甲磺酸阿帕替尼在晚期难治性骨与软组织肉瘤治疗中的临床应用观察
康建平 肖砚斌 董苏伟 李文忠 马翔 张漾杰 王雷 龚一帆
骨与软组织肉瘤包括骨肉瘤和软组织肉瘤(soft tissue sarcoma,STSs),是一类罕见且极其异质性较强的恶性肿瘤,从全身的间叶组织发展而来,如骨骼、肌肉、肌腱、脂肪、血管、淋巴管、神经和关节周围的组织[1]。肉瘤占成人恶性肿瘤的1%、儿童恶性肿瘤的15%。其中STSs 组织病理亚型多样,包括超过75种组织病理亚型,因此这些肿瘤常常难以诊断,治疗方法有限[2]。手术和化疗仍是治疗STSs 最主要的手段,阿霉素(ADM)+异环磷酰胺(IFO)为一线化疗主要方案[3]。治疗后复发转移率>50%。低恶性的在局部达到广泛切除后约90%左右可以达到治愈。肉瘤的预后与恶性程度有关,病理高级别的肉瘤患者,初诊时10%已发生转移,即使肿瘤局部控制良好,术后仍有40%~50%的患者会出现局部复发,>50%患者会发生肺等远处转移,预后极差。对于晚期难治性肉瘤的患者,分子靶向治疗和肿瘤免疫治疗逐渐成为首选的治疗方法,国内外已开展多种靶向药物的临床研究。截至目前,仅帕唑帕尼被美国食品药品监督管理局(FDA)批准用于晚期软组织肉瘤的二线治疗,但帕唑帕尼在中国尚未上市。血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(VEGFR),尤其是VEGFR-2所介导的信号级联通路是关键的调节途径,可以调控血管内皮细胞的增殖、迁移、生存以及通透性的改变,在促进肿瘤血管生成中发挥了重要作用[4]。目前,有报道研究显示,阿帕替尼在一些晚期软组织肉瘤治疗中表现出较好的疗效[5-7]。本研究回顾性观察阿帕替尼治疗21 例晚期难治性肉瘤的疗效及不良反应。
1 材料与方法
1.1 病例资料
选取云南省肿瘤医院2017年6月至2018年9月收治的Ⅲ期(根据Enneking 分期系统)骨与软组织肉瘤患者21例,纳入标准者:1)经病理学确诊的骨或软组织肉瘤患者;2)不能手术的局部晚期、复发或转移的肉瘤患者。
1.2 方法
1.2.1 研究设计 本研究回顾性观察阿帕替尼治疗晚期难治性肉瘤的疗效及不良反应,旨在探索阿帕替尼治疗晚期或转移性肉瘤患者的安全性与有效性。
1.2.2 给药方式 甲磺酸阿帕替尼片,500 mg,1 次/d,餐后0.5 h 服用(每日服药的时间应尽可能相同),以温开水送服。28 d为1个给药周期。至少连用1个周期,发生完全缓解(complete reponse,CR)、部分缓解(partial response,PR)和病情稳定(stable disease,SD)的患者继续给药直至疾病进展(progressive disease,PD)。不可耐受不良反应或患者要求停药或PD的患者则终止给药。出现Ⅲ级及以上不良反应的患者暂停用药,对症处理后予减量至250 mg使用,若再次出现Ⅲ级及以上不良反应,则停止用药。
1.2.3 疗效评价 服药前,全面收集1 次病史,包括既往治疗史、生命体征、体格检查、ECOG PS 评分、血压检测和心电图等,并进行实验室检查,包括血常规、血生化、肝肾功、凝血功能和大小便常规等,影像学检查包括原发病灶部位和(或)转移病灶部位的CT或MRI,作为对比基线。治疗第1 个疗程中,每周复查1次上述实验室检查项目及血压等,治疗的前4个疗程中,每个疗程结束时复查1次上述实验室检查及影像学检查,之后改为每2个疗程复查上述实验室检查及影像学检查,与基线对比,评估疗效。
1.2.4 不良反应评价 根据美国国家癌症研究所(NCI)4.0标准评价不良事件的严重程度,共分为0~Ⅳ级。
1.2.5 随访 主要疗效指标:无进展生存期(progression free survival,PFS)定义:服用阿帕替尼开始直至肿瘤进展或死亡时间。次要疗效指标:总生存期(overall survival time,OS)定义:从阿帕替尼治疗开始直至死亡或失访时间。其余疗效指标为:疾病控制率(disease control response,DCR)与客观缓解率(overall response rate,ORR)。根据实体瘤疗效评定标准RECIST 1.1评价临床疗效[8],分为CR、PR、SD、PD。ORR=CR+PR;DCR=CR+PR+SD。本研究从2017年6月开始随访,随访方式包括住院、门诊及电话随访,随访截止时间为2019年3月31日。无CR,PR患者2例(9.5%),SD患者7例(33.3%),PD患者12例(57.1%),ORR为9.5%,DCR为(42.8%)。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。所有的检验均采用双侧检验,生存分析采用Kaplan-Meier 法,组间差异采用Log-rank检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般情况
共有21例可供评价的晚期难治性肉瘤患者,其中男性12例(57%),女性9例(43%),年龄15~77岁,平均年龄38.3岁,19例(90%)患者ECOG评分0~1分,2例(10%)患者ECOG 评分2 分。病理类型:骨肉瘤5 例(23.8%),滑膜肉瘤4例(19.0%),纤维肉瘤2例(9.5%),上皮样肉瘤2例(9.5%),尤文肉瘤2例(9.5%),软骨肉瘤1例(4.8%),横纹肌肉瘤1例(4.8%),恶性纤维组织细胞瘤1例(4.8%),未分化肉瘤1例(4.8%),腺泡状软组织肉瘤1例(4.8%),透明细胞肉瘤1例(4.8%)。肿瘤原发部位:四肢14例(66.7%),躯干7例(33.3%)。主要转移部位为肺部(81.8%)。18例(81.8%)患者在阿帕替尼治疗前接受过手术治疗;16例(76.2%)患者在阿帕替尼治疗前接受过一线或二线化疗,化疗药物包括多柔比星、顺铂、异环磷酰胺、达卡巴嗪、长春新碱、甲氨喋呤、依托泊苷等;4例(19.0%)患者在阿帕替尼治疗前接受过放疗。患者一般情况见表1。
2.2 疗效评价
2.2.1 主要疗效指标 21 例患者均得到随访,本研究中21例患者mPFS为8个月。PFS生存曲线见图1。
2.2.2 次要疗效指标 次要疗效指标为OS,本研究中21例患者mOS为14个月。OS生存曲线见图2。
2.3 影响PFS的单因素分析
在影响PFS 的单因素分析中,对患者的性别、年龄、ECOG评分、组织来源、是否手术、是否化疗、是否放疗等情况对患者PFS 的影响进行单因素分析。分析结果见表2,图3。从该分析中可以看出,患者的性别、年龄、ECOG评分、组织来源、是否手术、是否化疗对患者PFS的影响差异无统计学意义(P>0.05),服用阿帕替尼前是否有放疗史仅该因素对患者PFS 的影响差异具有统计学意义(P<0.05),有放疗史患者的PFS低于无放疗史患者。
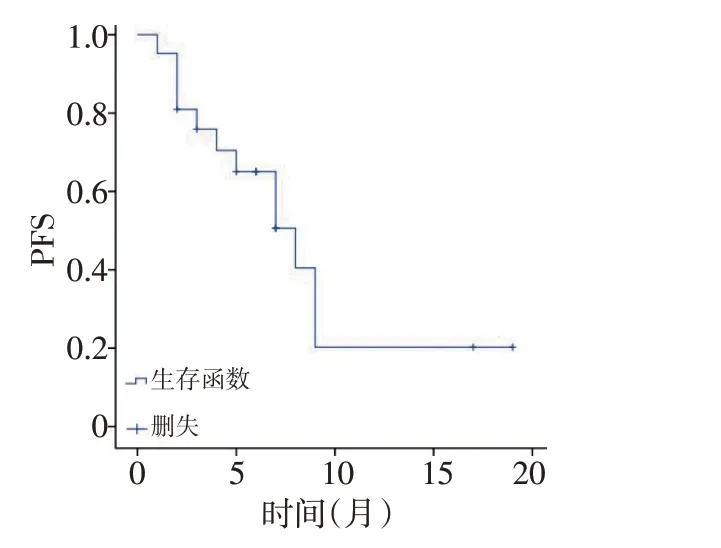
图1 接受甲磺酸阿帕替尼治疗的晚期难治性骨与软组织肉瘤患者无进展生存曲线
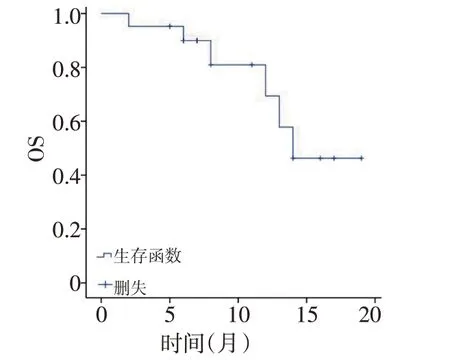
图2 接受甲磺酸阿帕替尼治疗的晚期难治性骨与软组织肉瘤患者总生存曲线
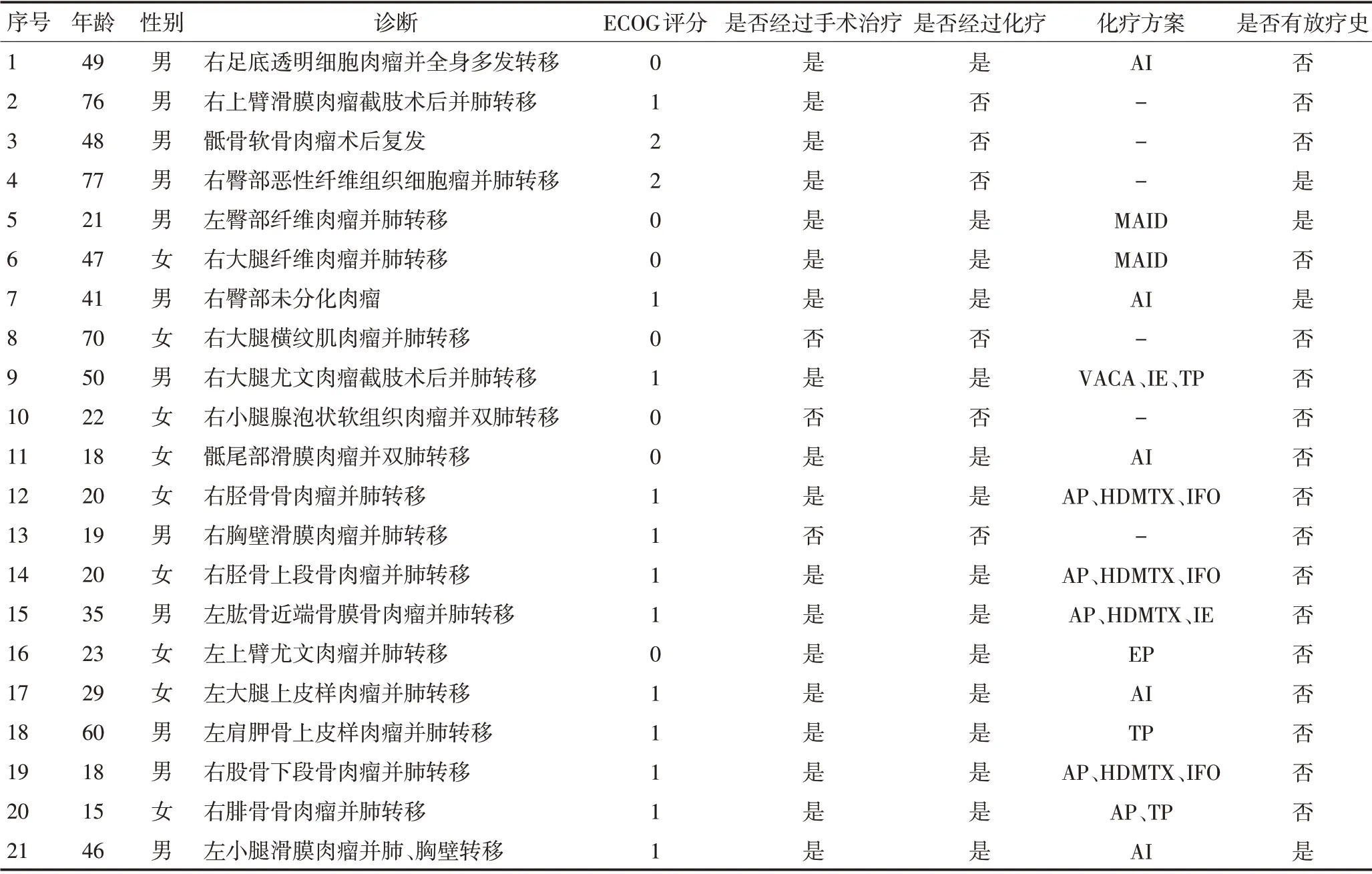
表1 21例Ⅲ期肉瘤患者的一般临床资料
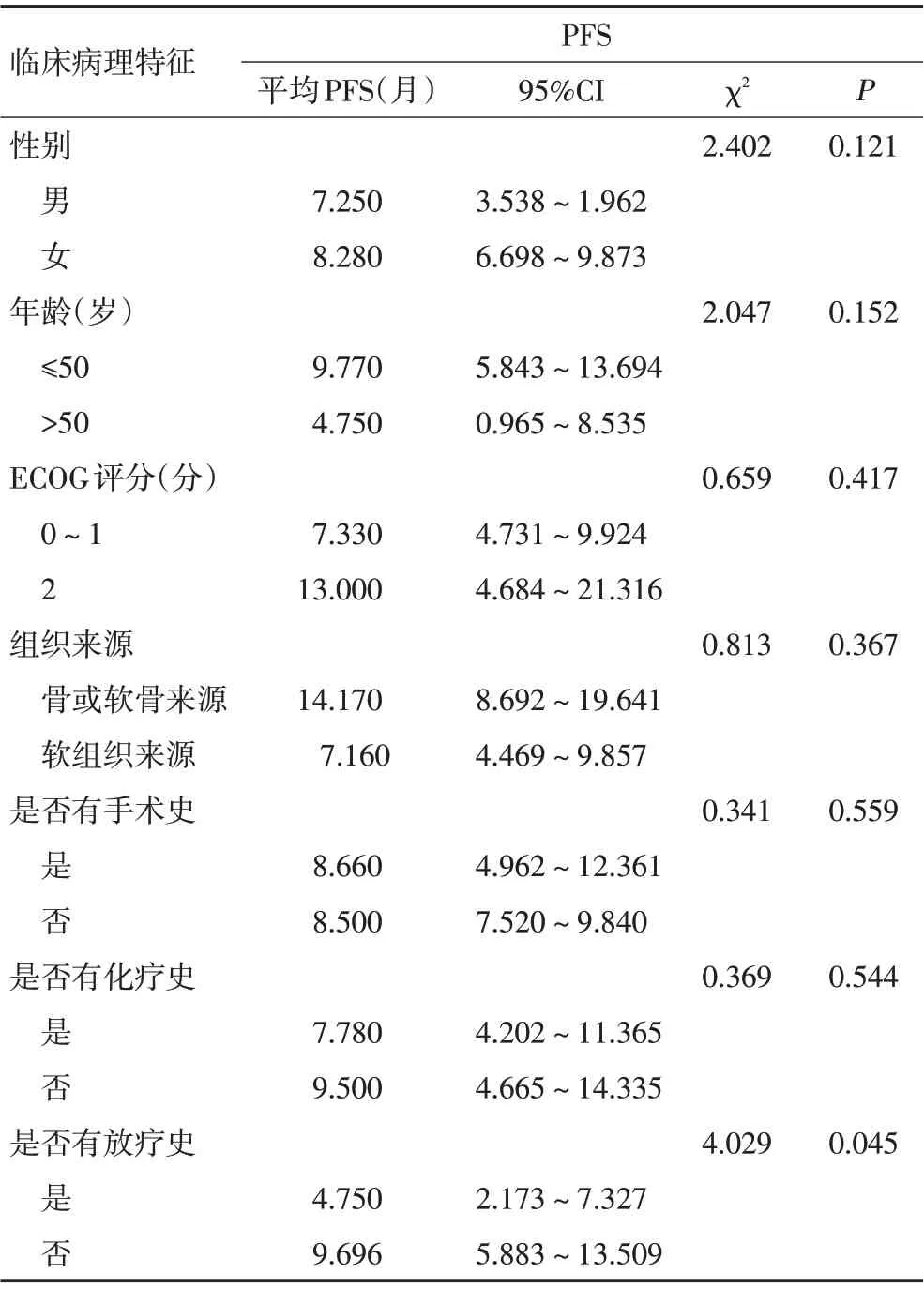
表2 患者临床、病理特征和无进展生存时间的单因素分析

图3 接受阿帕替尼治疗前及治疗1周期、2周期、5周期后影像
2.4 不良反应观察
本研究在随访观察中,常见的不良反应依次为手足综合征、疼痛、高血压、腹泻、贫血、气胸、口腔黏膜炎、蛋白尿、乏力、伤口愈合不良、睡眠障碍、声嘶、恶心和呕吐等,其中多数反应为Ⅰ~Ⅱ级,Ⅲ级及以上不良反应依次为手足综合征(14.3%)、气胸(14.3%)和贫血(4.8%)。具体发生病例数及比例见表3。
2.5 典型病例
患者女性,47岁,右大腿纤维肉瘤并肺转移。接受阿帕替尼治疗前及治疗1、2 和5 个周期后影像见图3,可见肺部转移病灶持续缩小。该例患者出现的不良反应主要为手足综合征、高血压和气胸。
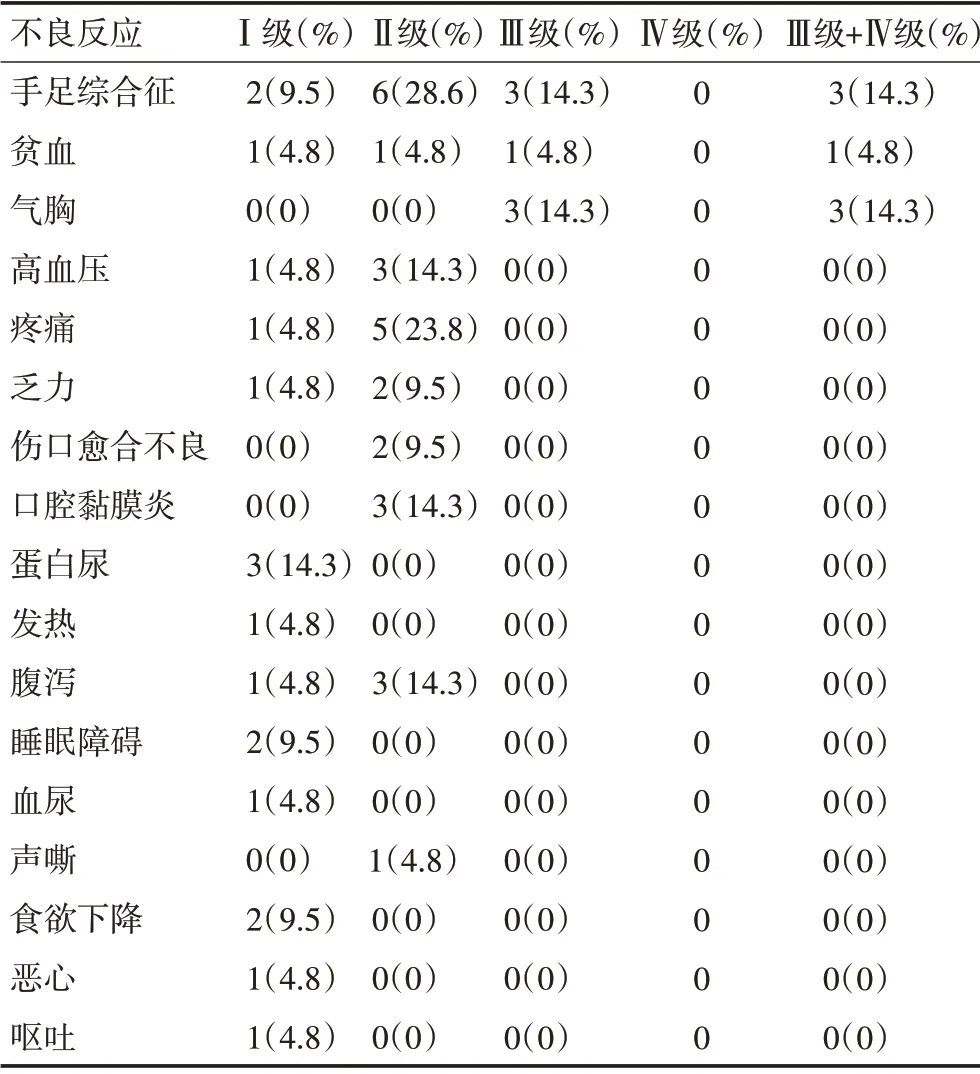
表3 不良反应发生病例数及分级比例
3 讨论
目前,对于骨与软组织肉瘤的治疗,仍以手术、化疗和放疗为主,其目的是抑制肿瘤的增殖、预防转移,从而提高生存率。但由于肉瘤的病理特点具有高度异质性,晚期难治性肉瘤的治疗仍无标准方法,许多指南、专家共识推荐该类患者参加临床试验[9-10]。在国内外众多研究中,关于肿瘤的生长与血管生成之间的关系尤为引人关注,肿瘤血管新生理论之父,美国国家科学院院士Folkman于1971年提出“当肿瘤的体积>2 mm3的时候,肿瘤的血供消失,肿瘤细胞会分泌出许多细胞因子,其能促进肿瘤的血管生成并使肿瘤出现浸润和转移”,随着该假说的提出,学界开始重点研究肿瘤血管生成的相关理论,并努力尝试转化为临床所用[11]。VEGF及其受体(VEGFR),尤其是VEGFR-2所介导的信号级联通路是其中关键的调节途径,可以调控血管内皮细胞的增殖、迁移、生存以及通透性的改变,在促进肿瘤血管生成中发挥重要作用[12]。甲磺酸阿帕替尼片是由中国拥有自主知识产权的小分子VEGFR酪氨酸激酶抑制剂PTK787的衍生化合物,阿帕替尼在很低的浓度即能有效抑制VEGFR,较高浓度还能抑制血小板源性生长因子受体(PDGFR)、c-Kit及c-Src等激酶。药效学研究表明阿帕替尼可抑制VEGFR酪氨酸激酶活性,阻断VEGF结合后的信号传导,导致肿瘤血管生成抑制。
2014年经中国国家食品药品管理监督总局批准(FDA),阿帕替尼用于晚期胃癌或胃食管结合部腺癌三线及三线以上治疗。对于骨与软组织肉瘤而言,目前仅帕唑帕尼被FDA批准用于晚期软组织肉瘤的二线治疗、伊马替尼可用于无法手术切除或复发、转移的隆突性皮肤纤维肉瘤的治疗,但帕唑帕尼在中国尚未上市。因此,众多研究者把目光瞄向了中国自主研发的小分子VEGFR 酪氨酸激酶抑制剂-阿帕替尼。2016年ASCO 会议报道青岛大学附属医院张晓春教授的阿帕替尼治疗晚期肉瘤的初始临床经验,收集了2014年12月至2015年5月接受阿帕替尼治疗的6例肉瘤患者并进行回顾性分析,所有病例诊断均经病理证实,其中软组织肉瘤2 例,腹腔肉瘤1例,骨肉瘤1 例,乳腺肉瘤1例,软骨肉瘤1 例,男性3例,女性3例。服用阿帕替尼治疗1个月后进行影像学评估,6例患者中3例达PR,3例SD。Zhu等[13]的报道中,有31 例骨与软组织肉瘤患者应用阿帕替尼治疗,其临床获益率为75.0%,mPFS 时间为4.25 个月,mOS为9.43个月;Zhou等[14]报道了1例骨肉瘤并肺转移患者应用阿帕替尼疗效,其PFS 为11 个月;Ji 等[15]报道了1 例晚期恶性纤维组织细胞瘤患者接受阿帕替尼治疗2 个周期后,肺部转移病灶获得PR;Li 等[6]报道了16例晚期骨与软组织肉瘤患者使用阿帕替尼的疗效,2例获得PR,mPFS达8.84个月。在上述个案及小样本报道的支持下,本研究纳入21 例晚期难治性骨与软组织肉瘤患者予以甲磺酸阿帕替尼治疗,以观察其有效性及安全性。
本研究中,21例患者mPFS为8个月,该结果与Li等[6]所报道的阿帕替尼治疗晚期骨与软组织肉瘤所获得的结果8.84 个月相仿;与帕唑帕尼治疗晚期转移性软组织肉瘤所获得的PFS(4.6 个月)[16]相比,超出3.4 个月。另外,本研究所获得mOS 为14 个月,该结果远大于其他研究所获得的mOS,原因可能并非本研究真正获得较长的mOS,而是可能和随访时间较短引起数据分析统计中删失结果较多,到达终点事件的结果较少有关;另一方面,部分患者疾病进展出组后,综合阿帕替尼的治疗,转而尝试其他靶向药物的治疗,如帕唑帕尼、安罗替尼、舒尼替尼等,上述因素均影响OS。在影响PFS 的单因素分析中,本研究显示患者的性别、年龄、ECOG 评分、组织来源、是否手术、是否化疗对患者PFS的影响未显示差异无统计学意义(P>0.05),仅服用阿帕替尼前是否有放疗史这一因素对患者PFS 的影响显示差异具有统计学意义(P<0.05),有放疗史患者的PFS 低于无放疗史患者,然而,在其他学者的研究中,放疗联合抗血管生成药物治疗这一治疗模式在多种实体瘤中都显现出良好的效果[17-19],分析原因可能是因为有放疗史的患者相较无放疗史的患者,病情较重,经过手术、化疗和放疗等多种治疗办法后仍不能控制肿瘤生长和转移,最终选择使用阿帕替尼治疗,最后导致了有放疗史患者的PFS低于无放疗史患者。同时,本研究有放疗史患者4例,样本量小,有可能是偏倚引起,最终结论有待继续扩大样本量后再行分析。由于本研究中入组患者数量较少且病种分散,因此仅将入组患者的病灶组织来源简单地分为骨或软骨来源、软组织来源两大类,尽管统计学结果显示这两大类组织来源对患者PFS 无影响,但是从生存曲线上看,骨或软骨来源的肉瘤显示出了更好的PFS倾向,在Sulzbacher 等[20]的研究中证明其具有高VEGF 表达的骨肉瘤患者显示出OS较短的趋势,而作为小分子VEGFR酪氨酸激酶抑制剂的阿帕替尼则能够诱导骨肉瘤细胞的自噬和凋亡通过使VEGFR-2/STAT3/BCL-2 途径失活[18],阿帕替尼在骨肉瘤中的疗效是否比软组织肉瘤好亟需进一步研究。
本研究在随访观察中,常见的不良反应依次为手足综合征、疼痛、高血压、腹泻、贫血、气胸、口腔黏膜炎、蛋白尿、乏力、伤口愈合不良、睡眠障碍、声嘶、恶心、呕吐等,其中多数反应为Ⅰ~Ⅱ级,Ⅲ级及以上不良反应依次为手足综合征(14.3%)、气胸(14.3%)和贫血(4.8%)。对于大多数Ⅰ~Ⅱ级不良反应,通过药物调整剂量后可以得到逆转。对于服药过程中出现的高血压症状,这可能与体循环血管阻力增高有关,阿帕替尼抑制血管内皮生长,使得VEGF 信号通路受阻,减少了一氧化氮的释放,导致血管僵硬致收缩,进而增高血管阻力,引发高血压[18]。同时,也与患者的精神压力有关,由于肿瘤患者往往压力较大,会促使交感神经系统亢奋,使得血浆儿茶酚胺浓度增高,小动脉及毛细管动脉收缩增强,激活肾素-血管紧张素-醛固酮系统,导致血压升高[19]。针对高血压这一不良反应,同样可以通过药物剂量调整和(或)辅以使用降压药物亦可将血压调整至140 mmHg/90 mmHg左右。目前,对于抗肿瘤药物引起手足综合征的机制尚未明确,但有报道称,抗肿瘤药物引起手足综合征可能是由于血浆浓度达到峰值或是药物在体内累积剂量过大引起,亦可能与足部、手等部位丰富血液、汗腺发达、温度较高、局部压力、皮肤二氢嘧啶脱氢酶活性低和胸苷磷酸化酶高表达等有关[20]。使用凡士林软膏、京万红软膏等保持皮肤的湿润;外出时涂抹防晒霜或者打伞等减少紫外线的吸收;日常运动以散步、慢走为宜;休息时适当抬高肢体可避免血液的瘀积等方法均可缓解这一症状[21]。
值得引人注意的是,本研究中曾出现第1例患者气胸(14.3%)这一不良反应。随即查阅相关文献后罕有阿帕替尼治疗后出现气胸的报道。在随后的观察随访时间里,相继出现2例患者发生气胸症状。再次复习相关文献,既往有国外研究者报道在应用帕唑帕尼过程中出现了气胸症状[22]。关于气胸的发生原因有多种原因,有研究[23]认为可能与肺转移瘤的胸膜侵犯和靶向治疗引起的肿瘤坏死及空洞形成有关。另外,刘佳勇等[24]的观点认为:靶向药物引起的气胸还可能与肿瘤的亚型相关。在应用盐酸安罗替尼胶囊治疗晚期软组织肉瘤Ⅱb 期多中心临床试验中,有14 例腺泡状软组织肉瘤被纳入实验组,其中1例腺泡状软组织肉瘤患者发生气胸,其研究者分析认为腺泡状软组织肉瘤特殊的缓慢生长方式可能不易导致胸膜的破坏。因此,在经过靶向治疗后,肿瘤即使坏死,也并不容易导致气体渗漏。本研究中随访发现的3 例气胸很有可能与服用阿帕替尼相关。有研究提示,经过帕唑帕尼治疗后,气胸的发生率约为7.0%~10.3%[25-26]。与本研究对比后可以发现阿帕替尼治疗骨与软组织肉瘤后引起气胸症状可能性稍大。当然,本研究样本量较小,证据尚显不足。
综上所述,甲磺酸阿帕替尼在治疗晚期难治性骨与软组织肉瘤中显现出一定的疗效,不良反应总体来说是可预见、可控制和可逆转的,对于治疗依从性良好、无其他治疗方法可选择的晚期难治性骨与软组织肉瘤的患者可以尝试使用。但是本研究样本量小,亟需扩大样本量进一步研究。
——评《卵巢恶性肿瘤诊疗手册》

