羧基化多壁碳纳米管净化-气相色谱/质谱联用技术测定土壤中18种多氯联苯
"刘腾飞,杨代凤,范 君,毛 健,孙灵湘,董明辉
(江苏太湖地区农业科学研究所,江苏苏州215155)
多氯联苯(Polychlorinated Biphenyls,PCBs)是环境中存在的一类典型的持久性有机污染物,其具有高毒、难降解、易迁移和生物累积等特性,虽然在全球范围内禁用多年,但在多种环境介质[1-3]中仍广泛检出。土壤是环境中PCBs最重要的赋存介质,土壤中的PCBs可通过食物链传递和富集,经饮食摄入等途径进入生物体内产生毒害作用。因此,建立快速、准确地检测土壤中PCBs的方法,对于保护环境和农产品安全具有重要意义。
气相色谱/质谱法(GC/MS)[1,4-6]是目前测定土壤中PCBs最常用的方法。但土壤基体复杂,当待测物PCBs含量较低时,提取液中的杂质对待测物的测定干扰极大,因此必须对土壤提取液进行净化处理。现有净化技术[5-9]大多操作繁琐、速度慢、效率低,影响样品检测的时效性。多壁碳纳米管(MWCNTs)是一种具有大比表面积和较强吸附性能的纳米碳材料,近年来作为一种理想的净化材料而被广泛应用[10],尤其是经过羧基化改性后,其比表面积和分散性增加,吸附能力增大,目前在农药[11]、兽药[12]、抗生素[13]等有害物质的残留检测中得到良好应用。本文作者[14-15]前期将羧基化多壁碳纳米管(MWCNTs-COOH)与N-丙基乙二胺(PSA)联用,成功用于茶叶及茶青样品中PCBs检测的净化过程,获得了优异的净化效果,但对于土壤中PCBs检测的研究尚未见报道。因此,本文利用MWCNTs-COOH作为吸附材料,基于分散固相萃取(DSPE)技术,建立了一种快速、准确地同时测定土壤中18种PCBs的GC/MS方法,该方法前处理简单,净化效果好,为土壤中PCBs污染物的监测提供了一种新方法。
1 实验部分
1.1 仪器、试剂与材料
7890B-5977A气相色谱-质谱联用仪(美国,Agilent);KQ-500DE超声波清洗器(昆山超声仪器公司);TG16-WS台式高速离心机(湖南湘仪实验仪器公司);K600粉碎机(德国,博朗);HSC-24B氮吹仪(天津恒奥科技公司);Direct-Q 5UV型超纯水机(美国,Millipore)。
18种PCBs混合标准贮备溶液:PCB28、PCB52、PCB101、PCB118、PCB153、PCB138、PCB180、PCB81、PCB77、PCB123、PCB114、PCB105、PCB126、PCB167、PCB156、PCB157、PCB169、PCB189(质量浓度均为10mg/L,美国o2si)。标准溶液的配制:准确吸取10mg/L的18种PCBs混合标准溶液1mL,置于10mL容量瓶中,用正己烷定容,配成1mg/L的混合标准溶液,于4℃冰箱冷藏保存;使用前,取出放至室温后,用正己烷逐级稀释成5、10、50、100和500μg/L的混合标准工作溶液。基质匹配标准溶液的配制:称取空白试样,按照最优化提取净化条件处理后,上机样液用氮气吹干,加入1.0mL不同浓度的混合标准工作溶液,振荡混匀,过0.22μm有机滤膜,得到对应浓度的基质匹配标准溶液。
羧基化多壁碳纳米管(长度:10~30μm,外径:10~20nm,内径:5~10nm,纯度:>95%,比表面积:>200m2/g),N-丙基乙二胺(PSA,粒度40~60μm),石墨化碳黑(GCB,粒度40~120μm),十八烷基键合硅胶(C18,粒度40~60μm)(南京先丰纳米材料科技有限公司);正己烷(色谱纯,瑞典欧普森);丙酮,甲苯(分析纯,上海国药集团);无水Na2SO4(分析纯),使用前于450℃下灼烧4h;无水MgSO4(分析纯),使用前于620℃下灼烧4h。实验用水为超纯水。
1.2 样品制备及前处理
在当地某农产品(蔬菜、水稻、小麦)生产基地,采集纵向深度为0~15cm的表层土壤样品。将土样除去草根、石块等杂物,在干燥通风自然条件下阴干,干燥后的土壤经四分法缩分,过2mm筛,取一定量装入自封袋中密封,于阴凉干燥条件下储存。称取2.0g土壤样品于50mL塑料离心管中,加水0.5mL,涡旋混匀,浸润,加入1g无水Na2SO4和5mL丙酮-正己烷(1∶1,V/V)提取液,涡旋混匀,在500W功率下超声提取15min,期间取出振摇2次,8 000r/min离心4min,取2.5mL上清液至试管中,氮吹至近干,加入甲苯5mL,涡旋混匀,待净化。向待净化液中加入0.02g MWCNTs-COOH和0.1g无水MgSO4,涡旋2min,以9 000r/min离心5min,取上清液氮吹至近干,加入1.0mL正己烷,涡旋混匀,过0.22μm有机膜,待测。
1.3 仪器条件
色谱条件:HP-5MS石英毛细管柱(30m×0.25mm×0.25μm);进样口温度250℃;载气为高纯氮气;恒流模式,流速1.2mL/min;不分流进样;进样量1.0μL。升温程序:初温80℃,保持2min;以20℃/min升温至180℃,保持2min;再以3℃/min升温至230℃,保持2min;再以10℃/min升温至280℃,保持2min。
质谱条件:电子轰击(EI)离子源,电离能量70eV,离子源温度280℃,四极杆温度150℃,传输线温度280℃,检测方式:选择离子扫描(SIM),溶剂延迟5min。
2 结果与分析
2.1 仪器条件的优化
实验根据18种PCBs的极性,选用弱极性、低流失的HP-5MS毛细管柱进行色谱分离,并根据灵敏度和分析时间,通过优化色谱升温程序、载气流速、进样口温度等参数,最终确定1.3色谱条件。在选定的色谱条件下,利用GC/MS全扫描方式,在m/z50~450范围内对500μg/L的PCBs混合标液进行分析,得到总离子流(TIC)色谱图,根据TIC谱图通过NIST标准谱库检索,确定各目标物的保留时间,并在扣除背景后的质谱图中,选择丰度高、m/z大且基质干扰少的特征离子,分时段分别监测。18种PCBs的保留时间、特征离子及其丰度比参见文献[15]。最优条件下的GC-MS色谱图见图1。
2.2 提取条件的优化
2.2.1 提取溶剂的选择 PCBs为弱极性的疏水物质,根据相似相溶原理,采用正己烷为提取溶剂比较理想,加入适量丙酮对样品有一定的渗透作用,有助于提高提取效率。由于土壤样品含水分少,提取溶剂不易渗透,实验在10μg/kg加标水平下,首先比较了加水与不加水对18种PCBs提取效果的影响。结果(图2)显示,土壤在不加水的情况下,18种待测物的回收率为88.9%~97.3%,加入0.5mL水浸润后,回收率可提高至93.1%~109.1%,表明土壤加水浸润后,能在一定程度上改善提取效果,因此实验中将土壤样品加水浸润后再进行提取。在此条件下,分别以丙酮-正己烷(0∶1、1∶1、1∶2)作为提取溶剂考察对待测物的提取效率。结果(图3)表明,以丙酮-正己烷(0∶1)为提取溶剂时,待测物的提取效率较差,回收率均低于15%;以丙酮-正己烷(1∶1)为提取溶剂时,待测物的提取效率最佳,回收率为94.7%~109.3%,优于丙酮-正己烷(1∶2)为提取溶剂时的回收率(88.0%~99.5%)。故选择丙酮-正己烷(1∶1)作为最佳提取溶剂。
在此基础上,考察了不同体积(5、8、10、12、15mL)提取溶剂对待测物提取回收率的影响。结果显示,当提取溶剂体积为5mL时,所有待测物均可达到较好的提取效果,回收率为92.5%~108.0%,因此实验选择5mL作为最佳提取溶剂体积。

图1 18种PCBs标准溶液(10μg/L)的选择离子色谱图Fig.1 SIM chromatogram of 18PCBs(10μg/L)standard solution1.PCB28;2.PCB52;3.PCB101;4.PCB81;5.PCB77;6.PCB123;7.PCB118;8.PCB114;9.PCB153;10.PCB105;11.PCB138;12.PCB126;13.PCB167;14.PCB156;15.PCB157;16.PCB180;17.PCB169;18.PCB189.

图2 加水与否对土壤中18种PCBs加标回收率的影响Fig.2 Effect of water added or not on recoveries of 18 PCBs spiked in soil
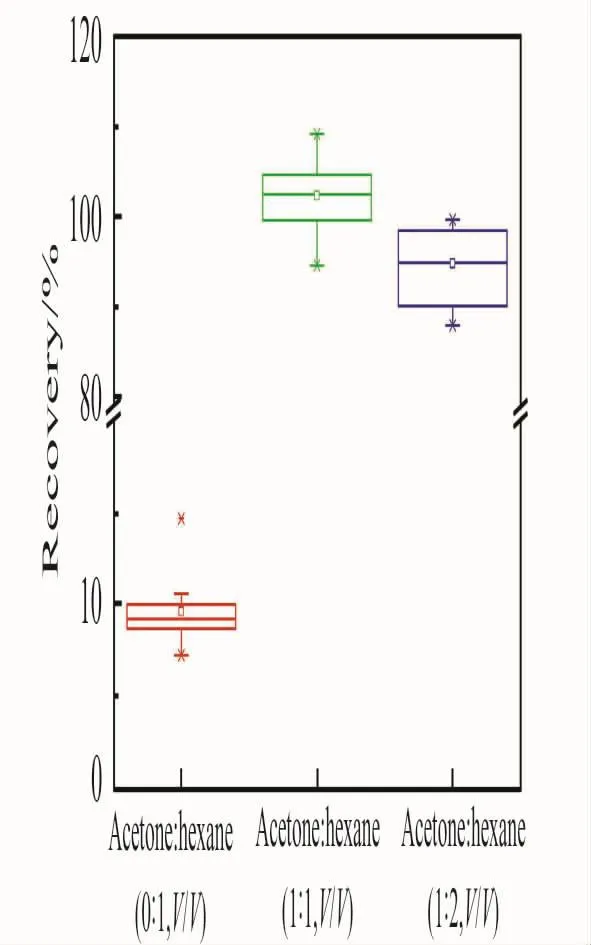
图3 不同提取溶剂对18种PCBs提取回收率的影响Fig.3 Effect of different extraction solvents on recoveries of 18PCBs
2.2.2 提取方法的选择 实验采用超声提取方法提取土壤中的18种待测物,并在10μg/kg加标水平下,考察了超声提取时间(5、10、15、20min)对待测物提取效率的影响。结果显示,当超声提取时间为5min时,18种待测物的回收率为61.5%~72.3%,回收率随着超声提取时间的增加而增大,当超声提取时间为15min和20min时,待测物的回收率分别为94.0%~104.3%和96.9%~106.4%。综合考虑回收率和分析时间,实验选择超声提取时间为15min。
2.3 净化条件的选择
2.3.1 吸附剂种类和用量 实验选择MWCNTs-COOH、GCB、C18和PSA为DSPE吸附剂,分别对加标浓度10μg/kg的土壤提取液进行净化,比较4种吸附剂的净化效果。从净化液颜色来看,经过超声提取后,土壤提取液呈浅黄色,经MWCNTs-COOH吸附剂净化后呈无色透明状态,经其余吸附剂净化后,溶液仍具有一定颜色;从回收率来看,以C18和PSA为吸附剂,18种待测物的回收率分别为80.2%~113.1%和80.9%~105.3%,而以MWCNTs-COOH和GCB为吸附剂,大多数待测物的回收率较差,低于70%,其中PCB81、PCB77、PCB126、PCB169 4种待测物的回收率均为0,这是由于2种吸附剂对平面结构分子具有极强的亲和力[16],而本研究中18种待测物分子因含有平面苯环而被吸附,从而导致回收率偏低。实验在提取后浓缩过程中,以甲苯对提取剂丙酮-正己烷(1∶1)进行溶剂置换后再净化,发现待测物的回收率得到了明显提高,分别为91.9%~100.2%和88.9%~104.9%,说明加入甲苯通过竞争关系改善了2种吸附剂对平面结构分子的吸附。进一步考察了甲苯用量(2、3、4、5、6mL)对待测物回收率的影响。结果显示,随着甲苯用量的增加,待测物的回收率呈增大趋势,当其用量为5mL时回收率分别为93.0%~105.5%和97.8%~109.2%,继续增大甲苯用量至6mL时,回收率变化不大,因此选择甲苯的最佳用量为5mL。综合净化效果和回收率因素,实验选择MWCNTs-COOH为最佳吸附剂。
在10μg/kg加标水平下,比较了不同 MWCNTs-COOH 用量(0.01、0.02、0.03、0.04g)对18种待测物回收率的影响。结果显示,MWCNTs-COOH对土壤提取液净化效果显著,随着其用量的增大,提取液颜色逐渐变浅,但部分待测物因被吸附剂吸附,造成回收率下降。当其用量为0.02g时,提取液趋于澄清透明,且所有待测物回收率均在91.9%~109.3%之间。因此,选择MWCNTs-COOH的最佳用量为0.02g。
图4为土壤提取液未经净化和经0.02g MWCNTs-COOH净化后的GC-MS色谱图。结果显示,MWCNTs-COOH可有效除杂,样品净化效果较好。
2.3.2 净化时间的选择 实验在10μg/kg加标水平下,按1.3.3方法,设置涡旋净化时间分别为1、2、3、4min,考察净化剂作用时间对待测物净化效率的影响。结果(图5)显示,当净化时间为2min时,18种待测物的净化效率最好,回收率为98.1%~109.3%。继续延长净化时间,部分待测物被吸附剂吸附,导致回收率下降。故选择最佳吸附净化时间为2min。
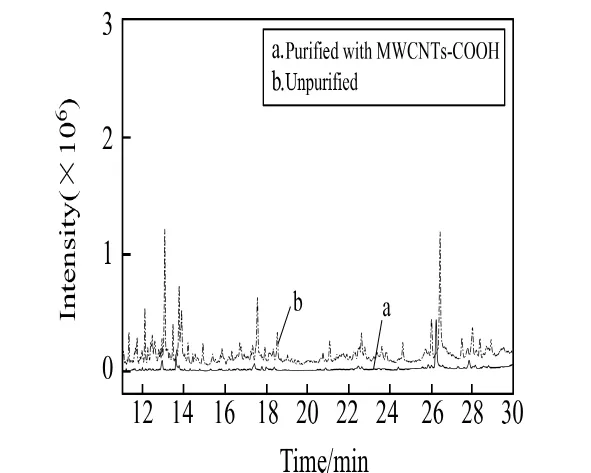
图4 土壤提取液未经净化(b)和经 MWCNTs-COOH净化(a)后的色谱图Fig.4 Chromatograms of soil extraction unpurified and purified with MWCNTs-COOH

图5 净化时间对土壤中18种PCBs加标回收率的影响Fig.5 Effect of cleanup time on recoveries of 18PCBs spiked in soil
2.4 基质效应
实验以基质匹配标准曲线斜率与纯溶剂标准曲线斜率比值评判基质效应的程度[17]:比值>1,表明存在基质增强效应;比值<1,存在基质抑制效应;比值越接近1,则基质效应越小;当比值远离1,表明存在明显的基质效应。表1结果显示,18种待测物的标准曲线斜率比值均>1,表明存在基质增强效应。为降低基质效应给结果带来的误差,本方法在实际土壤样品检测中采用基质匹配标准溶液进行定量。
2.5 线性范围、检出限和定量限
配制质量浓度为5、10、50、100、500μg/kg的基质标准工作溶液分别进行测定,以各PCBs定量离子的峰面积(y)对其质量浓度(x)绘制基质标准曲线,结果见表1。结果显示,18种待测物在5~500μg/kg范围内线性关系良好,相关系数不低于0.9998。以最低加标水平样品色谱图的3倍信噪比(S/N)和10倍S/N确定方法的检出限(LOD)和定量限(LOQ)分别为0.5~1.4μg/kg和1.6~4.4μg/kg,见表1。

表1 18种PCBs的回归方程、相关系数、线性范围、基质效应、检出限和定量限Table 1 Regression equations,correlation coefficients(r),linear ranges,matrix effects,limits of detection(LOD)and limits of quantitation(LOQ)for 18PCBs

(续表1)
2.6 回收率与精密度
称取空白土壤样品,按5、10、100μg/kg 3个添加水平进行加标回收实验,每个水平做6次平行,采用本方法进行前处理和测定,计算加标回收率和相对标准偏差(RSD)。结果显示,在3个加标水平下,18种待测物的平均回收率为90.1%~111.7%,RSD为1.2%~15.3%(表2),表明该方法稳定、可靠。

表2 18种PCBs在土壤中的加标回收率及相对标准偏差(n=6)Table 2 Average recoveries and relative standard deviations(RSDs)of 18PCBs in spiked soil samples(n=6)
2.7 与文献方法的比较
将本方法与文献报道的方法[11-14,31]从样品处理时间、试剂用量、准确性、检出限等方面进行比较,结果见表3。与其他方法相比,本方法具有前处理时间短、溶剂消耗少、操作简单、快速等优点,因此可作为土壤中PCBs快速检测的有效方法。

表3 本方法与文献方法对土壤中PCBs检测结果的比较Table 3 Comparison of this method with other methods reported in the literatures for the determination of PCBs in soil
2.8 实际样品分析
采用该方法对当地农产品生产基地182个土壤样品进行分析。在被检测的土壤样品中,有9.9%(18个)的土壤样品检出PCBs,含量在4.6~22.7μg/kg之间,远高于我国背景地区/农村中PCBs的土壤背景值(0.424μg/kg)[18],其中有55.6%(10个)的土壤样品中PCBs含量在5.8~22.7μg/kg之间,高于全球土壤背景值(5.41μg/kg)[19]。由于PCBs可通过食物链威胁人体健康,因此该地区产地土壤中PCBs污染问题应引起重视。
3 结论
本文建立了测定土壤中18种PCBs的分散固相萃取净化及GC/MS检测方法。土壤基质复杂,含有较多的干扰杂质,经优化试验,样品经丙酮-正己烷(1∶1)超声波提取,甲苯溶剂置换后,采用 MWCNTs-COOH DSPE净化,获得了较好的提取效率和净化效果,18种待测物的加标回收率在90.1%~111.7%之间,RSD(n=6)低于15.3%,LOD为0.5~1.4μg/kg,LOQ为1.6~4.4μg/kg。该方法操作简单,净化效果好,准确度高,稳定性好,为开展土壤中PCBs的检测分析提供了有效方法。

