氮硫掺杂荧光碳点测定菇类食品中维生素B2的研究
李 宏,赵纯希,王翰墨,侯朝祥,周继伟,杨亚玲*
(1.云南省农业科学院农产品加工研究所,云南昆明650200;2.昆明理工大学生命科学与技术学院,云南昆明650500)
维生素B2(VB2)又名核黄素,属于水溶性维生素,在中性和酸性溶液中加热能稳定存在。维生素B2是人体所必需的维生素,是体内黄酶类辅基的组成部分,参与体内许多酶系统的重要辅基的组成,与机体内各种物质和能量代谢密切相关[1]。当体内维生素B2缺乏时就会引发为口、眼等部位的炎症,表现为口角炎、舌炎、唇炎、眼结膜炎等[2-3]。体内维生素B2的储存是很有限的,因此机体都要从食物中摄入。适量的维生素B2摄入能够保证机体各种代谢的正常。目前测定维生素B2的方法有多种,例如高效液相色谱法[4-6]、毛细管电泳法[7]、荧光法[8]、电化学法[9-11]等。但是这些方法存在有的时间冗长,有的过程繁杂等不足。
相对于传统的半导体量子点,碳点(Carbon Dots,CDs)具有低毒性、环境友好等优点而受到研究者们的关注。CDs是一种新型的具有荧光特性的纳米碳材料,尺寸较小,一般在10nm以下[12]。由于CDs具有半导体量子点所没有的优点,所以其有广泛的应用前景,包括传感[13-17]、细胞成像[18-20]和药物传递[21]。除了一般含有C、N、O元素的CDs外,掺杂CDs也越来越被人们所关注,例如掺杂N、S、B、P等元素的CDs[22-25]。许多研究表明掺杂CDs具有更高的荧光量子产率[26-27]。近年来,有研究将荧光共振能量转移(FRET)的原理应用于维生素B2的测定。钟文英等[28]用以谷胱甘肽为稳定剂合成的ZnSe量子点(供体)与维生素B2(受体)组成FRET体系,确定两者之间发生FRET的最佳条件,建立了FRET的荧光猝灭法测定维生素B2的含量。基于FRET测定维生素B2的含量为维生素B2的测定提供了新思路。
本研究用尿素和半胱氨酸通过水热法合成了同时掺杂N、S元素的碳点(N,S-CDs),所合成的N,SCDs具有良好的荧光性质、水溶性以及较高的荧光量子产率。合成的N,S-CDs用透射电镜(TEM)、傅里叶变换红外(FT-IR)光谱、X射线光电子能谱(XPS)等进行表征,并将其与维生素B2组成FRET体系用于维生素B2的含量检测。结果表明,维生素B2的浓度在1.0×10-7~1.5×10-5mol/L范围内与 N,S-CDs荧光猝灭程度呈良好线性,相关系数为0.9911,检出限为5.0×10-8mol/L。此方法用于实际样品检测,加标回收率为97.2%~104.3%,为维生素B2的分析研究提供了一种新方法。
1 实验部分
1.1 仪器与试剂
Tecnai G2型透射电子显微镜(美国,FEI公司);EDX-3600B型能谱(XPS)分析仪(江苏天瑞公司);UV-2500型紫外-可见分光光度计(日本,岛津公司);G9800A型荧光分光光度计(美国,安捷伦公司);TENSOR27型傅里叶变换红外光谱仪(德国,布鲁克公司)。
尿素、半胱氨酸、维生素A、维生素B1、维生素B2、维生素C、谷胱甘肽、葡萄糖、果糖、麦芽糖均购自阿拉丁试剂有限公司;草酸、NaCl、KCl、ZnSO4、CaCl2、CuSO4、MnCl2、FeCl3均购自天津化学试剂有限公司。所有试剂均为分析纯,使用前未经任何处理。实验用水为超纯水。
实验中所用的香菇、冬菇、元菇和杏鲍菇均购买于当地超市。
1.2 实验方法
1.2.1 N,S-CDs的合成 分别称取尿素和半胱氨酸各0.5g,溶于100mL超纯水中,然后将溶液转移到聚四氟乙烯内衬的反应釜中,置于马弗炉中,在180℃下反应6h。反应结束后,自然冷却至室温。然后将溶液在10 000r/min下离心20min,用0.22μm的滤膜抽滤并将滤液透析24h。所得溶液即为纯化的N,S-CDs,在4℃下保存备用。
1.2.2 样品的前处理 实验中选择菇类为检测对象。将晒干的菇类粉碎,然后称取2g粉末于烧杯中,加入20mL 0.1mol/L HCl,称重。加热煮沸30min,自然冷却至室温后,称重并补足重量。然后滴加3mL 2.5mol/L NaAc,过滤,将滤液定容到25mL的容量瓶中,待用。
1.2.3 维生素B2的检测 取5μL N,S-CDs溶液于10mL的离心管中,用超纯水稀释到3mL,然后将不同浓度的维生素B2标准溶液或经过处理的样品加入其中,并在激发波长为350nm、发射波长为440nm下测定荧光强度。
CDs的合成及其检测维生素B2的机理图如图1所示。
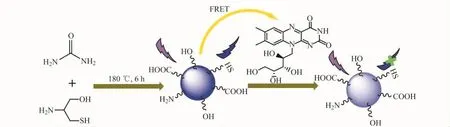
图1 N,S-CDs的合成及其检测维生素B2示意图Fig.1 Schematic illustration of the synthesis of N,S co-doped CDs and application for the detection of vitamin B2
2 结果与讨论
2.1 N,S-CDs的表征以及性质研究
图2A为N,S-CDs的TEM图,从图中可以看出合成的N,S-CDs呈球形,且粒径均匀,分散性较好,粒径分布如图2A中插图所示,大约为2.8±0.4nm。
图2B为N,S-CDs的FT-IR光谱图,图中3 400cm-1处左右的宽峰对应O-H、N-H的伸缩振动;在2 943、2 306、1 601cm-1处的峰对应C-H、S-H 和 C=O的伸缩振动;在1 406、1 118、1 039cm-1处的峰对应C-N、C-S和C-O的伸缩振动。
图2C为 N,S-CDs的 XPS的全谱图,在531.9、400.5、284.3、164.3eV 处有四个峰,分别对应于O 1s、N 1s、C 1s和S 2p。C 1s能谱图中在284.3、285.1、285.4、286.0、286.5、288.3eV 处的峰分别为C-C、C-H、C-S、C-N、C-O和C=O的特征峰。N 1s能谱图中在399.2、401.1eV处的两个峰为C-N和N-H的特征峰。O 1s能谱图中在531.6、532.2eV处的两个峰为C=O和C-O的特征峰。S 2p能谱图中在163.5、164.8eV处的两个峰为S 2p3/2和S 2p1/2的特征峰。XPS的分析结果基本与FTIR的一致。因此,所合成的N,S-CDs含有羧基、氨基、羟基、巯基等官能团,具有良好的水溶性。

图2 (A)N,S-CDs的透射电镜(TEM)图;(B)N,S-CDs的FT-IR光谱图;(C)N,S-CDs的XPS谱图Fig.2 (A)TEM image of N,S-CDs;(B)FT-IR spectrum of N,S-CDs;(C)XPS spectrum of N,S-CDs
图3 (A)为N,S-CDs的紫外-可见吸收光谱和荧光光谱。从图中可以看出其在236nm和336nm处有两个吸收峰,最大发射波长为350nm,最大激发波长为440nm。图(3)B为N,S-CDs在不同激发波长下的发射光谱图,当激发波长逐渐增大时发射波长无明显变化,并在激发波长为350nm处荧光强度最强。以硫酸奎宁(54%,0.1mol/L H2SO4)为参考物质,测得该N,S-CDs的荧光量子产率大约为21%。

图3 (A)N,S-CDs的紫外-可见吸收光谱和荧光光谱;(B)不同激发波长下的发射光谱图Fig.3 (A)The UV-Vis absorption spectra and fluorescence speatra of the N,S-CDs;(B)Fluorescence emission spectra of N,S-CDs at different excitation wavelengths from 320to 380nm
2.2 N,S-CDs的荧光猝灭机理
N,S-CDs的荧光发生猝灭,主要机理为N,S-CDs和维生素B2之间发生了FRET。由图4(A)可知,N,S-CDs最大发射波长为440nm,维生素B2的激发光谱在372nm和446nm处有两个峰,对应的发射波长为525nm,作为供体的N,S-CDs的发射光谱与受体维生素B2的激发光谱有非常好的重叠,这将有利于FRET的发生。另外,从图4(B)可知,随着维生素B2的加入,N,S-CDs的荧光发生猝灭,而维生素B2的荧光峰增强,所以N,S-CDs和维生素B2之间发生了FRET。

图4 (A)维生素B2的激发光谱(1)、发射光谱(2)和N,S-CDs的发射光谱(3);(B)N,S-CDs不加维生素B2(1)、加低浓度维生素B2(2)和高浓度维生素B2(3)后的荧光光谱图Fig.4 (A)Excitation(1),emission spectrum(2)of vitamin B2and emission spectrum of N,S-CDs(3);(B)Fluorescence spectrum of N,S-CDs without vitamin B2(1),with low(2)and high(3)concentration of vitamin B2
2.3 反应条件优化
实验中考察了pH和孵育时间对N,S-CDs测定维生素B2的影响。如图5(A)所示,在pH为3~7时,N,S-CDs的荧光随着pH的增加而增强,在pH大于7之后,N,S-CDs的荧光强度基本不变。而加入维生素B2后,pH对体系的荧光也有影响,由图中可以看出,在pH为7时,N,S-CDs的荧光猝灭程度达到最大。综上所述,选择体系为pH=7。图5(B)所示为加入维生素B2后,N,S-CDs的荧光发生猝灭,并且5min后体系的影响强度几乎保持不变,所以反应时间选为5min。

图5 (A)pH对N,S-CDs(1)和反应体系荧光强度(2)的影响;(B)反应时间对体系荧光强度的影响Fig.5 (A)The effect of pH on fluorescence intensity of N,S-CDs(1)and reaction system(2);(B)The effect of reaction time on the fluorescence intensity
2.4 N,S-CDs荧光猝灭测定维生素B2
图6 (A)体现了不同浓度的维生素B2对N,S-CDs的荧光强度的影响。从图中可知随着维生素B2的浓度逐渐增加,N,S-CDs的荧光逐渐被猝灭。图6(B)表明维生素B2浓度在0.1~15μmol/L的范围内时,与N,S-CDs的荧光猝灭程度呈线性关系,线性方程为:F/F0=-0.0339c+0.9006,相关系数为0.9911。其中F和F0分别为加入不同浓度维生素B2前后N,S-CDs的荧光强度,c为维生素B2的浓度。

图6 (A)维生素B2浓度对N,S-CDs荧光强度的影响(插图:加入不同浓度维生素B2后体系的光谱图);(B)F/F0和不同浓度维生素B2之间的线性关系Fig.6 (A)The effect of different concentration of vitamin B2on the fluorescence intensity of N,S-CDs(Inset:fluorescence spectra of system after the addition of different concentration of vitamin B2);(B)The linear relationship between F/F0and different concentrations of vitamin B2
2.5 N,S-CDs荧光猝灭测定维生素B2的可行性
考察了N,S-CDs测定维生素B2的可行性。在相同实验条件下,相同浓度的维生素A、维生素B1、维生素C、葡萄糖、果糖、麦芽糖、草酸、谷胱甘肽、Na+、K+、Zn2+、Ca2+、Cu2+、Mn2+、Fe3+对维生素B2的检测无明显干扰,因此所制备的N,S-CDs对维生素B2有较好的选择性,不易受其它可能共存物质的干扰。
2.6 实际样品检测
检测了实际样品菇类食品中维生素B2的含量。将样品按前述方法处理好后用于检测,每个样品平行测定5次。表1为各种菇中维生素B2含量及回收率测定结果,其中1#、2#、3#和4#分别为香菇,冬菇,元菇和杏鲍菇。结果表明加标回收率为97.2%~104.3%之间,相对标准偏差(RSD)低于5.6%。同时采用高效液相色谱法(HPLC)进行测定,结果表明两种方法没有明显差异。因此,此方法可用于菇类食品中维生素B2的测定。

表1 几种菇中维生素B2的含量测定(n=5)Table 1 Determination of vitamin B2in mushrooms(n=5)
3 结论
本实验中用尿素和半胱氨酸合成N、S共掺杂的N,S-CDs,该N,S-CDs具有良好的荧光特性。将其与维生素B2构成荧光共振能量转移体系,用于维生素B2的测定,建立一种检测维生素B2的方法,具有良好的应用前景。

