检测吡虫啉的极谱分析方法研究
胥亚庆,陈 文*,覃 凡
(1.成都理工大学材料与化学化工学院,四川成都610059;2.四川省矿产资源化学高校重点实验室,四川成都610059)
吡虫啉(Imidacloprid,IMI)是第一代新烟碱类杀虫剂的代表,因其含有6-氯-3-吡啶甲基(6-Chloro-3-pyridylmethyl)[1-2],能够与位于害虫神经系统后突触的乙酰胆碱受体直接作用,具有效期长、杀虫种类多、不容易挥发、水溶解性好以及在土壤中有着较好稳定性等优点[3-4]。吡虫啉对刺吸式口器害虫有着很好的防治效果,例如粉虱、飞虱、蚜虫,对一些鞘翅目害虫也有着较高的防治效果,可用于小麦、水稻、玉米、果树、蔬菜、甜菜、马铃薯、棉花等作物,是目前农业上用来防治蚜虫的主要农药[5]。因为吡虫啉价廉易得,其滥用的情况也时有发生,故而会造成农作物及土壤的污染,因此,建立一个简便、快速测定农作物及土壤中吡虫啉残留的方法具有十分重要的意义。
目前检测吡虫啉残留的方法主要有高效液相色谱法[7]、气相色谱法[8-9]、液相色谱-质谱法[10-11]以及电化学方法[12]等。电化学方法快速、灵敏、准确,适用于微、痕量组分分析,近年来在有机分析领域应用广泛,如:黄志英等[13]对吡虫啉在玻碳电极上的电化学行为及其测定进行了研究;郑修文等[14]建立了单扫描极谱测定吡虫啉含量并对电极反应机理进行了研究,但是该研究只针对吡虫啉原药而未针对农作物以及土壤残留等进行分析。
本研究利用吡虫啉可以在Na2HPO4-NaH2PO4缓冲溶液(PBS,pH=8.0)中,在滴汞电极上产生一个灵敏的还原峰,而阴离子表面活性剂十二烷基磺酸钠(SDS)对峰电流具有较好的增敏作用,据此建立了一种测定吡虫啉的极谱分析新方法。本文方法较文献报道的方法具有更低的检出限和更宽的线性检测范围,可以实现对吡虫啉残留量的测定,因此具有潜在应用价值。
1 实验方法
1.1 仪器与试剂
JP-303型极谱仪(成都仪器厂),三电极体系:滴汞电极为工作电极,铂微电极(1mm直径;南京骄远分析仪器有限公司)为辅助电极,饱和甘汞电极(单盐桥,上海雷磁仪器厂)为参比电极;pXS-1+型离子活度计(成都世纪方舟科技有限公司);数控超声波清洗器(昆山市超声仪器有限公司);电子分析天平(上海舜宇恒平科技仪器有限公司)。
吡虫啉原药(97%,拜尔作物科学(中国)有限公司);吡虫啉原药(10%,浙江海正化工股份有限公司)。吡虫啉标准储备液(1.0×10-3mol/L):准确称取0.0659g吡虫啉原药(97%),加入25mL甲醇溶解后,转移至250mL容量瓶中并用蒸馏水定容[15],浓度为1.0×10-4mol/L,1.0×10-5mol/L的标准溶液可由上述储备液稀释而得。十六烷基三甲基溴化铵(TMAB)、十二烷基磺酸钠(SDS)、聚乙二醇(成都科龙化工试剂厂);Triton X-100(HONG KONG FARCO CHEMICAL SUPPLIES);聚乙烯吡咯烷酮k90(天津博迪化工股份有限公司)。Na2HPO4-NaH2PO4缓冲溶液(PBS)、克拉克-鲁布斯(C-L)缓冲溶液、伯瑞坦-罗比森(B-R)缓冲溶液、NH3-NH4Cl缓冲溶液,pH均为8.0。实验所用的试剂均为分析纯,水均为一次蒸馏水。
1.2 实验方法
在25mL比色管中,依次准确加入一系列吡虫啉的标准溶液或适量样品溶液,12.0mL PBS(pH=8.0),0.55mL SDS溶液(1.0×10-3mol/L),用水稀释至刻度,摇匀。取适量倒入10mL小烧杯中,设置仪器条件为:起始电位-0.40V(vs.SCE),扫描速率700mV/s、静止时间10s、汞柱高度为50cm,扫描次数4次,量程2~10×104nA,于常温下进行测定,记录其二阶导数波峰的峰电位与峰电流。
2 结果与讨论
2.1 极谱行为
在已经确定的仪器条件下,在-0.40~-1.20V电位范围内进行扫描,各溶液的极谱图见图1。由图1可以看出,PBS(曲线a)、SDS(曲线b)、SDS+3.2×10-5mol/L IMI(曲线d)、PBS+SDS(曲线e)和3.2×10-5mol/L IMI(曲线g)在-0.40~-1.20V范围内均无峰,而PBS+3.2×10-5mol/L IMI(曲线c)在-1.104V处有一还原峰,该峰是吡虫啉的还原峰。PBS+SDS+3.2×10-5mol/L IMI(曲线f)在-1.110V处有一个还原峰。通过比较,发现曲线c、f的峰形相同,但是后者的峰电流大于前者的峰电流,说明SDS对峰电流有增敏作用。
2.2 底液的选择
2.2.1 pH值的确定 分别配制1.0×10-5mol/L(低浓度)和6.0×10-5mol/L(高浓度)的吡虫啉标准溶液,均不加任何试剂,用稀HCl和NaOH溶液调节溶液的pH值为2~12,然后按照实验方法测定,结果见图2。由图2可知,pH对高、低浓度的吡虫啉峰电流的影响趋势大致相同,碱性范围的峰电流均要高于酸性范围。综合考虑各个因素,本实验选择pH=8.0作为反应体系的最佳pH值。
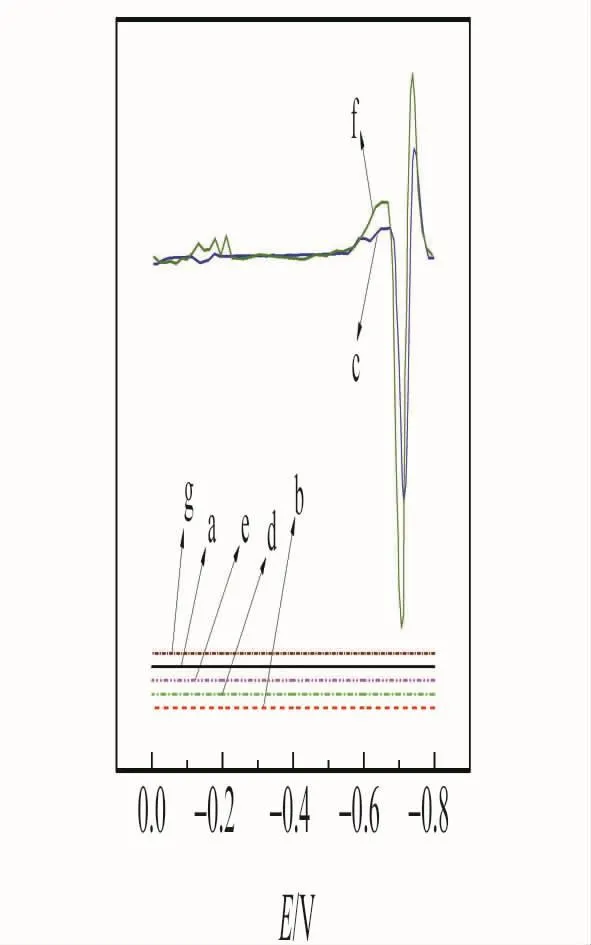
图1 二阶导数极谱图Fig.1 Second-order derivate polarogramsa.PBS;b.SDS;c.PBS+3.2×10-5 mol/L IMI;d.SDS+3.2×10-5 mol/L IMI;e.PBS+SDS;f.PBS+SDS+3.2×10-5 mol/L IMI;g.3.2×10-5 mol/L IMI.

图2 pH值对峰电流的影响Fig.2 Effect of pH on peak current
2.2.2 缓冲溶液及其用量的选择 实验考察了加入量均为10mL的pH=8.0的NH3-NH4Cl缓冲溶液、C-L缓冲溶液、B-R缓冲溶液、PBS对峰电流的影响。结果显示吡虫啉在PBS中的峰电流响应最好,因此本实验选择PBS为最佳反应介质。配制1.0×10-5mol/L(低)和6.0×10-5mol/L(高)的吡虫啉溶液,分别加入不同体积的PBS,考察缓冲溶液用量对峰电流的影响。结果显示:PBS的用量对低浓度吡虫啉溶液影响不大,加入量于8~15mL时,峰电流都较稳定;高浓度的吡虫啉溶液的峰电流在PBS用量为10~15mL时趋于稳定。综合考虑,本实验选择最佳缓冲溶液用量为12mL。
2.2.3 表面活性剂的种类及用量的选择 分别考察了CTMAB、SDS、Triton X-100、聚乙烯吡咯烷酮k90和聚乙二醇等对峰电流的影响。结果表明阴离子表面活性剂SDS对峰电流的增敏作用最大。配制1.0×10-5mol/L(低)和6.0×10-5mol/L(高)的吡虫啉溶液,考察SDS用量对峰电流的影响。结果显示:对于高浓度吡虫啉溶液,用量为0.5~0.8mL时,随用量的增加峰电流趋于稳定;对于低浓度吡虫啉溶液,用量为0.4~0.6mL时峰电流比较稳定。综合考虑,实验选择SDS的用量为0.55mL。
2.3 仪器最佳条件的确定
分别配制1.0×10-5mol/L(低)和6.0×10-5mol/L(高)的吡虫啉溶液,在最佳底液条件下,采用单因素变量法,分别考察了扫描速率、起始电位、静止时间、汞柱高度对峰电流的影响。在0.1~1.0V/s范围改变扫描速率,在0.1~-0.9V范围改变起始电位,在1~14s内改变滴汞静止时间,在25~52cm范围改变汞柱高度,最终选择的最佳仪器条件为:扫描速率700mV/s;起始电位-0.4V;静止时间10s;汞柱高度50cm。
2.4 温度与稳定性实验
从0~50℃改变温度,考察温度对吡虫啉峰电流的影响。结果表明随着温度的升高,高、低浓度吡虫啉峰电流的变化趋势一致,均随着温度升高而减小,这是吸附波又一特点之一。随着温度的升高,吸附于电极表面的吡虫啉脱附,造成峰电流下降的结果。综合考虑高、低浓度吡虫啉峰电流的变化,在室温范围内测定吡虫啉可以满足分析要求。考察高、低浓度的吡虫啉标准溶液在敞开和密闭情况下的稳定性。结果表明在密闭的情况下,对高、低浓度的吡虫啉在2h内分析测定均能得到稳定的结果。
2.5 标准曲线与检出限
配制一系列不同浓度的吡虫啉标准溶液,测定其峰电流,以吡虫啉浓度为横坐标,峰电流为纵坐标制作标准曲线。吡虫啉在2.0×10-6~2.8×10-5mol/L浓度范围线性方程为:Ip″(×103nA)=-1.2734+0.5465c(×10-6mol/L)(R2=0.9931);吡虫啉在2.80×10-5~1.24×10-4mol/L浓度范围线性方程为:Ip″(×103nA)=-10.6105+0.9163c(×10-6mol/L)(R2=0.9941)。配制浓度为2.0×10-6mol/L的吡虫啉溶液,进行10次连续测定,得出该方法的检出限为1.02×10-7mol/L。
按照上述实验方法,分别配制6份相同高浓度(6.0×10-5mol/L)、低浓度(1.0×10-5mol/L)的吡虫啉溶液,进行平行测试,相对标准偏差(RSD,n=6)分别为1.30%、1.44%。
2.6 共存物质的影响
在最佳实验条件下,考察了一些常见离子,两种常见的农药以及甲醇、淀粉、葡萄糖等物质对浓度为6.0×10-5mol/L吡虫啉溶液测定的影响。在允许误差±5%的范围内,确定干扰物质的最大浓度(mol/L),实验结果见表1。按照地表水中上述离子的浓度,采用0.01mol/L EDTA进行掩蔽。多菌灵、氟虫腈对测定的干扰也比较严重,但是按照一般农药施用的方式,两者均难以到干扰的倍数,所以可以忽略。
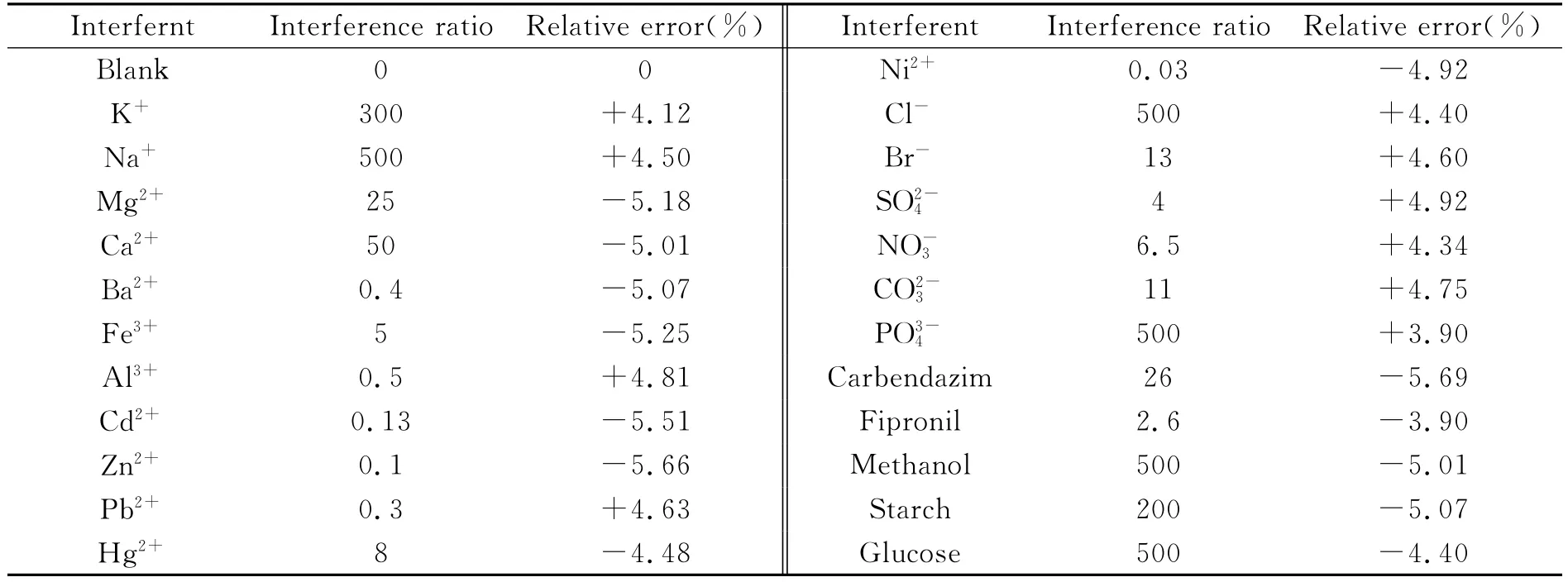
表1 共存物质的干扰Table 1 Interference of coexisting substances
2.7 样品分析
2.7.1 样品前处理 (1)吡虫啉原药:准确称取吡虫啉原药(10%)0.6392g于100mL烧杯中,用10mL甲醇溶解后,转移至100mL容量瓶中,用水定容,摇匀。浓度为2.5×10-4mol/L,待用。(2)土壤:向5g土壤样品(取自成都理工大学珙桐园附近土地)中喷洒20mL 1.0×10-4mol/L吡虫啉标准溶液。喷洒过后在阴凉处放置1d。将样品放入小烧杯中,加10mL甲醇,超声振荡30min,离心分出滤液,重复3次,合并滤液,转移到50mL容量瓶中,用水定容,静置[13]。(3)花生和大豆:向约5g的花生和大豆样品中喷洒20mL 1.0×10-4mol/L吡虫啉标准溶液,置于阳光下1h,然后在阴凉处放置1d。将样品粉碎过60目筛后,置小烧杯中,加10mL甲醇,超声振荡30min,用0.45μm膜过滤,用10mL甲醇洗涤过滤装置和小烧杯3次,合并滤液[13],转移至50mL容量瓶中,用水定容,静置。
2.7.2 样品分析及回收率 分别取吡虫啉原药(10%)、土壤样品、花生及大豆样品溶液各10.0mL,置于25mL比色管中,在最佳底液和仪器条件下进行测定,平行测定3次。结果见表2。此方法测定吡虫啉的回收率在92.7%~109.2%之间,说明单扫描极谱法测定样品中吡虫啉含量,方法有较好的准确度。
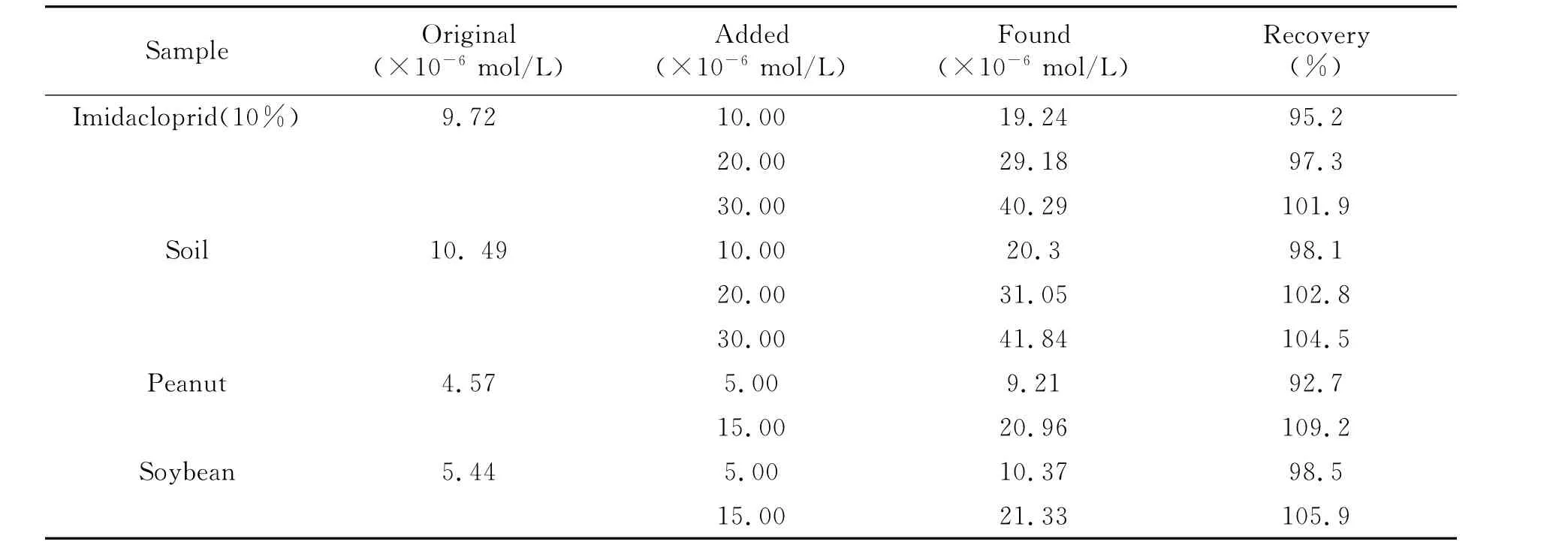
表2 加标回收实验(n=3)Table 2 The recovery for the spiked experiments(n=3)
2.8 电极反应物的确定
对2.1节所述7种溶液进行紫外-可见光谱分析(图略),发现在250~300nm波长内有一特征吸收峰。结果表明,PBS、SDS、PBS+SDS均在250~300nm波长范围无吸收峰。PBS+3.2×10-5mol/L IMI、SDS+3.2×10-5mol/L IMI、PBS+SDS+3.2×10-5mol/L IMI、3.2×10-5mol/L IMI在此波长内有一吸收峰,峰形相同且最大吸收峰位置一样,说明加入表面活性剂后,未生成新的络合物,该吸收峰就是吡虫啉的吸收峰,这与极谱机理讨论结果一致。
2.9 电极反应机理
2.9.1 扫速与峰电流和峰电位的关系 按照实验方法,配制6.0×10-5mol/L吡虫啉标准溶液,在电位0.1~0.8V/s范围内改变扫描速率,测定峰电流Ip和峰电位Ep,考察峰电流及峰电位随扫描速率的变化关系。结果显示:吡虫啉在0.1~0.8V/s扫速范围内峰电位与扫速的自然对数呈线性关系,线性回归方程为:Ep(V)=-1.0487-0.0235lnv(V/s)(R2=0.9428),说明体系为受吸附控制的不可逆体系。而在此扫速范围内,峰电流与扫速的平方根不呈线性关系,进一步说明其电极反应受吸附控制。
2.9.2 pH对极谱波的影响 按照2.2.1项下,考察pH值的变化对极谱波峰电位的影响,从而确定电极反应过程中是否有质子参与[14]。结果显示,吡虫啉的极谱峰电位在pH=6.52~9.93的范围内随着pH的增加而呈现正移的趋势,由此说明在此pH范围内电极反应过程中没有质子参加。
综上所述,吡虫啉的极谱波为不可逆吸附还原波。
3 结论
本文对单扫描极谱法测定吡虫啉的方法进行研究,在最佳条件下,吡虫啉浓度分别在2.0×10-6~2.8×10-5mol/L和2.8×10-5~1.24×10-4mol/L范围与峰电流呈线性关系,检出限为1.02×10-7mol/L。该方法具有较高的精密度和稳定性,用于实际样品分析,结果满意。

