蒺藜苜蓿MtNSN1的克隆与功能分析
张智琦,王珍,张铁军,龙瑞才,杨青川,康俊梅
(中国农业科学院北京畜牧兽医研究所,北京100193)
核干因子(nucleostemin,NS)是一种广泛存在于动植物和微生物中调控器官生长和发育的包含了rRNA前体加工蛋白的大型蛋白复合体。与rRNA合成相关的结构表明它在核糖体生物起源中起着重要的作用[1-2]。同时,NS主要在与生长发育密切相关的干细胞中表达,也表明了其对生长发育具有一定的调控作用[3]。因此研究NS在蒺藜苜蓿(Medicagotruncatula)中的同源基因MtNSN1在生长发育方面的功能,可以为提高苜蓿的产量提供一种新的思路。NS作为原核生物和真核生物中保守的鸟苷三磷酸酶(GTPase)的成员,属于参与核糖体生物发生、细胞增殖和细胞生长的YlqF/YawG GTPase家族[4]。NS首次被发现于小鼠的干细胞和部分癌细胞中,研究发现在抑制小鼠双微体基因(murine double minute 2,MDM2)活性的条件下,NS在小鼠体内的损耗或超表达会引起G1-S和G2-M转化的停滞[5]。MDM2是一种E3泛素连接酶,E3泛素连接酶特异性的识别靶标蛋白,其在植物生长发育和抗逆过程中也起着重要作用[6-7]。在人体中对NS家族的研究发现其包括3种类型,即核干因子、类鸟嘌呤核苷酸结合蛋白3(guanine nucleotide binding protein-like 3-like,Gnl3l)和新型核仁GTP酶(novel putative nucleolar GTPase1,Ngp-1),实验表明这3个家族成员在体内均与GTP结合,同时蛋白间GTP的结合域是一致的[8]。NS在C端含有一个酸性氨基酸域(AAA),在N端含有一个碱性氨基酸域(BAA)和一个卷曲线圈域(CC)。后两个结构域作为核仁蛋白的重要组成在动植物细胞周期中起着关键的作用[5]。然而与哺乳动物不同,在拟南芥(Arabidopsisthaliana)中只发现NS的两个亚家族——类核干因子和类Ngp-1,没有类Gnl3l[9]。
拟南芥的类核干因子(nucleostemin-like 1,NSN1)具有与哺乳动物NS基因相同的结构域,通过RNA原位杂交发现NSN1表达于植物茎尖分生组织和各种组织原基中;亚细胞定位发现,NSN1主要定位于核仁中[10-11]。在拟南芥和烟草(Nicotianabenthamiana)中均发现NSN1的沉默会导致生长的迟缓和衰老的提前,表明NSN1通过调节核糖体的生物发生从而调控植物生长和衰老的过程。已经发现NSN1可以与包括雌激素受体共调节因子抗体(pescadillo)和EB病毒核抗原1结合蛋白2(EBNA-binding protein 2,EBP2)在内的核糖体蛋白发生相互作用;而NSN1的缺失则可能通过延迟60 s核糖体亚基的生物发生来抑制翻译过程[12-14]。拟南芥突变体nsn1在胚胎发生的过程中子叶发生畸变,同时叶片极性发生紊乱[15]。在苗期,nsn1的子叶和叶片向上卷曲,卷曲的叶片在近轴端生长出分生组织类似物的增生结构,同时在nsn1叶片的近轴端发现了比野生型植株远轴端更长更大的铺面细胞,说明NSN1的突变会导致分生组织和远轴端细胞相关基因表达水平的上调,抑制了子叶边界和远轴端细胞识别相关基因的表达[9]。nsn1的叶片和根系均有发育缺陷,产生的营养器官数量严重减少,细胞数量远少于野生型,暗示了NSN1是胚胎发育、子叶和叶片生长和发育所必需的基因[16-17]。
综上所述,拟南芥的NSN1在植物细胞分化和细胞增殖调控中起到重要作用。蒺藜苜蓿是一种重要的一年生豆科模式植物,而NS在蒺藜苜蓿中的研究还尚未有人涉足。本研究通过克隆蒺藜苜蓿中NSN1的同源基因MtNSN1,分析该基因在不同组织中的表达水平差异,构建超表达载体并转化野生拟南芥,利用实时荧光定量PCR检测超表达植株中细胞周期标记基因的表达情况,以及使用DNA抑制剂博来霉素来检测转基因拟南芥对其耐受性的改变。旨在初探MtNSN1的表达模式及其对生长发育的调控作用,以期为苜蓿产量性状的遗传改良提供参考。
1 材料与方法
1.1 试验材料与培养
蒺藜苜蓿R108种子购于美国诺贝尔研究所,拟南芥Clombia-0种子保存于本实验室。挑选健康饱满的蒺藜苜蓿种子,在细砂纸上轻轻摩擦,破除种子硬实。将种子置于浸湿滤纸的玻璃皿中,放入光照培养箱(16 h光照/8 h黑暗,26 ℃/22 ℃,相对湿度60%)培养5 d左右。待种子萌发,将发芽的幼苗种在1/2霍格兰营养液中,置于人工气候室(20~22 ℃,16 h光照/8 h黑暗)中。每5 d换一次营养液,培养至取样。将野生型拟南芥的种子用10%的次氯酸钠浸泡10 min消毒,再用超纯水冲洗10次。加入0.1%的琼脂使种子悬浮,将其均匀地种在1/2 MS固体培养基上,置于4 ℃冰箱春化48 h,然后放在培养箱培养14 d左右,移入土中,置于人工气候室培养。
1.2 蒺藜苜蓿MtNSN1的克隆
根据Ensembl Plant数据库中同源基因NSN1的基因序列,用Primer 5设计一对引物MtNS-F/R(表1)。以蒺藜苜蓿R108的cDNA为模板进行PCR扩增,获得目的基因。将目的基因与pEASY-T5载体连接后,转化到大肠杆菌Trans-T1感受态细胞中,涂布在含有卡那霉素(50 mg·L-1)抗性的固体LB培养基上,置于培养箱中37 ℃培养12 h,挑取长势较好的单克隆菌株送公司测序,将测序结果正确的菌株提取质粒于-20 ℃保存。
1.3 生物信息学分析
利用DNAMAN软件分析测序结果并获得编码蛋白序列,并比对不同物种中MtNSN1同源基因的氨基酸序列; 通过 MEGA 5.0 软件进行进化树分析;利用Expasy网站中的ProtParam预测蛋白等电点和分子量;用ProtScale进行蛋白亲疏水性分析。运用PredictProtein网站进行亚细胞定位的预测;利用CBS网站中的TMHMM 2.0进行跨膜结构的预测;利用NPSA-PRABI网站对蛋白的二级结构进行分析。
1.4 MtNSN1的表达分析
取开花期蒺藜苜蓿的根、茎、叶和花分别提取RNA。以蒺藜苜蓿的actin2作为内参基因,根据基因序列设计荧光定量引物qPCR-F/R(表1),用SYBR法进行实时荧光定量PCR。所得数据用2-ΔΔCT(Livak) 方法处理分析。
1.5 MtNSN1的RNA原位杂交
切取培养皿中萌发3 d的蒺藜苜蓿幼苗的茎尖部分,将其置于福尔马林-乙酸-乙醇混合液(formalin-aceto-alcohol,FAA)中固定,用不同浓度的乙醇和二甲苯对材料进行脱水和透明处理,然后浸蜡包埋,再用切片机切片,最终获得蒺藜苜蓿的茎尖石蜡切片。根据MtNSN1的序列设计一对片段长度约为200 bp的特异性良好的探针引物insitu-F/R(表1),引物上下游分别加上具有T7和SP6 RNA聚合酶启动子的序列。通过体外转录获得正义和反义RNA探针。对探针RNA和对照RNA进行一定梯度稀释后进行预杂交试验,确定探针的浓度。对茎尖石蜡切片进行脱蜡,蛋白酶K消化以及脱水处理。用混有探针RNA的杂交液对切片进行杂交,然后洗片,显色,封片,最后用荧光显微镜观察[18-19]。

表1 本研究所用的引物序列Table 1 Sequences of primers used in the study
1.6 超表达载体pMDC83-MtNSN1的构建以及对拟南芥的转化
以含有目的基因的质粒作为模板,设计一对去掉终止密码子的引物p83-NSN1-F/R(表1),PCR扩增出目的基因。将目的基因切胶回收纯化后,通过入门载体与最终载体pMDC83连接。用热激法[20]将载体转化到大肠杆菌T1感受态中,筛选阳性菌株测序后,获得超表达载体pMDC83-MtNSN1,然后提取菌株质粒。将上述质粒转化到农杆菌GV3101中,活化后离心重悬,用花序侵染法[20]转化野生型拟南芥。收获转化的拟南芥T1代种子,将其种于含有潮霉素(50 mg·L-1)抗性的1/2 MS固体培养基上,筛选抗性转基因拟南芥。
1.7 转基因拟南芥阳性植株的鉴定
以T1代抗性转基因植株DNA为模板,用引物p83-NSN1-F/R(表1)进行PCR扩增,检测阳性植株。以鉴定为阳性植株的cDNA为模板,用引物qPCR-F/R进行实时荧光定量PCR,以拟南芥β-actin(表1)为内参基因,每个处理设计3个生物学重复。所得数据用2-ΔΔCT(Livak) 方法分析。
1.8 MtNSN1基因的功能分析
1.8.1表型分析 将野生型拟南芥和MtNSN1表达量较高的阳性转基因拟南芥T2代种子于光照培养箱培养2周。测量并统计植株的主根长度和叶片数量,每个株系设置50个重复。
1.8.2细胞周期标记基因的表达模式分析 根据对拟南芥的表型统计,综合分析后选择性状差异最大并且MtNSN1表达量最高的株系NSN1-5来进行后续实验。选取4周龄的T2代转基因拟南芥提取植物总RNA,根据细胞周期标记基因包括3个细胞周期基因CYCA2;3、CYCB1;1、CYCD3;1和2个S期特有基因组蛋白H4基因(HistoneH4)和核糖核酸还原酶编码基因(ribonucleotide reductase,RNR)的序列设计引物(表1),以β-actin为内参基因,进行荧光定量PCR(方法同1.4)。
1.8.3对DNA抑制剂的耐受性分析 博来霉素是一种DNA抑制剂,用其处理植物会导致多种类型分子损伤的产生,包括DNA单链和双链的断裂,该抑制剂主要影响细胞周期的S期[21]。前人研究发现拟南芥在博来霉素的处理下,与细胞周期相关的基因均有所下调[22]。将野生型拟南芥和T2代转基因拟南芥的种子消毒后置于4 ℃春化2 d,种在1/2 MS培养基上,竖直培养2周后,移在含有3,6,9和12 mg·L-14个浓度博来霉素抗性的1/2 MS培养基上,继续培养1周,统计不同浓度下2个株系拟南芥的根长,不同处理各设置50个重复。
2 结果与分析
2.1 蒺藜苜蓿MtNSN1的生物信息学分析
MtNSN1是一个 cDNA全长2193 bp的基因,其中包含一个1800 bp的开放阅读框,可编码599个氨基酸。将该基因序列与数据库(https://www.arabidopsis.org/Blast/index.jsp)中的A17生态型蒺藜苜蓿同源基因的序列进行比对,发现有8个碱基差异与3个氨基酸差异。
生物进化树分析表明,MtNSN1与大豆(Glycinemax)的氨基酸同源性为66.67%(图1)。利用DNAMAN软件进行氨基酸序列比对,发现其中G~G5组成的MMR/HSR1域,在古生菌到脊椎动物中都有存在(图1)。采用Expasy网站中的ProtParam预测MtNSN1蛋白分子量为133.7 kDa,蛋白偏碱性。通过ProtScale对蛋白的疏水性分析表明MtNSN1为亲水性蛋白。利用PredictProtein预测MtNSN1定位于细胞核上。采用TMHMM 2.0预测发现该蛋白无跨膜区。利用NPSA-PRABI网站分析知MtNSN1的二级结构主要由44.57%的α螺旋和41.57%的无规则卷曲组成。
2.2 MtNSN1的组织差异性表达分析
利用荧光定量PCR对蒺藜苜蓿的根、茎、叶和花中的MtNSN1进行定量分析,结果表明,该基因在这些组织中均有表达。其中MtNSN1在花中表达量最高,根次之,表达量约为花中的30%;叶中表达量最低,仅为花中的10%(图2)。
2.3 MtNSN1在蒺藜苜蓿茎尖的原位杂交
反义探针在茎尖分生组织中检测到阳性信号,显示出蓝紫色(图3A), 而正义探针未检测到阳性信号,没有显示出蓝紫色(图3B)。表明MtNSN1主要表达在生长活跃的茎尖分生组织和周围的幼嫩叶中。
2.4 阳性转基因拟南芥的筛选与鉴定
在含有潮霉素(50 mg·L-1)抗性的1/2 MS固体培养基上筛选出7株抗性转基因拟南芥植株。经过PCR检测确定以上植株均为阳性转基因植株。实时荧光定量PCR结果表明,MtNSN1在不同株系中表达量不同。将7株阳性苗分别命名为NSN1-1、NSN1-2、NSN1-3、NSN1-4、NSN1-5、NSN1-6、NSN1-7。其中NSN1-6中MtNSN1表达量最低;NSN1-5中表达量最高,是NSN1-6的65倍;NSN1-3表达量次之,是NSN1-6的9倍(图4)。

图1 MtNSN1与其他物种生物进化树分析和氨基酸序列多重比对Fig.1 Phylogenetic analysis and amino acid sequence alignment of MtNSN1 with other species A:MtNSN1与其他物种的系统进化树分析(方框内为蒺藜苜蓿的MtNSN1); B:MtNSN1与其他物种的氨基酸序列比对(方框内为保守结构域G1~G5)。A:Phylogenetic analysis of MtNSN1 with other species (The frame shows MtNSN1 in M. truncatula); B:Amino acid sequence alignment of MtNSN1 with other species (The frame shows conserved domain of G1-G5).ZmGNL: 玉米 Zea mays NP_001142481; VaGNL: 红豆 Vigna angularis XM_017584230.1; MtNGP: 蒺藜苜蓿 M. truncatula XP_013467257.1; NGP: 拟南芥 Arabidopsis NP_175706.1; MmGNL3: 小鼠 Mus musculus AY181025.1; HsGNL3: 人 Homo sapiens AAV74413.1; SrGNL3: 线虫 Strongyloides ratti XP_024506722.1; OsNSN1: 水稻 Oryza sativa XP_015620869.1; MtNSN1: 蒺藜苜蓿 M. truncatula XP_013467257.1; GmNSN1: 大豆 Glycine max KRG90185; LaNSN1: 狭叶羽扇豆 Lupinus angustifolius XM_019580035.1; NSN1: 拟南芥 Arabidopsis NP_187361.1; NaNSN1_0: 烟草 Nicotiana attenuate XP_019249461; SlNSN1: 番茄 Solanum lycopersicum NP_001234382; SbNSN1: 高粱 Sorghum bicolor XP_002464274.
2.5 转基因拟南芥的表型分析
根据对野生型拟南芥以及转基因拟南芥NSN1-2,NSN1-3和NSN1-5的2周龄植株根长和叶片数量的统计,3个株系的转基因拟南芥根长明显多于野生型拟南芥,其中平均根长最长的是NSN1-3,比野生型拟南芥长大约2 cm(图5);3个株系的转基因拟南芥叶片数量略多于野生型拟南芥,但无显著差异。其中平均叶片数量最多的是NSN1-5(图5),比野生型拟南芥多1~2片。统计结果表明,MtNSN1转基因拟南芥的主根长度和叶片数量均优于野生型拟南芥。
2.6 转基因拟南芥中细胞周期标记基因的表达分析
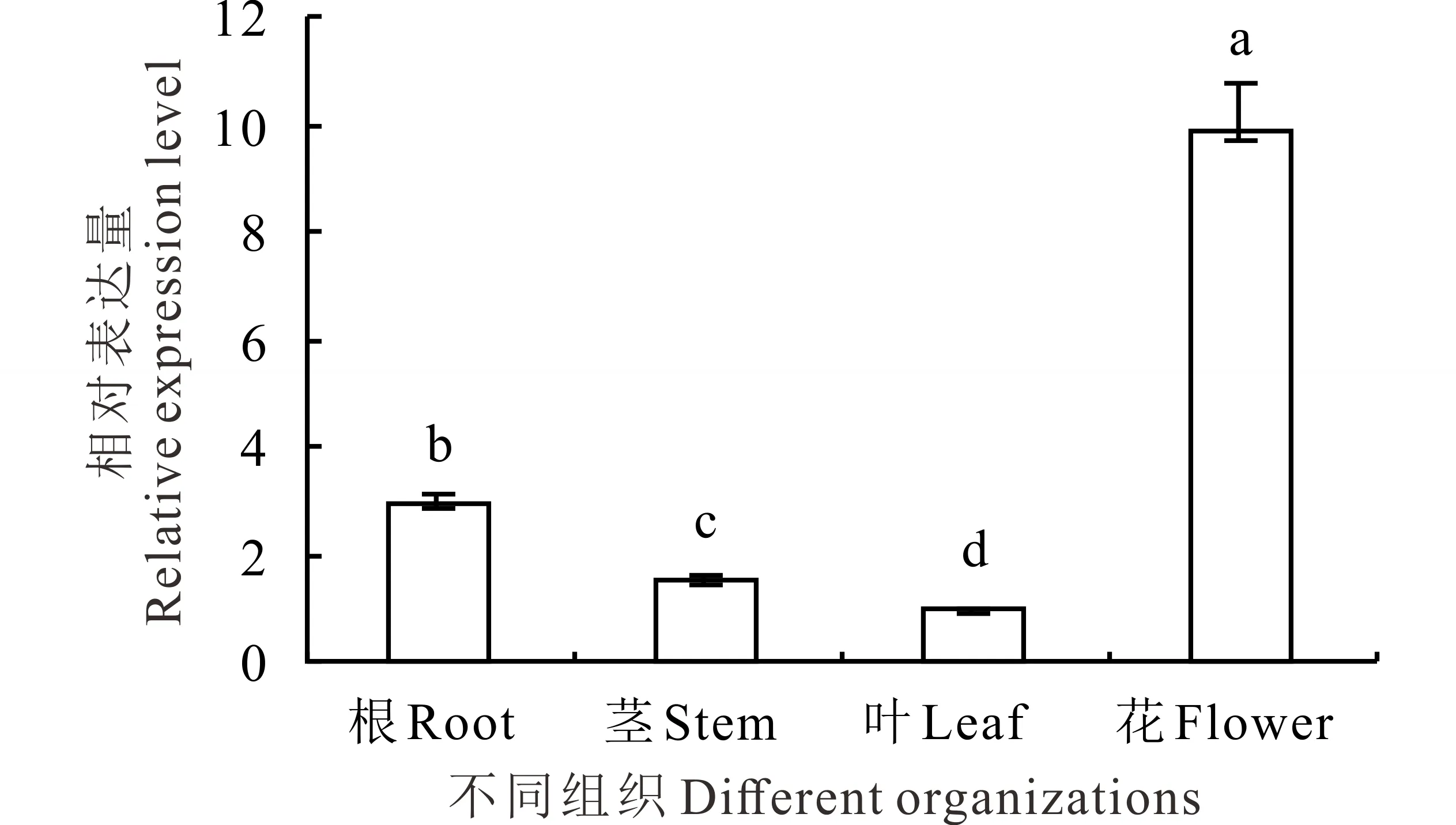
图2 蒺藜苜蓿中MtNSN1的组织差异性表达分析Fig.2 The relative expression of MtNSN1 in different organizations from M. truncatula不同小写字母表示差异显著(P<0.05),下同。Different small letters mean significant differences (P<0.05), the same below.
通过实时荧光定量PCR,分析WT和转基因拟南芥T2代中5个细胞周期标记基因的表达量。结果表明,在转基因拟南芥中5个细胞周期标记基因表达量都有不同程度的升高。其中CYCA2;1表达量升高显著(图6),是野生型拟南芥的70倍;CYCD3;1和H4表达量次之,是野生型拟南芥的2.5倍多;CYCB1;1和RNR表达量升高较少,是野生型拟南芥的2倍。
2.7 DNA抑制剂对转基因拟南芥生长发育的影响
转基因株系和WT在博来霉素浓度从低到高的处理下,根长越来越短,说明博来霉素对拟南芥的生长有抑制作用。在同一浓度下比较,转基因拟南芥的根长均长于WT,表明MtNSN1转基因拟南芥比野生型拟南芥对博来霉素有更强的耐受性(图7)。

图3 MtNSN1在蒺藜苜蓿茎尖分生组织的原位杂交定位Fig.3 The localization of MtNSN1 examined in shoot apical meristem of M. truncatula by in situ hybridization A: 反义探针杂交结果Hybridized with the MtNSN1 antisense RNA probe; B: 正义探针杂交结果Hybridized with the MtNSN1 sense RNA probe; SAM: 茎尖分生组织Shoot apical meristem; P1,P2: 叶原基发育的不同时期The different times of leaf primordium; 标尺为50 μm The bar is 50 μm.
3 讨论
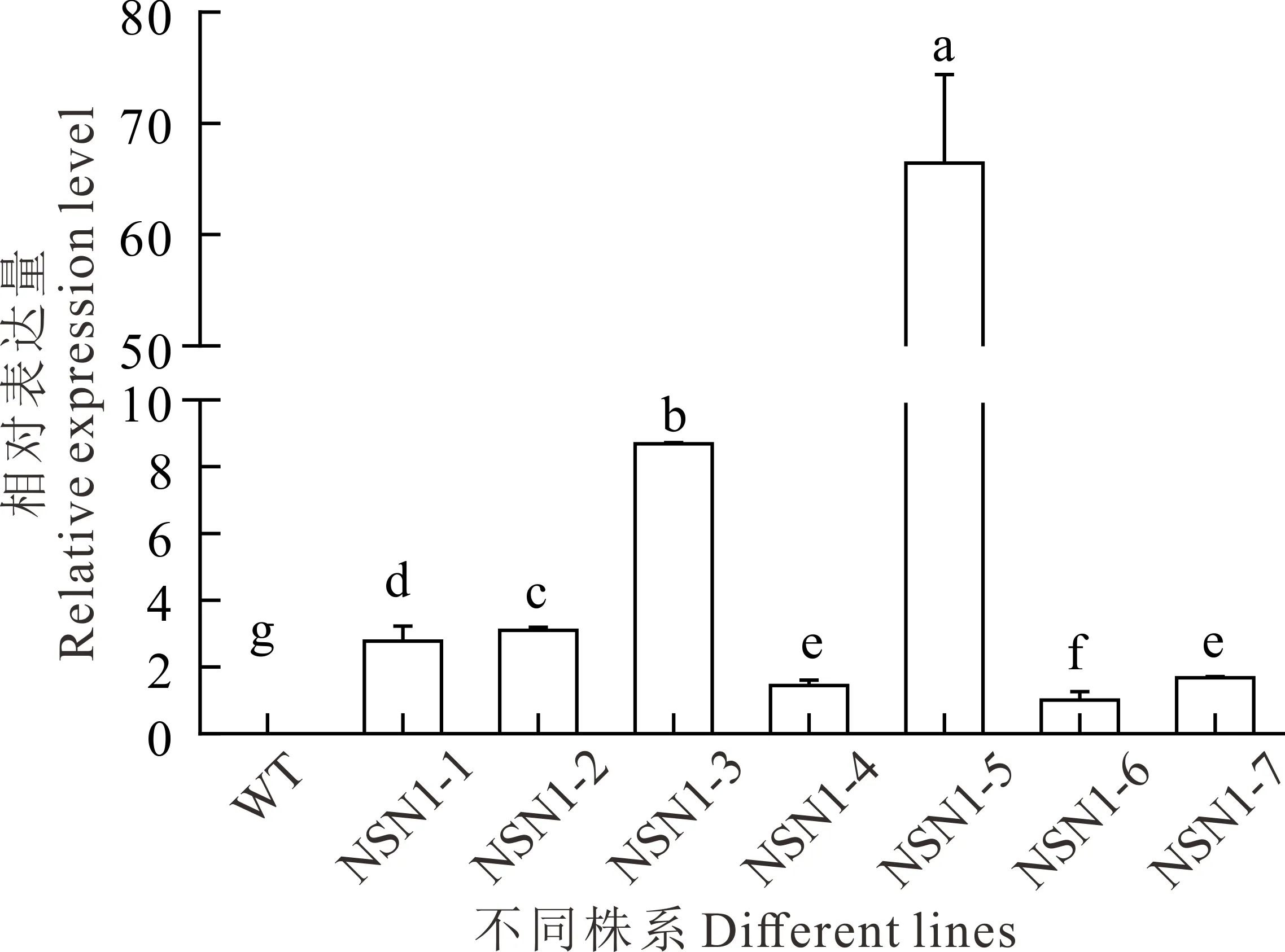
图4 转基因拟南芥中MtNSN1的相对表达量Fig.4 The relative expression level of MtNSN1 in transgenic Arabidopsis
蒺藜苜蓿MtNSN1包含一个1800 bp的开放阅读框,可编码599个氨基酸,蛋白分子量为133.7 kDa,蛋白偏碱性。根据进化树分析,MtNSN1与大豆亲缘关系最近。氨基酸多序列比对分析发现,蛋白由5个保守的GTP结合基序组成,分别为G1、G2、G3、G4和G5[23],这样的结构被命名为MMR/HSR1结构域。
MtNSN1在蒺藜苜蓿不同组织中的表达量也有所不同,其中在花中的表达量最高。Wang等[11]的研究表明, 拟南芥NSN1通过直接或间接控制结合到隐花基因2(AGAMOUS2,AG2)上的引物蛋白复合物来调控隐花基因(AGAMOUS,AG)。在植物中,干细胞的活动必须通过花的发育过程来终止,而这一过程需要激活AG的表达,因此AG在花分生组织起始过程中发挥着重要作用[24-25]。这与NSN1编码的mRNA主要分布于花序分生组织和花原基中,以及该基因对花的生长发育起到重要调控作用这一结论具有一致性。

图5 转基因和野生型拟南芥的表型统计Fig.5 The phenotype statistics of transgenic Arabidopsis and WT

图6 5个细胞周期标记基因在转基因拟南芥中的相对表达量Fig.6 The relative expression level of five cell cycling marker genes in transgenic Arabidopsis
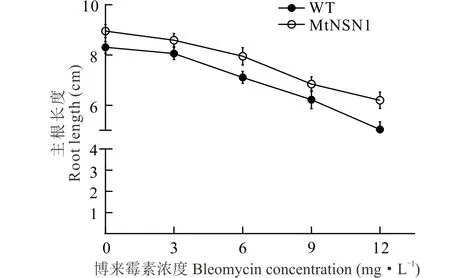
图7 不同浓度博来霉素处理下转基因和野生型拟南芥的根长 Fig.7 The root length statistics of transgenic and WT Arabidopsis under different concentration of bleomycin
通过RNA原位杂交,发现NSN1在幼苗叶片和茎尖分生组织中有明显的信号,表明NSN1在拟南芥参与生长发育的过程[9]。本研究利用原位杂交发现MtNSN1在蒺藜苜蓿的茎尖分生组织及其周围幼嫩的叶中表达,表明该基因表达于具有衍化出各类组织原基功能的茎尖分生组织中,表明蒺藜苜蓿MtNSN1参与了分生组织的调控机制。
通过研究NSN1对拟南芥子叶发育的影响表明,该基因的突变可能对胚胎发育的任何阶段产生抑制作用。进一步研究证明NSN1参与分生组织在胚胎中的发生过程以及控制子叶的发育[9]。Jeon等[12]研究发现NbNSN1缺失的烟草植株有生长迟缓的现象。本研究通过统计发现MtNSN1转基因拟南芥在主根长度和叶片数量上与野生型相比都有增加,表明该基因可能影响植物胚胎及不同器官的生长发育。
有文献报道[2,13],在动物中缺失或超表达NS时细胞周期会被抑制,同时G1-S和G2-M的过渡阶段也发生阻滞。在体外培养的神经干细胞中,NS的缺失会抑制DNA的复制过程,同时扰乱DNA的自我更新,而超表达NS则对羟化导致的DNA损伤具有保护作用[26]。研究发现,核糖体生物发生是细胞周期进展的关键调控机制,G1期结束产生的核糖体数量控制着G1的S期的转变[27]。本研究通过DNA抑制剂博来霉素处理不同的拟南芥株系,发现MtNSN1转基因拟南芥植株的主根比野生型拟南芥更长,表明转基因株系对博来霉素有更强的耐受性,这种耐受性的提高可能是MtNSN1参与了细胞周期的调控造成的。
此外,有研究发现拟南芥NSN1通过维持细胞周期的进程参与调控植物的生长发育[28]。Wang等[16]的研究中发现拟南芥突变体nsn1表型矮小,且NSN1主要定位于控制细胞生长的核仁中。细胞周期标记基因CYCA2;3、CYCB1;1、CYCD3;1、RNR和H4除了控制细胞周期过渡外,还在植物细胞分裂和分化发育过程中起着协调作用[29]。在nsn1突变体中,细胞周期标记基因的表达量与野生型拟南芥相比均有所下降[16]。本研究发现MtNSN1转基因拟南芥中上述5种细胞周期标记基因的表达量与野生型拟南芥相比均有上调,表明MtNSN1在转录水平上影响拟南芥的细胞周期进程。
4 结论
克隆得到蒺藜苜蓿MtNSN1 的cDNA全长2193 bp,氨基酸序列比对表明MtNSN1含有MMR/HSR1结构域,属于GTPase家族中的RbgA/YlqF/YawG 亚家族。通过对MtNSN1在蒺藜苜蓿不同器官中的表达分析,表明该基因在花中表达量最高,根次之,叶片中表达量最低,仅为花中的10%;RNA组织原位杂交显示,MtNSN1主要在茎尖分生组织及其周围的幼嫩叶中表达,暗示MtNSN1与苜蓿茎尖分生组织维持有关。超表达MtNSN1拟南芥的主根长度和叶片数目都明显优于野生型,初步说明该基因影响地上及地下器官的生长。通过实时荧光定量PCR分析表明,超表达MtNSN1拟南芥中细胞周期标记基因CYCA2;3、CYCB1;1、CYCD3;1、H4和RNR的表达水平均有显著上调。DNA化学诱变剂处理后,超表达植株根系受抑制程度小于野生型,表明MtNSN1参与维持细胞周期的过程。

