菲和芘胁迫下AMF和PGPR对高羊茅生理生态的响应
李文彬,宁楚涵,李伟,李峰,郭绍霞*
(1.青岛农业大学菌根生物技术研究所,山东 青岛 266109;2.青岛农业大学园林与林学院,山东 青岛 266109)
随着工业化和城市化进程的加快,加上煤矿等的开采以及工业“三废”的排放、污水灌溉、化肥农药的不科学使用等问题导致土壤有机物污染日益严重,由此带来的生态和食品安全等问题受到广泛关注[1]。具有两个以上苯环以稠环形式相联合的化合物菲和芘属于多环芳烃(polycyclic aromatic hydrocarbons,PAHs),因其具有广泛存在性、易富集和三致(致癌、致畸、致突变)效应[2],对人体造成了潜在危害[3-4],已被各国列为优先控制的有毒有害污染物。有研究发现,PAHs的浓度会影响植物的耐受力;高浓度下,PAHs可在植物根系表层形成膜状物,阻止植物从土壤中吸收水分和矿质元素,进而抑制植物生长,降低生物量[5]。Dupuy等[6]研究发现,在菲浓度高于50 mg·kg-1时玉米(Zeamays)植株生长受到严重抑制。芘、屈、苯并(b)荧蒽和苯并(k)荧蒽4种PAHs处理下可降低紫松果菊(Echinaceapurpurea)的株高和生物量;紫松果菊在PAHs总浓度为183.6 mg·kg-1时仍存活,并对PAHs污染土壤具有较强的耐性[7]。基于以上研究,增强植物抗性、稳定被有机物污染的城市绿地系统,是值得探究的问题。其中,菌根真菌、细菌和植物联合提高植物抗逆性、保持农业生态系统可持续生产力的作用备受青睐[8-10]。
研究表明,一定种类的丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)和植物根围促生细菌(plant growth-promoting rhizobacteria,PGPR)能互相促进对方的定殖和侵染,改善土壤理化特性和植物营养条件,促进植物生长并协同发挥生理生态效应[11]。石油烃污染胁迫下,燕麦(Avenasativa)单独接种PGPR粘质赛氏杆菌(SerratiamarcescensBC-3)或与根内根孢囊霉(Rhizophagusintraradices)混合接种处理下,植物表现出更好的生长;混合接种处理植株的鲜重和干重分别是未接种对照的1.5和1.4倍,燕麦叶片SOD、CAT和POD活性高于对照,且表现为PGPR和AMF共接种的植物酶活性最高[12]。枯草芽孢杆菌(Bacillussubtilis)和地斗管囊霉(Funneliformisgeosporum)协同作用可以有效提高红三叶(Trifoliumpratense)对石油污染胁迫的耐受性,单一接种或混合双接种均能显著增加红三叶地上部和根系干重,可溶性糖含量和脯氨酸含量均显著升高,叶片CAT、POD活性显著升高,丙二醛含量明显减少[13]。甲胺磷污染下,番茄(Lycospersiconesculentum)接种AMF摩西斗管囊霉(Funneliformismosseae)、幼套近明球囊霉(Claroideoglomusetunicatum)、PGPR枯草芽胞杆菌(Bacillussubtilis)、荧光假单胞菌(Pseudomonasfluorescens)后表明,接种摩西斗管囊霉显著增加了根区土壤和根内PGPR定殖数量,而荧光假单胞菌处理显著提高了AMF侵染率,100 μg·g-1甲胺磷水平下,摩西斗管囊霉+荧光假单胞菌处理的番茄株高显著高于其他处理,地上部干重最大,根系干重显著高于对照、PGPR各处理和AMF处理[14]。
PAHs的环境污染[15]、转移、降解[16-17]及对人和动物的危害一直是研究的热点问题。关于植物的研究主要集中在植物修复、耐毒性和生理影响上,对植物生长以及光合特性的影响研究较少。高羊茅(Festucaelata)是中国北方典型冷季型城市草坪草,不仅适应气候能力强,而且具有较强的耐盐碱、耐热性等,在国内城市草坪绿地中被广泛采用[18-19]。研究表明,高羊茅接种摩西斗管囊霉并用不同浓度NaCl处理后能增加叶片抗氧化酶活性和抗氧化剂含量、渗透调节物质含量;降低丙二醛和膜透性[20];土壤压实胁迫下,接种AMF处理的高羊茅叶片超氧化物歧化酶活性、过氧化物酶活性、过氧化氢酶活性、抗坏血酸过氧化物酶活性以及硝酸还原酶活性均不同程度高于对照,而丙二醛含量和叶片相对电导率低于对照,表明接种AMF能有效地增强高羊茅对土壤压实的抵抗力,以混合双接种摩西管柄囊霉+根内根孢囊霉的效应最大[21]。然而,有关AMF+PGPR对高羊茅生理适应PAHs的作用机制了解甚少。本试验在前期研究的基础上,继续选用高羊茅为试验材料,从生理生态学角度研究接种AMF和PGPR后高羊茅对多环芳烃污染的适应机制,为今后修复多环芳烃污染的研究提供一定的科学依据。
1 材料与方法
1.1 试验材料
供试植物为高羊茅品种‘艾瑞3号’(购自山东中农种业有限责任公司)。供试AMF菌种为变形球囊霉(Glomusversiforme,Gv),PGPR细菌为荧光假单胞菌(Pseudomonasfluorescens,Ps2-6)。变形球囊霉为青岛农业大学菌根生物技术研究所自有,由三叶草扩繁,以保存于其根系及基质中的孢子、菌丝和菌根根段为接种物(孢子密度380个/50 g,菌丝侵染率为65%);荧光假单胞菌自三叶草和苜蓿根围分离、鉴定和保存,采用牛肉膏蛋白胨培养基和无机盐培养基培养PGPR菌种备用。供试土样为121 ℃高温高压蒸汽灭菌2 h后的园土。于2018年4月上旬将高羊茅种子用10% H2O2浸泡10 min进行表面消毒,然后置于滤纸上晾干。将150粒高羊茅种子播种至上盆口直径25 cm、下盆口直径17 cm、高15 cm的塑料盆内(每盆3 kg土),根据温室湿度、光照和温度状况进行人工调控。出芽前,每周浇2~3次水。根据培养基质肥力水平和植株生长需要于中后期适当补充200 mL 30%的Hoagland营养液。土壤基本理化性质:pH为6.86,有机质含量5.4 g·kg-1,全氮含量1.2 g·kg-1,全磷含量0.4 g·kg-1,全钾含量5.6 g·kg-1,碱解氮含量56.0 mg·kg-1,有效磷含量4.7 mg·kg-1,速效钾含量50.2 mg·kg-1。
1.2 试验方法
试验于2018年4-6月在青岛农业大学温室大棚内进行,采用盆栽试验,设菲和芘水平各0、50、100、150 mg·kg-1下,接种变形球囊霉、荧光假单胞菌以及二者混合接种和不接种对照(CK),共16个处理,随机排列,每个处理重复5次。将各0、50、100、150 mg·kg-1浓度菲和芘的丙酮溶液均匀喷洒在土壤表层,多次搅拌,过筛,混合均匀,放置于储藏架上静置7 d。接种AMF的剂量为12000接种势[IP=N×W×K+S,IP为接种势单位,N为单位长度根段内含有的泡囊数量,W为根重(g),K为单位质量根系长度(cm),S为单位质量或体积接种剂内孢子数量],对照(CK)则接种等量灭菌接种物,以保持相同的其他根围微生物区系环境。高羊茅出苗后2周接种PGPR每盆10 mL菌液(1×108cfu·mL-1)。
高羊茅种子用10% H2O2浸泡消毒10 min后置于滤纸上晾干。每盆播种50粒。用75%酒精溶液消毒盆栽容器。播种后出芽前,每周浇2次水,浇水均匀而充足。出芽后每7 d浇1次营养液,以保证养分供给,管理期间注意温度、光照强度、通气条件的控制,严禁积水。播种后3个月,植株高度约25 cm和密度为50%~80%时,测定各项指标。
1.3 指标测定
1.3.1AMF侵染率的测定 采集高羊茅须根系,洗净,加入5% KOH溶液,80 ℃水浴5 min,清洗3次,加2% HCl浸泡5 min后,加入0.1%酸性品红-乳酸甘油染色液,室温下过夜,加乳酸脱色,制片镜检,计算菌根侵染率[22]。
菌根侵染率=∑(0×根段数+10%×根段数+20%×根段数+…+100%×根段数)/总根段数
菌根依赖性=(接种处理干重-未接种处理干重)/接种处理干重×100%
1.3.2防御性酶活性的测定 超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性、可溶性蛋白含量、脯氨酸含量、丙二醛(malonaldehyde,MDA)含量的测定均采用王学奎[23]描述的方法。
1.3.3高羊茅光合参数的测定 选择晴朗少云的天气(9:30-11:30)用光合仪CIRAS-3(北京精测电子科技有限公司)测定叶片的气体交换参数。测定净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、细胞间隙CO2浓度(intercellular CO2concentration,Ci)等参数。
1.3.4叶绿素含量测定 用95%乙醇提取法测定高羊茅叶片叶绿素含量。
1.3.5叶绿素荧光测定 选择晴朗少云的天气(9:30-11:30),用Pocket PEA荧光仪(北京精测电子科技有限公司)测定叶片的叶绿素荧光参数。叶片暗适应30 min后,测定暗适应后的光系统Ⅱ(PSⅡ)的最大光化学效率(Fv/Fm)和PSⅡ潜在活性(Fv/Fo)。
1.4 数据处理
采用Microsoft Excel 2003软件对数据进行处理和绘图,采用DPS 7.5和SPSS 11.5统计分析软件对数据进行差异显著性检验(LSD法,α=0.05)。
2 结果与分析
2.1 菲和芘胁迫下AMF和PGPR对高羊茅叶绿素含量的影响
同一菲和芘浓度下,接种AMF和PGPR显著增加了高羊茅叶片Chl(a+b)含量,不同接种间表现为变形球囊霉+荧光假单胞菌>荧光假单胞菌>变形球囊霉>CK,且差异显著(P<0.05)。同一接种处理下,随菲和芘浓度的增加,总叶绿素(a+b)含量呈先增加后下降的趋势,与Chl a和Chl b变化相同,Chl a/b有下降的趋势。菲和芘100 mg·kg-1下,与CK相比,双接种变形球囊霉+荧光假单胞菌处理的高羊茅叶片Ch(a+b)、Chl a和Chl b含量分别增加了51.8%、57.7%和41.7%,荧光假单胞菌处理下分别增加了41.5%、31.7%和58.3%,变形球囊霉处理下分别增加26.7%、 23.6%和31.9%(表1)。 由以上结果可知,接种荧光假单胞菌处理对总叶绿素和叶绿素a、b含量增加优于变形球囊霉,表明接种变形球囊霉和荧光假单胞菌均能不同程度促进菲和芘胁迫下高羊茅叶片光合色素合成,提高叶片叶绿素含量;菲和芘胁迫下双接种变形球囊霉+荧光假单胞菌处理增加高羊茅叶绿素含量的效应最大。菲和芘与接种处理对高羊茅叶绿素含量的影响无交互作用(P>0.05)。
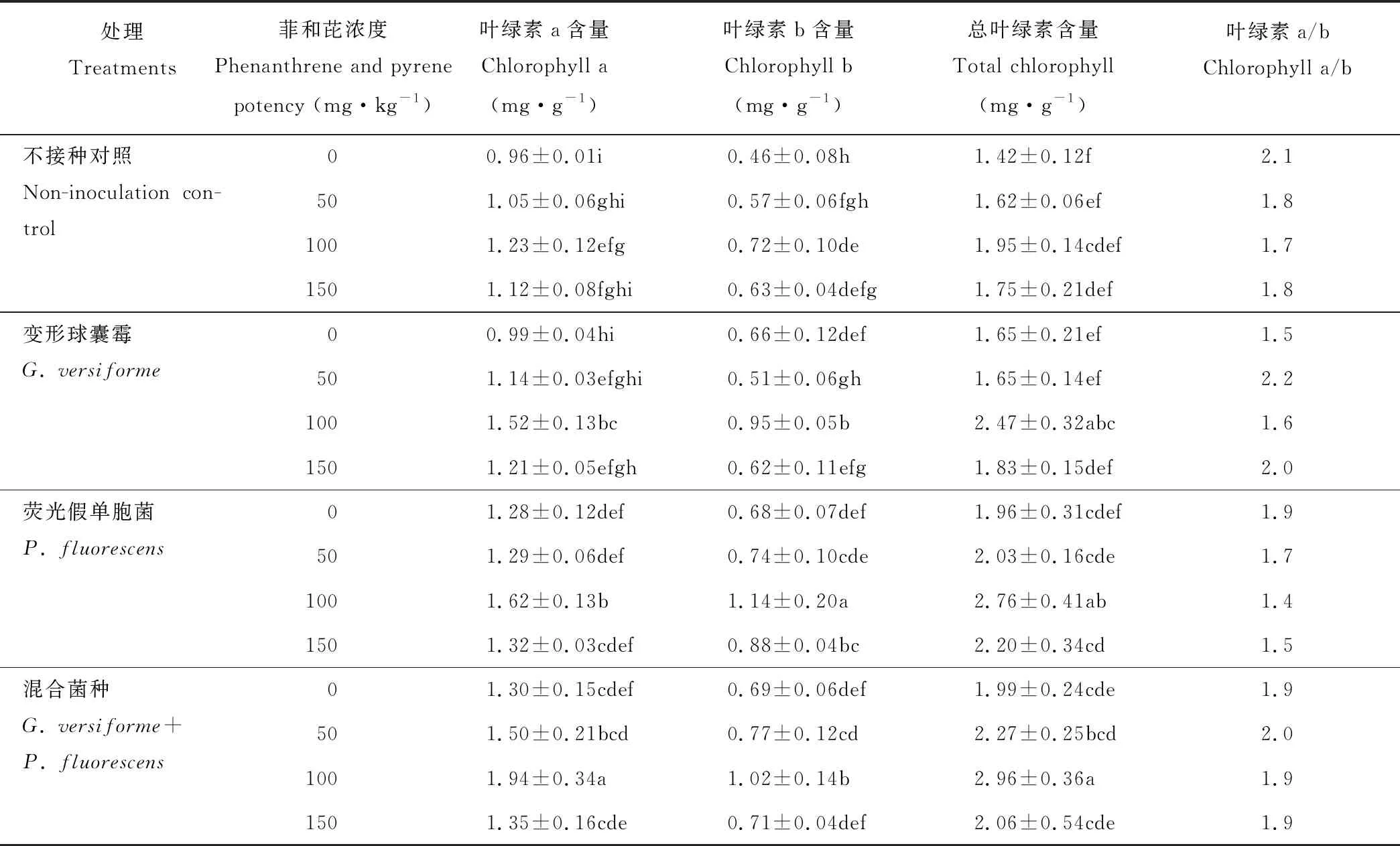
表1 AMF和PGPR对高羊茅叶片叶绿素含量的影响Table 1 Effects of AMF and PGPR on the content of chlorophyll in leaves of F. elata
注:同列不同小写字母表示处理间差异显著(P<0.05)。下同。
Note: In each column, different lowercase letters mean significant difference among treatments (P<0.05). The same below.
2.2 菲和芘胁迫下AMF和PGPR对高羊茅叶绿素荧光参数的影响
同一菲和芘浓度下,双接种变形球囊霉+荧光假单胞菌处理增加了高羊茅叶片PSⅡ潜在活性(Fv/Fo),对高羊茅叶片PSⅡ最大光化学效率(Fv/Fm)无显著影响。随菲和芘浓度的增加(0~100 mg·kg-1),Fv/Fm值和Fv/Fo值下降。接种AMF和PGPR后,Fv/Fm值和Fv/Fo值呈增加的趋势。100 mg·kg-1下,与CK相比,双接种变形球囊霉+荧光假单胞菌处理的高羊茅叶片Fv/Fm值和Fv/Fo值分别增加2.2%和8.8%;变形球囊霉处理下Fv/Fm值与对照无差异,Fv/Fo值比CK增加32.9%;荧光假单胞菌处理下Fv/Fm值和Fv/Fo值分别比CK增加1.3%和5.9%(图1)。可见,供试菲和芘所有浓度下,变形球囊霉和荧光假单胞菌处理不影响Fv/Fm值(P>0.05)。 接种荧光假单胞菌处理增加Fv/Fo值的效果大于变形球囊霉的处理。以上结果表明接种变形球囊霉和荧光假单胞菌均能不同程度提高Fv/Fo值,且共同接种处理的效果最大。方差分析表明菲和芘胁迫以及接种处理的交互作用对高羊茅叶绿素荧光参数无显著影响(表2)。
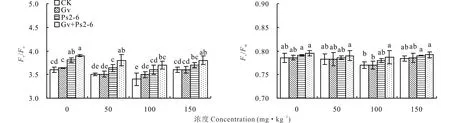
图1 菲和芘胁迫下AMF和PGPR对高羊茅PSⅡ最大光化学效率和潜在活性的影响Fig.1 Effects of AMF and PGPR on Fv/Fm and Fv/Fo of F. elata under phenanthrene and pyrene stress CK: 不接种对照Non-inoculation control; Gv:变形球囊霉G. versiforme; Ps2-6:荧光假单胞菌P. fluorescens;Gv+Ps2-6:混合菌种G. versiforme+P. fluorescens。不同小写字母表示处理间差异显著(P<0.05)。下同。The different lowercase letters mean significant differences among treatments (P<0.05). The same below.
2.3 菲和芘胁迫下AMF和PGPR对高羊茅光合参数的影响
同一菲和芘浓度下,接种AMF和PGPR显著增加了高羊茅叶片净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)。同一接种处理下,随菲和芘浓度的增加,Pn、Tr、Ci和Gs均呈先增加后下降的趋势。菲和芘100 mg·kg-1下,接种变形球囊霉处理的高羊茅叶片Pn、Tr、Ci和Gs分别增加2.9%、28.6%、1.1%和19.0%;接种荧光假单胞菌处理后分别增加35.3%、57.1%、2.9%和47.6%,双接种变形球囊霉+荧光假单胞菌处理后分别增加70.6%、100.0%、4.5%和78.6%,以上结果表明双接种处理的高羊茅光合参数高于变形球囊霉和荧光假单胞菌各处理(图2)。上述表明,供试菲和芘所有浓度下,单一接种变形球囊霉或荧光假单胞菌处理均可增加植物的净光合速率,以双接种变形球囊霉+荧光假单胞菌处理的效应最大,接种荧光假单胞菌处理增强光合作用的效应大于变形球囊霉的处理。菲和芘处理与接种处理对高羊茅净光合速率、气孔导度以及胞间CO2浓度的影响存在交互作用(表2)。
2.4 菲和芘胁迫下AMF和PGPR对高羊茅生理的影响
同一菲和芘浓度下,双接种变形球囊霉+荧光假单胞菌处理的高羊茅叶片SOD、CAT活性、可溶性糖和脯氨酸含量显著高于对照,差异显著;MDA含量显著低于对照。随菲和芘浓度的增加,SOD、CAT活性、可溶性糖含量先增加后减小,在100 mg·kg-1下达到最大,脯氨酸和MDA含量在菲和芘0~150 mg·kg-1浓度下一直增加。100 mg·kg-1下,与CK相比,双接种变形球囊霉+荧光假单胞菌处理的高羊茅叶片SOD、CAT活性、可溶性糖、脯氨酸含量分别增加57.5%、54.6%、134.2%、176.0%,MDA含量下降46.0%;变形球囊霉处理下CAT活性与对照差异不显著,SOD、可溶性糖、脯氨酸分别比CK增加33.0%、50.0%、8.3%,MDA下降23.6%;荧光假单胞菌处理下SOD、CAT、可溶性糖、脯氨酸分别比CK增加37.6%、9.0%、139.5%、72.9%,MDA下降29.2%(表3)。综上,供试菲和芘所有浓度下,单一接种变形球囊霉或荧光假单胞菌处理均可增加菲和芘胁迫下植物的抗氧化酶活性,以双接种变形球囊霉+荧光假单胞菌处理的效应最大,接种荧光假单胞菌处理提高抗氧化酶活性的效果大于变形球囊霉的处理。方差分析表明菲和芘胁迫以及接种处理的交互作用对高羊茅SOD、CAT、可溶性糖和脯氨酸含量有极显著影响(表2)。
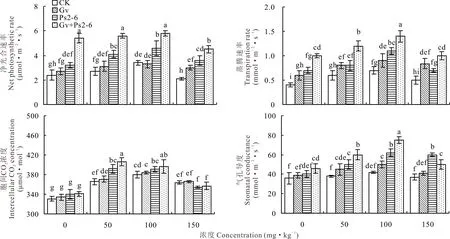
图2 菲和芘胁迫下AMF和PGPR对高羊茅Pn、Tr、Ci和Gs的影响Fig.2 Effects of AMF and PGPR on Pn、Tr、Ci and Gs of F. elata under phenanthrene and pyrene stress
2.5 菲和芘胁迫下AMF和PGPR对高羊茅生长和菌根侵染率的影响
同一菲和芘浓度下,接种AMF和PGPR显著增加了高羊茅株高和地上鲜重。随菲和芘浓度的增加,高羊茅株高和地上鲜重呈先增加后下降的趋势,且在100 mg·kg-1菲和芘浓度下达到最大值。菲和芘100 mg·kg-1下,与对照相比,双接种变形球囊霉+荧光假单胞菌处理的高羊茅株高和地上鲜重分别提高63.0%和69.6%(表4)。同一菲和芘浓度下,接种PGPR显著增加了高羊茅根系侵染率。随菲和芘浓度的增加,对AM真菌侵染率无明显影响。菲和芘100 mg·kg-1下,双接种变形球囊霉+荧光假单胞菌处理的高羊茅根系侵染率最高为48.4%;单接种变形球囊霉处理的侵染率达46.4%(图3)。说明供试条件下AMF与高羊茅可建立一定的共生关系,接种PGPR可促进AMF的定殖。可见,供试菲和芘所有浓度下,单一接种变形球囊霉或荧光假单胞菌处理均可增加菲和芘胁迫下植株的生物量,以双接种变形球囊霉+荧光假单胞菌处理的促进效应最大。方差分析表明菲和芘胁迫以及接种处理的交互作用对高羊茅株高和地上鲜重有显著影响(表2)。
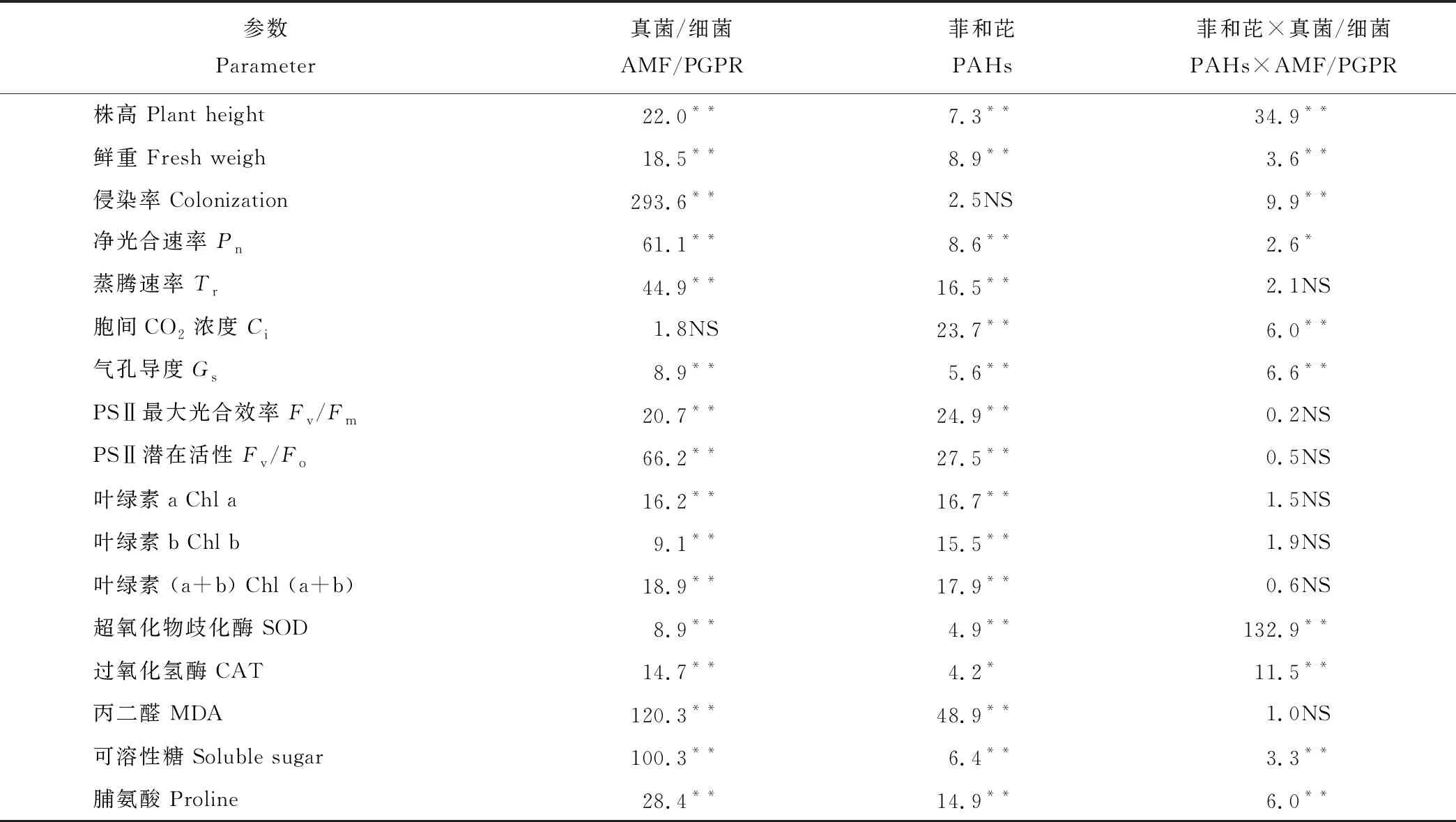
表2 菲和芘胁迫下高羊茅各指标方差分析Table 2 Correlation analysis of F. elata under phenanthrene and pyrene stress (PAHs)
注:NS表示不显著;*表示在P<0.05水平差异显著;**表示在P<0.01水平差异极显著。
Note: NS means no significant difference;*means significant difference atP<0.05 level; **means extremely significant difference atP<0.01 level.
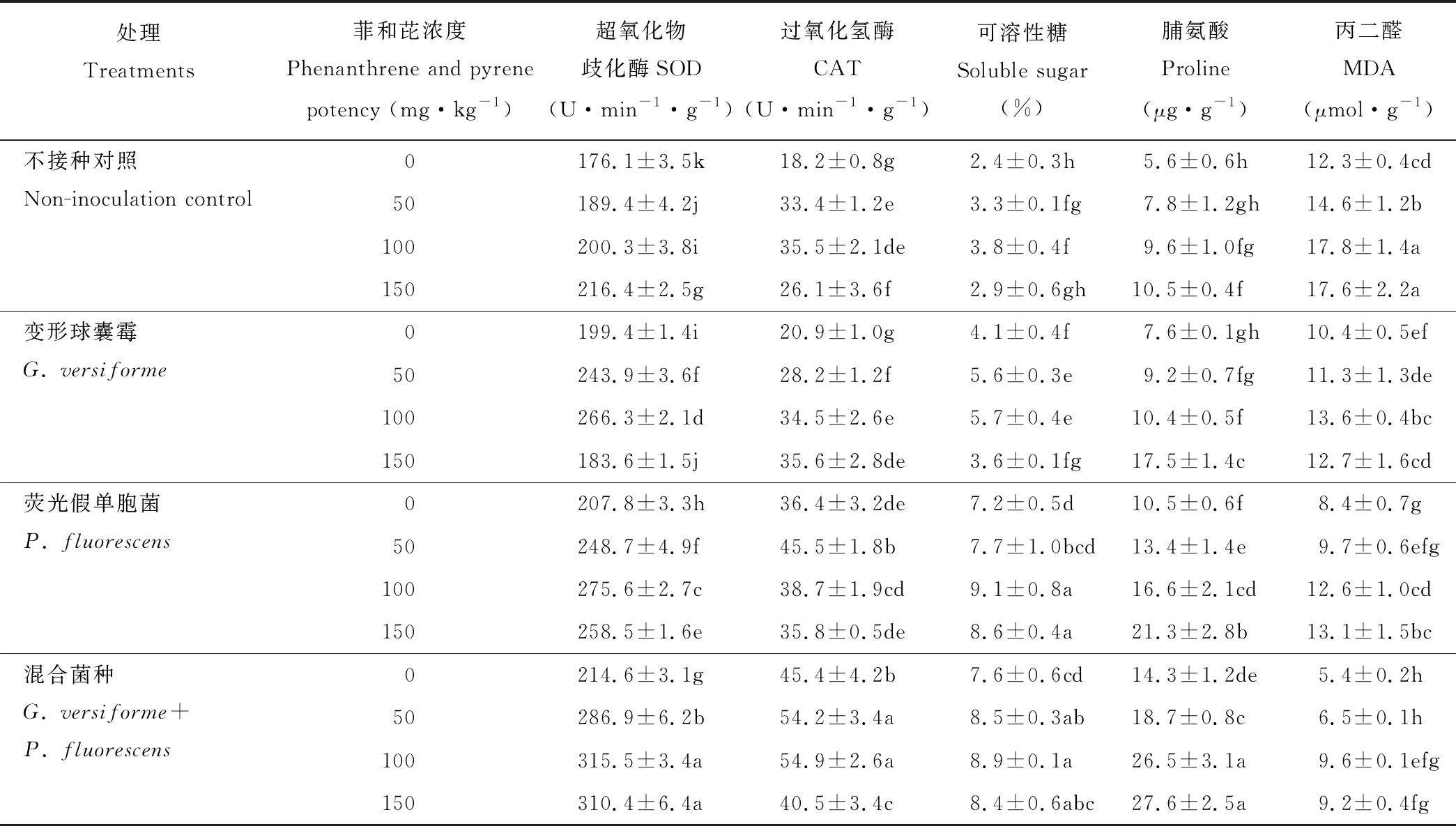
表3 菲和芘胁迫下AMF和PGPR对高羊茅生理的影响Table 3 Effects of AMF and PGPR on physiology of F. elata under phenanthrene and pyrene stress
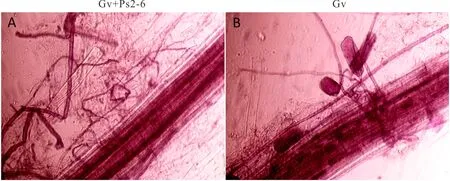
图 3 不同处理下高羊茅根系丛枝菌根真菌侵染的情况 Fig.3 Mycorrhizal colonization of F. elata roots under different treatments
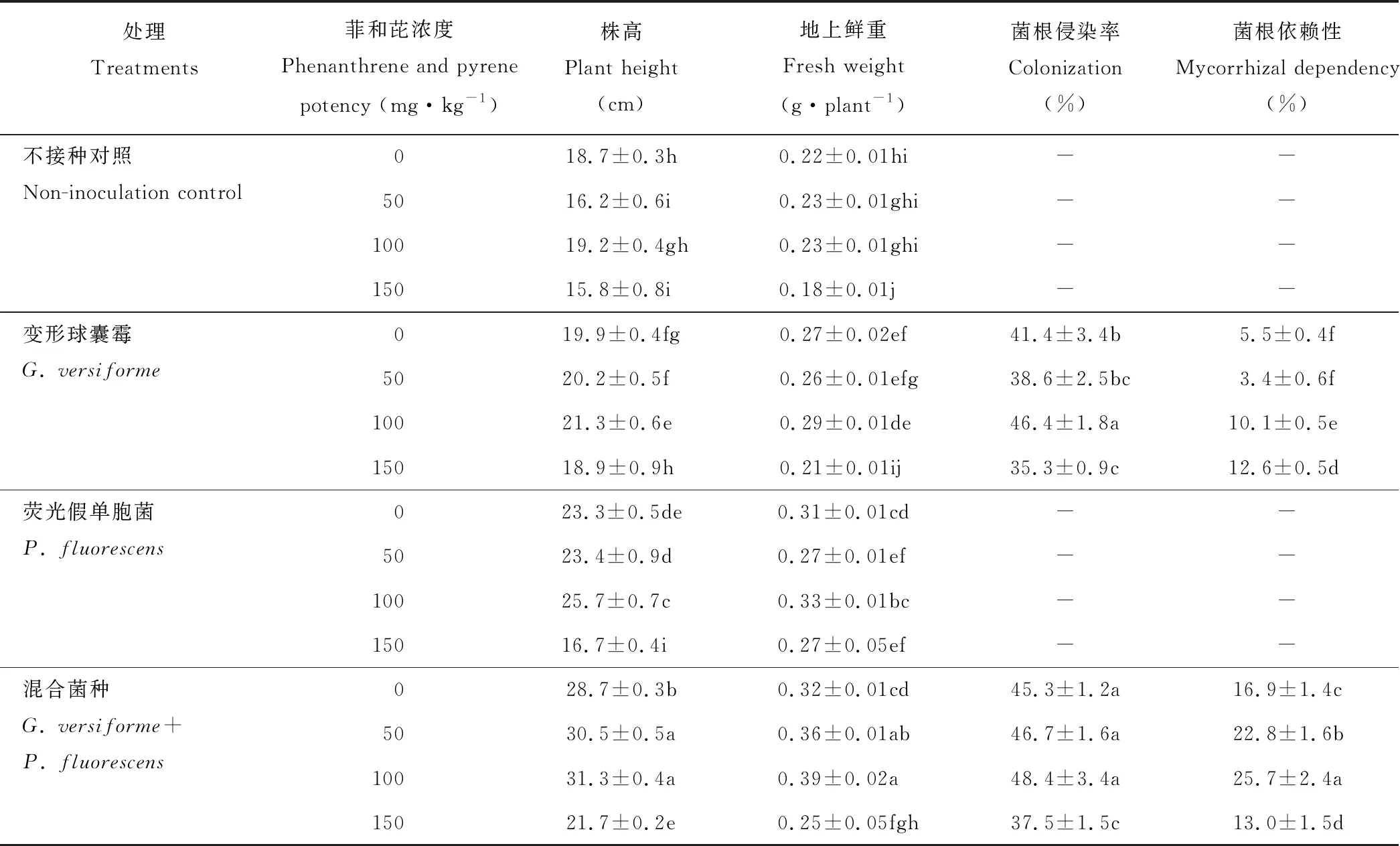
处理Treatments菲和芘浓度Phenanthrene and pyrene potency (mg·kg-1)株高Plant height(cm)地上鲜重Fresh weight(g·plant-1)菌根侵染率Colonization(%)菌根依赖性Mycorrhizal dependency(%)不接种对照Non-inoculation control018.7±0.3h0.22±0.01hi--5016.2±0.6i0.23±0.01ghi--10019.2±0.4gh0.23±0.01ghi--15015.8±0.8i0.18±0.01j--变形球囊霉G. versiforme019.9±0.4fg0.27±0.02ef41.4±3.4b5.5±0.4f5020.2±0.5f0.26±0.01efg38.6±2.5bc3.4±0.6f10021.3±0.6e0.29±0.01de46.4±1.8a10.1±0.5e15018.9±0.9h0.21±0.01ij35.3±0.9c12.6±0.5d荧光假单胞菌P. fluorescens023.3±0.5de0.31±0.01cd--5023.4±0.9d0.27±0.01ef--10025.7±0.7c0.33±0.01bc--15016.7±0.4i0.27±0.05ef--混合菌种G. versiforme+P. fluorescens028.7±0.3b0.32±0.01cd45.3±1.2a16.9±1.4c5030.5±0.5a0.36±0.01ab46.7±1.6a22.8±1.6b10031.3±0.4a0.39±0.02a48.4±3.4a25.7±2.4a15021.7±0.2e0.25±0.05fgh37.5±1.5c13.0±1.5d
3 讨论
研究表明丛枝菌根真菌或根围促生细菌单独接种均能促进多环芳烃胁迫下植物的生长[24]。菲和芘不同浓度胁迫下,接种变形球囊霉和荧光假单胞菌均促进高羊茅生长,同时有助于增强光合作用,但双接种变形球囊霉和荧光假单胞菌对高羊茅株高、生物量、叶绿素含量、叶绿素荧光Fv/Fm值和Fv/Fo值以及光合特性的提高效果优于单独接种变形球囊霉或荧光假单胞菌的效果(表1~4)。本试验表明低浓度菲和芘(0~100 mg·kg-1)下高羊茅叶绿素含量增加,而高浓度(150 mg·kg-1)下则降低,这可能是植物受到低浓度菲和芘的刺激作用促进叶绿素的合成;而高浓度下,植株生理代谢紊乱,叶绿素的合成途径受到阻碍,酶活性比例失调,或叶绿素快速分解,植株失绿[25]。叶绿素含量的降低,阻碍光合色素和光合成电子成分传递,从而导致高羊茅叶片气孔阻力增加,CO2进入气孔受阻,细胞间CO2浓度下降,叶片蒸腾速率和净光合速率下降,光合作用降低,进而抑制植株的生长。环境胁迫对植物的最直接影响是生长状况不良,大部分的植物对PAHs具有一定的最大耐受量,低浓度PAHs下,植物的不受影响或者影响较小,甚至刺激植物生长,而较高浓度植物生长受阻[26]。接种AMF和PGPR处理提高叶绿素含量、增强光合作用和生物量增加,这与AMF的菌丝与高羊茅根系结合扩大了根系的吸收面积、PGPR促进AMF对根系的侵染、增强N等矿质元素的吸收面积和转化能力不无关系[27-28];另外接种AMF和PGPR能通过菌丝吸附菲和芘,促进高羊茅根系对菲和芘的吸收,缓解植物胁迫与损伤,从而有利于植株的生长发育。 叶绿素荧光参数表现植物叶片在光合作用过程中光系统对光能的吸收、传递、耗散、分配等[29]。Fv/Fm值、Fv/Fo值是反映植物光抑制的重要指标。本试验菲和芘0~100 mg·kg-1下,Fv/Fm值和Fv/Fo值下降幅度降低,说明菲和芘胁迫下高羊茅叶片发生了光抑制现象;150 mg·kg-1菲和芘胁迫下与对照差异不显著,可能是由于在室内光环境相对较弱造成的。接种AMF和PGPR后对Fv/Fm影响不显著,Fv/Fo显著升高,说明接种处理能够增强植物叶片在光合过程中的传递等。在自然条件下有关菲和芘胁迫引起高羊茅光抑制的机制及原因有待进一步试验证明。
细胞膜能够调节和控制植物细胞内外环境之间的物质运输和交换,在菲和芘胁迫下,植物体内会产生较多的O2-、过氧化物和含氧自由基等,其不断积累会造成细胞膜脂过氧化,产生大量的MDA[30],同时植物体内存在着清除活性氧的关键酶(SOD、CAT等)、渗透调节物质(可溶性糖、脯氨酸等)等能够维持细胞膜结构的完整性,减轻活性氧自由基对细胞膜的伤害[31]。本试验观测到,与不施加菲和芘的对照相比,随着菲和芘浓度的增加,高羊茅叶片SOD、POD、可溶性蛋白含量先升高后下降,丙二醛和脯氨酸则逐渐升高,这与刘静等[32]的研究在菲和芘胁迫下互花米草(Spartinaalterniflora)抗氧化酶活性高于对照的结果一致,表明高浓度菲和芘胁迫下,细胞中活性氧自由基积累到一定程度,会使抗氧化酶的结构破坏或活性降低。接种AMF和PGPR均能缓解菲和芘胁迫,高羊茅叶片的SOD、CAT、可溶性糖和脯氨酸含量显著提高,MDA含量显著降低;双接种AMF+PGPR优于单独接种的效果可能是因为AMF自身繁殖和生长除依靠与植物根系形成共生体外,其外生菌丝也可以吸收有机污染物转化成二氧化碳和水或作为养分,同时外生菌丝能不断延伸并产生庞大的菌丝网络,通过菌丝网络强大的吸附能力与桥梁作用来吸收土壤中的菲和芘;而PGPR与植物构建的共生体系通过生物代谢消耗、氧化还原、生物浸取、螯合、分泌表面活性剂、分泌胞外聚合物、影响有机物转运等途径吸附土壤中的菲和芘。植物与AMF结合形成的共生体能够帮助植物从土壤中吸收利用营养物质和水分,加强了对氧自由基的清除能力,减缓活性氧对植物体内的伤害和膜脂过氧化程度,提高了高羊茅的抗逆性,进而影响植物根围微生物群落组成,而AMF和PGPR组合能够促进PGPR的定殖,同时PGPR能够促进AMF的孢子发育,增加侵染位点数以及侵染率,促使泡囊丛枝结构的形成。因此,在菲和芘胁迫下双接种AMF+PGPR能够达到更大的效果。
4 结论
综上所述,接种AMF和PGPR可提高菲和芘胁迫下高羊茅叶片的叶绿素含量、抗氧化酶活性,降低MDA含量,增加叶片净光合速率、蒸腾速率和胞间CO2浓度,显著增加植株的生物量。说明AMF和PGPR可以通过提高菲和芘胁迫下高羊茅叶片叶绿素含量和抗氧化能力,来增强植物光合作用能力和降低膜脂过氧化水平,从而缓解菲和芘胁迫对高羊茅造成的伤害,促进植物生长,提高植株的生物量。调控高羊茅在菲和芘胁迫下的基因表达以及AMF、PGPR与高羊茅对菲和芘污染土壤的遗传适应机制等有待进一步深入研究。

