具有肠道动力及肠道菌群调节功能乳杆菌的筛选及功能评价
沈旭丹,吉梦馨,翟齐啸,赵建新,张 灏,田丰伟*,陈 卫
(江南大学食品学院,江苏 无锡 214122)
功能性便秘是一种临床上常见的胃肠道疾病[1]。美国2011年流行病学调查发现,便秘在全世界的平均发病率为16%,其中中国约有20%~30%的人口受到便秘困扰[2]。功能性便秘的发病率逐年上升,且易受饮食、环境、情绪等多种因素影响,其中老年人发病率高于青壮年[3],女性患者多于男性[4],其临床症状主要表现为排便困难、次数少(频率低于3 次/周),粪便干硬,常伴有腹痛、腹胀等症状,一般慢性便秘的病程长达6 个月[5]。便秘的发生一般伴随着肠道动力及菌群失调,相关发病机制主要包括:膳食纤维、水分摄入较少或滥用刺激性泻药,肠道敏感性降低;肿瘤等疾病压迫肠道,肠蠕动受机械性阻碍;肠平滑肌张力降低,排便肌群活动障碍,蠕动减弱[6];肠道菌群紊乱[7]。有研究表明,便秘患者普遍存在焦虑、抑郁情绪,间接影响其在社会关系等领域的生活质量[8]。此外,长期便秘将会导致肠壁损伤,肠道中毒素聚集堆积,从而引起一系列全身性并发症[9]。功能性便秘的个体差异较大,目前医学上主要以针对缓解排便困难等症状,促进恢复正常的肠道动力为治疗目标,而市场上应用于治疗便秘以西药泻剂居多,诸如容积性泻剂、渗透性泻剂等,但泻剂对于便秘患者适用性较为局限,且容易产生药物依赖性,长期服用会出现诸如腹胀、维生素吸收障碍等各种类型的副作用[10]。
益生菌是指给予(摄入)充足的数量能对宿主产生一种或多种特殊且经临床论证的功能性健康益处的活的微生物[11],主要包括乳杆菌、双歧杆菌等。研究表明,某些益生菌的摄入,能产生细菌素有效抑制病原菌的生长繁殖,从而改善肠道菌群的结构以及缓减堆积的酚类物质的危害[12];此外,益生菌能产生大量的短链脂肪酸(short chain fatty acids,SCFAs),降低结肠的pH值和传输时间,从而促进肠道蠕动[13]。考虑到功能性便秘患者常伴有肠道菌群失调以及转运速率变慢,通过益生菌缓解便秘的研究逐渐引起重视,同时市场上也已出现了针对缓减便秘的微生物制剂。
目前常见的微生态制剂如培菲康、丽珠肠乐、整肠生、金双歧等,主要以混菌制剂较多,且以双歧杆菌和芽孢杆菌多见。有研究显示,植物乳杆菌、干酪乳杆菌等多种乳杆菌也具有调节肠道动力以及肠道菌群的功能,具有成为治疗便秘的微生态制剂的潜力。一项关于便秘人群的临床研究表明,服用植物乳杆菌SN13T制剂6 周后,便秘人群的排便次数显著增加,粪便指数趋近于4(4为最易排便的分数)[14]。此外,曹永强[15]利用盐酸洛哌丁胺建立便秘小鼠模型,发现摄入干酪乳杆菌N1115能促进和改善便秘小鼠的肠道推进率以及粪便质量,同时有效地缓解便秘导致的肠道损伤。
综合乳杆菌潜在的益生功能,本研究通过体外相关评价指标,综合考察了45 株来自泡菜或人类肠道的乳杆菌的生理特性,并对部分乳杆菌进行了抗生素耐药性评价,综合筛选出了3 株安全并具有优良特性的乳杆菌进行调节肠道功能的体内评价,以期获得具有调节肠道动力以及肠道菌群功能的乳杆菌,丰富益生菌资源库,并为其后续在肠道功能紊乱及相关疾病上的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
乳杆菌均来源于江南大学生物技术中心菌种保藏库,分别分离自发酵食品与健康人群新鲜粪便。菌株编号如下:LG1~LG4为格氏乳杆菌;LC5~LC13为干酪乳杆菌;LP14~LP22为植物乳杆菌;LB23~LB26为短乳杆菌;LB27~LB28为瑞士乳杆菌;LF29~LF39为发酵乳杆菌;LR40~LR45为鼠李糖乳杆菌。
1.1.2 培养基
MRS培养基 青岛海博生物技术有限公司;ISO-sensitest(IST)培养基 英国OXOID公司;LSM培养基:采用900 mL IST培养基、100 mL MRS培养基配制。
1.1.3 主要试剂
活性炭粉末、胰蛋白酶(1∶250) 上海生工试剂有限公司;胆盐 上海拜力生物科技有限公司;胃蛋白酶(1∶15 000) 美国Sigma公司;易蒙停盐酸洛哌丁胺胶囊(2 mg) 西安杨森制药有限公司;粪便样品基因组提取试剂盒(Fast DNA SPIN Kit for Feces) 美国MP公司;超薄琼脂糖凝胶DNA回收试剂盒(离心柱型)天根生化科技(北京)有限公司;低聚果糖(fructo oligosaccharides,FOS)、低聚半乳糖(galactooligosaccharides,GOS) 保龄宝生物股份有限公司;低聚木糖(xylo-oligosaccharides,XOS)(纯度95%)上海源叶生物科技有限公司。
低聚果糖的主要组成为40%~54%蔗果五糖、40%~42%蔗果四糖、6%~8%蔗果三糖以及5%葡萄糖;低聚半乳糖的主要组成为16%~21%低聚半乳二糖、38%~51%低聚半乳三糖、25%~29%低聚半乳四糖到八糖以及7%~10%乳糖。
1.1.4 实验动物
无特定病原体(specific pathogen free,SPF)级健康雄性BALB/c小鼠(生产许可证号:SCXK(沪)2018-0003),体质量为20~22 g。购于江苏苏普斯实验动物中心。
1.2 仪器与设备
电热恒温鼓风干燥箱、电热恒温水槽、HWS-150型恒温恒湿培养箱 上海森信实验仪器有限公司;磁力搅拌器 德国IKA公司;真空冷冻干燥机 美国LABCONCO公司;VarioskanLUX多功能微孔板读数仪、酶标仪 美国赛默飞世尔科技公司;GCMS-QP2100气相色谱-质谱联用仪 日本岛津公司;T100聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、水平琼脂糖凝胶电泳系统、Universal hood II凝胶成像仪 美国伯乐公司;Milli-Q水净化系统 密理博(中国)有限公司;DZQ500真空包装机 上海翔一包装机械有限公司;NanoPhotometer超微量紫外分光光度计 德国IMPLEN公司;FastPrep-24核酸快速提取仪 美国MP公司;MiSeq第二代高通量测序仪 美国Illumina公司;ZHJHC1115B型超净工作台 上海智诚分析仪器制造有限公司。
1.3 方法
1.3.1 乳杆菌的体外特性筛选
1.3.1.1 乳杆菌的培养
将利用体积分数30%的甘油保存的乳杆菌划线活化后,分别按体积分数2%的接种量接种至MRS液体培养基中,连续活化2 代后待用。
1.3.1.2 乳杆菌在模拟胃肠道中的耐受能力
模拟胃肠液的制备参考文献[16]。活化好的菌株调节菌液初始浓度至109CFU/mL,重悬于等体积模拟胃液中培养3 h,离心重悬于等体积模拟肠液中培养4 h,分别进行平板活菌计数,按照式(1)计算乳杆菌在耐酸耐胆盐后的存活率。

式中:C为耐酸耐胆盐后的菌液浓度/(CFU/mL);C0为菌液初始浓度/(CFU/mL)。
1.3.1.3 乳杆菌利用低聚糖能力的测定
受试低聚糖为FOS、XOS和GOS。溴甲酚紫作为显色剂,将活化后的菌液用生理盐水重悬后点在含不同碳源的固体培养基上培养10 h,观察培养基变色情况[17-18]。
1.3.1.4 乳杆菌产SCFAs能力的测定
将活化好的菌株调节菌液初始浓度至2×108CFU/mL,菌液、10%硫酸以体积比25∶1混合酸化,加入4 倍10%硫酸体积的乙醚,振荡混匀后,提取脂肪酸。18 000×g条件下离心15 min,分离上层乙醚相,并通过无水Na2SO4进行干燥;静置30 min后,18 000×g条件下继续离心5 min,用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析上层乙醚相中的SCFAs。GC-MS检测条件参考文献[17]中方法。
1.3.1.5 乳杆菌的抗生素耐受性评价
乳酸菌的抗生素安全性评价方法见参考文献[19]。其中,鼠李糖乳杆菌、发酵乳杆菌、干酪乳杆菌的最小抑菌浓度(minimum inhibitory concentration,MIC)对照菌株为ATCC 334;植物乳杆菌、短乳杆菌的MIC对照菌株为ATCC 14917。
1.3.2 乳杆菌对小鼠肠道功能的调节实验
1.3.2.1 灌胃菌株的制备
活化好的菌株洗涤3 次后重悬于12 g/100 mL的脱脂乳粉溶液中,-80 ℃保存。
1.3.2.2 动物实验设计
参考文献[20],将120 只BALB/c雄性小鼠随机分成10 组,每组12 只,分别为空白对照组(灌胃无菌生理盐水)、3 株菌不同剂量的干预组(高、中、低剂量分别为1×1010、1×109、1×108CFU/kg mb,分别用H、M、L表示),灌胃15 d。实验期间,饲养环境严格控制在温度(25±2)℃、相对湿度(50±5)%、光照12 h和黑夜12 h的环境中,小鼠自由进食、进水。本动物实验中所用的方法均经过江南大学伦理委员会审阅并批准(JN.No20170930b1101105),并符合欧盟实验动物指南(Directive 2010/63/EU)。
1.3.2.3 小鼠健康指标的测定
记录实验第0天和第15天小鼠的体质量、食物摄入量,实验结束后按式(2)计算小鼠食物利用率。

1.3.2.4 小鼠小肠推进率以及首粒排黑便时间的测定
灌胃第15天晚小鼠禁食过夜,次日随机给每组中6 只小鼠灌胃盐酸洛哌丁胺(模型组),30 min后灌胃活性炭溶液,记录小鼠的首粒排黑便时间。30 min后处死,测量小肠总长度,计量墨汁推进长度,按式(3)计算小肠推进率。

1.3.2.5 小鼠粪便水分质量分数以及SCFAs含量的测定
灌胃第15天上午收集每只小鼠的粪便,称量并记录每只小鼠粪便湿质量,干燥后记录干质量,按式(4)计算粪便的水分质量分数。粪便中SCFAs含量的测定参考
1.3.1.4 节中的方法。

1.3.2.6 小鼠粪便菌群组成的测定
根据粪便试剂盒说明书提取小鼠粪便样品中细菌基因组,并以此为模板,扩增16S rDNA的V4区,PCR验证后进行切胶回收,回收产物按照Quant-iT PicoGreen dsDNA Assay Kit试剂盒说明书进行定量。根据PicoGreen荧光染料的定量结果,按等质量浓度混合样品,样品之间barcode不重复;按照Illumina建库试剂盒TurSeq DNA LT Sample Preparation Kit说明书构建文库,主要包括末端修复、3'端加A、接头连接以及PCR扩增等步骤。文库构建完成后,采用Bioanalyzer 2100仪测定DNA片段大小;按照KAPA Biosystems Library Quantification Kit试剂盒说明书,采用定量PCR法精确测定文库的DNA质量浓度。上机测序前的准备工作、上机测序以及测序完成后下机数据处理参照文献[21]中的方法进行。
1.4 数据统计与分析
数据表示为每组数据的平均值±标准差,实验均设有至少3 组平行,统计分析图通过GraphPad Prism 5和Origin 8.5软件完成。采用SPSS软件中的单因素方差分析和Duncan's多量程检验对各组平均值的差异进行分析。
2 结果与分析
2.1 乳杆菌的体外特性分析
2.1.1 乳杆菌在模拟胃肠道中的耐受能力
研究表明,益生菌对肠道功能的调节能力与其在肠道中的活菌数密切相关。Li Xiangfei等[22]分别用干酪乳杆菌死菌和活菌处理糖尿病小鼠,结果发现相较于死菌,活菌更加显著地提高了小鼠肠道内SCFAs的浓度以及Akkermansia等有益菌的相对丰度,同时促进了糖尿病小鼠肠道内普遍偏少的L细胞的增殖,通过肠道相关功能的改善进一步缓减了糖尿病症状。因此,益生菌能否通过胃酸环境,继续耐受肠道的高胆盐,并以活菌形式到达小肠是其在肠道中发挥作用的前提。
本实验参考了常用的模拟胃肠道方法,探究初始浓度均为2×108CFU/mL的不同乳杆菌在先耐受pH值为3.0的胃液3 h,继续耐受含3 g/L胆盐的肠液4 h后的存活情况。结果发现,不同乳杆菌的耐酸、耐胆盐能力存在显著差异,其中瑞士乳杆菌LB25最高,达到了34.18%,而最低的格氏乳杆菌LG1的存活率仅有0.15%。同时本实验以标准菌株鼠李糖乳杆菌LGG作为耐酸、耐胆盐实验的标准参考,其耐酸、耐胆盐后的平均存活率为6.35%,与Mandal等[23]测得LGG耐受0.3%胆盐2 h后的平均存活率81%相差较大,而与Li Chun等[24]探究的冻干粉LGG在耐受等质量浓度的肠液4 h后的存活率为4.74%较为相近。通过实验方法的比较,推测可能是由于Mandal等的实验过程中采用MRS培养基作为胆盐的载体,耐受环境营养丰富,适宜乳杆菌的生长,从而缓减了胆盐对LGG的损伤程度。而Li Chun等实验方案和结果与本实验较为相似,也进一步表明本实验结果的可信度。本实验各菌株的耐酸耐胆盐结果如图1所示,在连续经受胃液和肠液后,受试乳杆菌的存活率均显著降低,仅有11 株乳杆菌的最终存活率在10%以上,其中LC9、LP17、LB25、LF38的存活率在20%以上,表现出了良好的耐酸、耐胆盐能力。
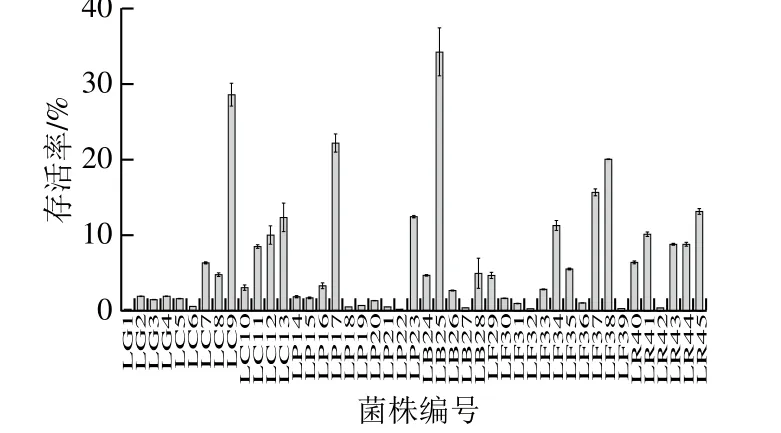
图1 乳杆菌耐酸耐胆盐后的存活率Fig. 1 Tolerance of Lactobacillus to simulated gastric juice and intestinal juice
2.1.2 乳杆菌利用低聚糖特性的研究
FOS、GOS、XOS均为功能性低聚糖,此类低聚糖不能被机体吸收,乳杆菌如果能利用低聚糖,在肠道中快速生长繁殖,就能占领优势生态位,改变肠道菌群的结构,同时发酵产生SCFAs,调节结肠pH值,抑制致病菌的增殖[25],此外还能促进矿物质吸收、脂肪代谢以及调节机体的免疫,有利于宿主的健康[26]。
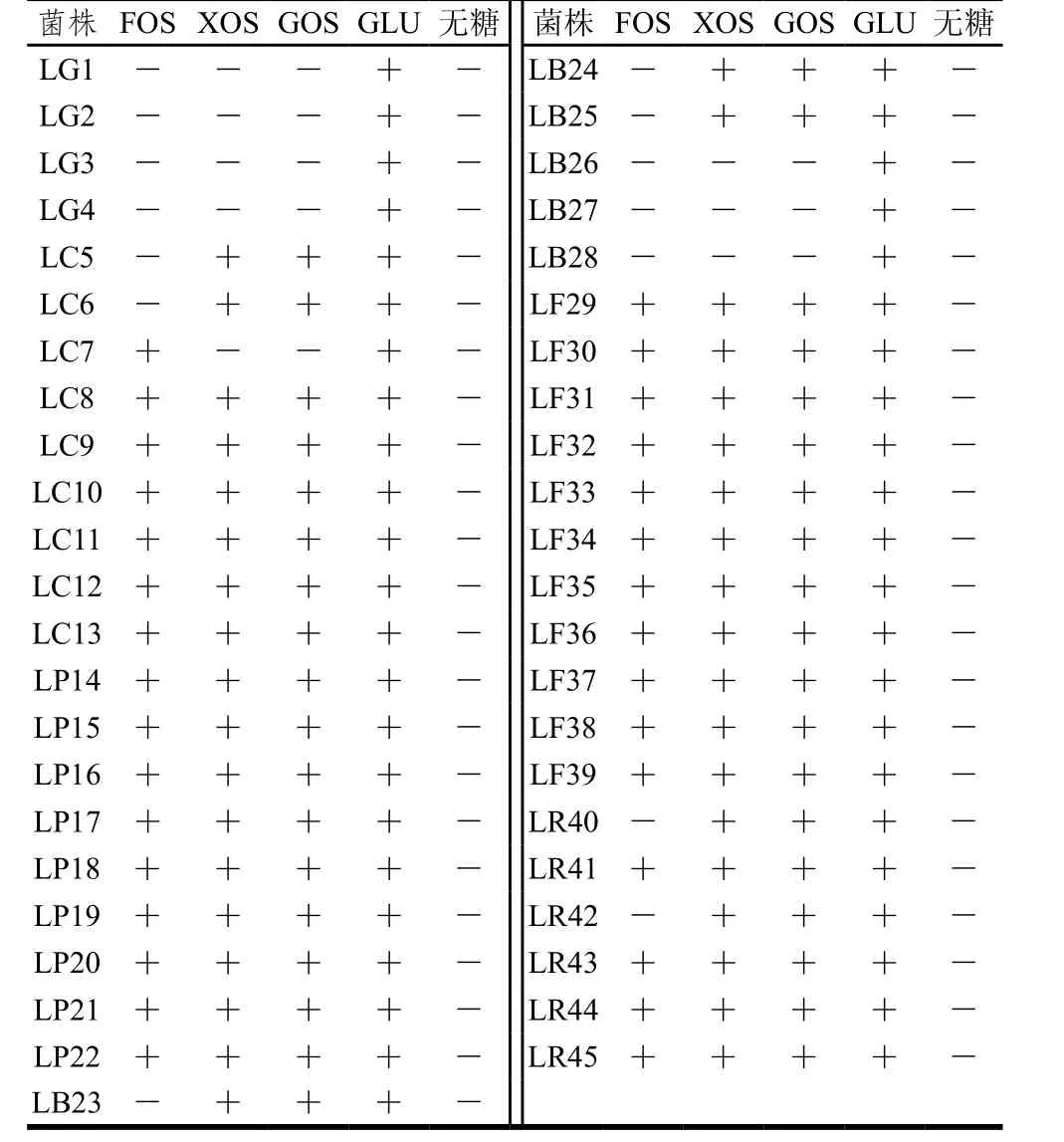
表1 乳杆菌对低聚糖的偏好性Table 1 Preferential utilization of oligosaccharides by Lactobacillus
由表1可知,干酪乳杆菌、植物乳杆菌、发酵乳杆菌以及鼠李糖乳杆菌普遍都能利用这3 种低聚糖,但个体之间存在一定的差异。乳杆菌代谢低聚糖时需要借助于转运蛋白以及胞内糖苷酶的参与。Goh等[27]总结了4 种乳杆菌代谢FOS、GOS的不同途径,指出不同种/株乳杆菌在代谢低聚糖时可能受转运蛋白数量、ATP数量等因素的制约,从而解释了本实验中菌株之间对低聚糖利用能力的差异性。此外,Gänzle等[28]综合了17 种乳杆菌中编码4 类低聚糖代谢的基因分布,发现干酪乳杆菌以及植物乳杆菌中相关代谢基因比较丰富,可能具有良好的低聚糖利用能力,这与本实验结果一致。2.1.3 乳杆菌产SCFAs能力的研究
乳杆菌在体内发酵低聚糖产生SCFAs,主要为乙酸、丙酸、丁酸等。这些SCFAs参与机体相关代谢,能促进机体对某些电解质的吸收以及肠上皮细胞的增殖,调节肠道免疫,恢复胃肠道的完整性和功能性,间接干预其他生理效应[29]。因此,乳杆菌产SCFAs的能力也是评价其对肠道功能调节作用的一个重要指标。
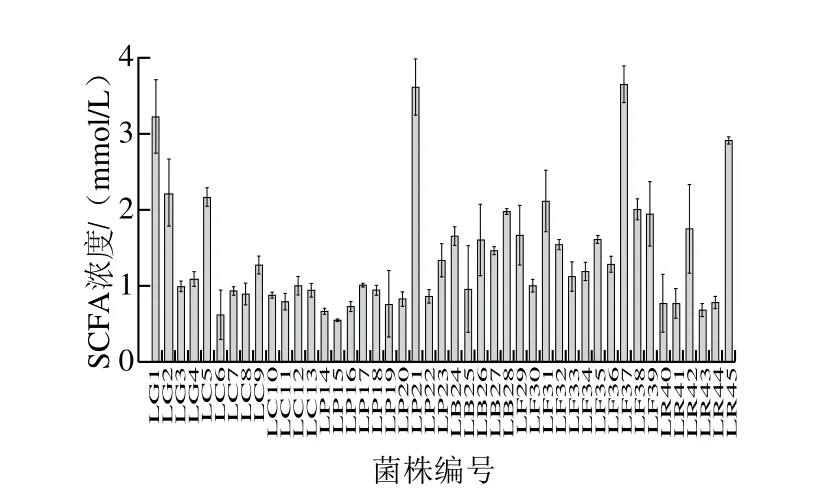
图2 不同乳杆菌产SCFAs能力的比较Fig. 2 Comparison of contents of short chain fatty acids produced by various Lactobacillus strains
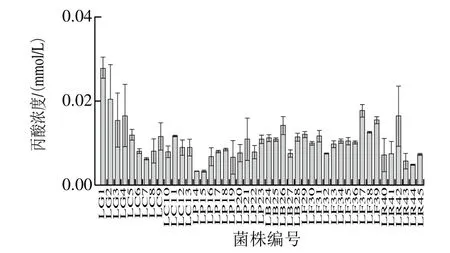
图4 不同乳杆菌产丙酸能力的比较Fig. 4 Comparison of contents of propionic acid produced by various Lactobacillus strains

图5 不同乳杆菌产丁酸能力的比较Fig. 5 Comparison of contents of butyric acid produced by various Lactobacillus strains
由图2~5可知,乙酸的产量占SCFAs总产量的绝大部分,其中所有的受试乳杆菌均可以产4 种SCFAs,但产酸能力具有差异性,格氏乳杆菌LG1((3.20±0.50)mmol/L)、植物乳杆菌LP21((3.60±0.38)mmol/L)、发酵乳杆菌LF37((3.64±0.24)mmol/L)和鼠李糖乳杆菌LR45((2.90±0.05)mmol/L)具有良好的产SCFAs能力。
2.1.4 乳杆菌的安全性评价
微生物对抗生素的耐受能力往往源于其固有耐药性或获得性耐药性。其中,故有耐药性为天然耐药性,抗性基因位于染色体上,相对稳定;而获得性耐药性主要是由基因的水平转移产生,此类基因多位于质粒上,而质粒转移的宿主范围十分广泛[30]。Štšepetova等[31]通过检测肠道菌对多种不同抗生素的耐药能力及其耐药基因,进一步验证了微生物的耐药性可能来自于质粒。一般认为,肠道细菌若具有抗生素耐药基因,且耐药基因不稳定,则可能通过水平转移至致病菌,从而危害人体健康。有研究表明,极少数乳杆菌菌株的耐药性基因是由质粒编码的[32],因此,评价乳杆菌的抗生素耐受性对其安全使用具有重要意义。
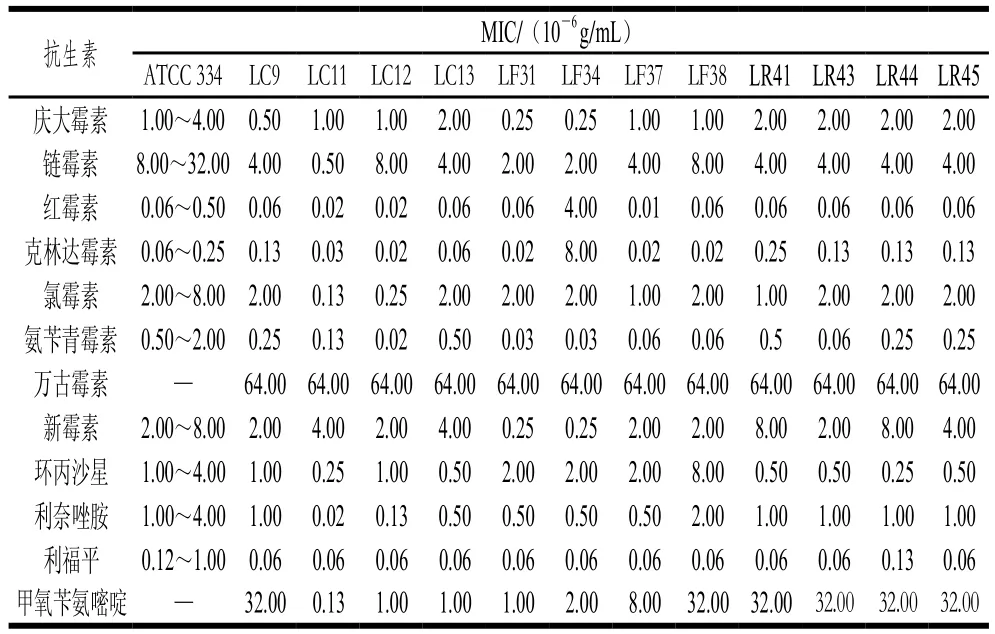
表2 不同乳杆菌的抗生素MIC(A)Table 2 Minimal inhibitory concentrations of antibiotics against various Lactobacillus strains (A)
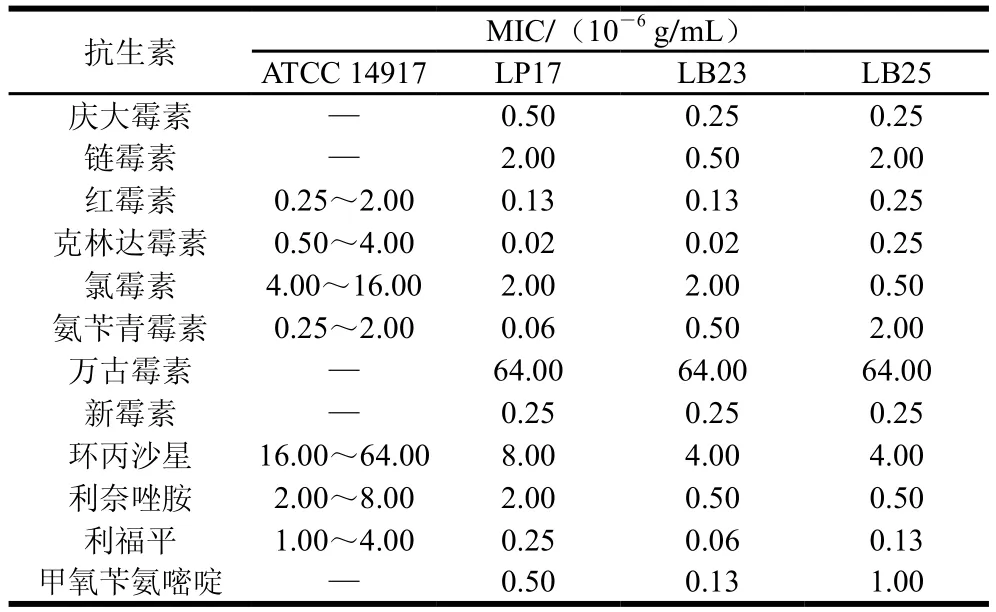
表3 不同乳杆菌的抗生素MIC(B)Table 3 Minimal inhibitory concentrations of antibiotics against various Lactobacillus strains (B)
本实验根据乳杆菌耐酸耐胆盐、低聚糖利用及产SCFAs能力的结果,综合选择15 株生理性质较好的乳杆菌进行抗生素安全性评价,评价方法参考ISO 10932—2010。由表2、3可知,除发酵乳杆菌LF34外,其余14 株乳杆菌的抗生素安全性均符合要求,氯霉素MIC为1.30×10-7~20.00×10-7g/mL,红霉素MIC为1.00×10-9~250.00×10-9g/mL,克林达霉素MIC为2.00×10-8~25.00×10-8g/mL,新霉素、链霉素和庆大霉素的MIC分别为2.50×10-7~80.00×10-7、5.00×10-7~80.00×10-7、2.50×10-7~20.00×10-7g/mL。与前人研究一致,受试乳杆菌对能够抑制蛋白质合成的抗生素如氯霉素、红霉素等较敏感[33]。
2.2 乳杆菌对小鼠肠道功能的调节作用
2.2.1 所选菌株对小鼠健康指标的影响
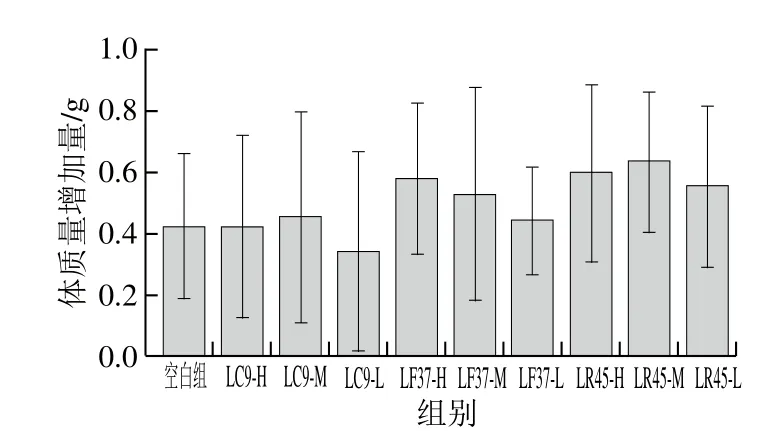
图6 实验期间小鼠的体质量增加量Fig. 6 Body mass gains of mice

图7 实验期间各组小鼠的食物利用率Fig. 7 Food utilization rates of mice
综合考虑耐酸、耐胆盐、低聚糖利用能力、产SCFAs能力以及抗生素耐受性,发现干酪乳杆菌LC9、发酵乳杆菌LF37和鼠李糖乳杆菌LR45能在肠道中保持更好活性,因此,挑选这3 株菌进行研究。由图6、7可知,各实验组小鼠的体质量在实验过程中略有上升,而除干酪乳杆菌LC9-L干预组的食物利用率低于空白组外,其余干预组的食物利用率均高于空白组,且组间并没有显著性差异,说明所选3 株乳杆菌灌胃15 d后对小鼠的健康无负作用。
2.2.2 所选菌株对小鼠肠道运动的影响
小肠推进率与首粒排黑便时间分别反映了小肠和整个肠道的运动能力。在肠道蠕动抑制模型造模过程中,与空白组相比,模型组小肠推进率显著降低,首粒排黑便时间显著延长,说明造模成功[21]。
由图8、9可知,干酪乳杆菌LC9和发酵乳杆菌LF37这2 株菌的3 个剂量组小肠推进率均显著高于模型组,以及首粒排黑便时间均显著低于模型组,说明这2 株菌可以促进肠道蠕动,加速排便。而鼠李糖乳杆菌LR45改善肠道运动能力上具有浓度依赖效应。
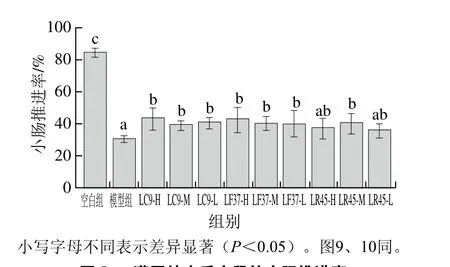
图8 灌胃结束后小鼠的小肠推进率Fig. 8 Small intestinal transition rates of mice after gavage
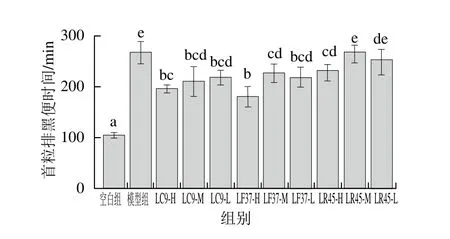
图9 灌胃结束后小鼠的首粒排黑便时间Fig. 9 First black stool defecation time of mice after gavage
根据《保健食品检验与评价技术规范》[20]中的评判标准,小肠推进率实验与黑便实验结果均为阳性即可判定干酪乳杆菌LC9、发酵乳杆菌LF37和鼠李糖乳杆菌LR45具有提高肠道动力/促进排便的保健功能。
2.2.3 所选菌株对小鼠粪便水分质量分数以及SCFAs含量的影响
粪便水分质量分数和SCFAs含量是评价粪便质量的2 个重要指标。大便干燥容易引起便秘,而SCFAs主要是由结肠内厌氧菌发酵碳水化合物产生,可以降低肠道pH值,增殖有益菌、抑制有害菌以调节肠道菌群,改善肠道功能[34]。王琳琳[21]将4 种SCFAs分别处理实验小鼠,发现处理后小鼠血清中5-羟色胺分泌增加,肠道肌肉收缩、蠕动能力增强,结肠转运速率加快。

图10 灌胃第15天时小鼠的粪便水分质量分数Fig. 10 Defecation status of mice on Day 15 of intragastric administration
由图10可知,各组小鼠的粪便形态和粪便水分质量分数均在正常范围内,干预组干酪乳杆菌LC9-H、LC9-M组小鼠的粪便水分质量分数显著高于空白组。
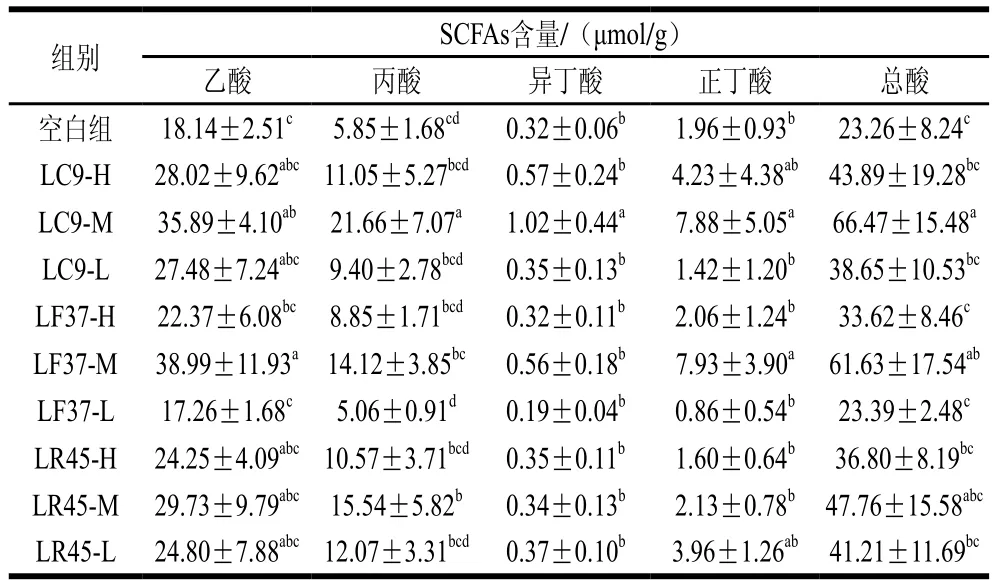
表4 灌胃第15天时小鼠粪便中SCFAs的含量Tab. 4 Contents of SCFAs in feces on Day 15 of intragastric administration
前期实验结果表明,灌胃菌液前,各组小鼠肠道内各种SCFAs含量并无显著差异。由表4可知,灌胃后各乳杆菌处理组小鼠的SCFAs含量均呈现上升趋势,其中,干酪乳杆菌LC9-M组乙酸、丙酸、异丁酸、正丁酸的含量均显著增加,发酵乳杆菌LF37-M干预组乙酸与正丁酸的含量显著上升,鼠李糖乳杆菌LR45-M组丙酸的含量显著上升。体外实验表明受试乳杆菌具有一定的产SCFAs能力,从而解释了其摄入后小鼠粪便内SCFAs含量的提高。但SCFAs增加量显著高于其体外产酸能力,可能是受试乳杆菌在小鼠肠道内产生一定量的SCFAs,降低了肠道pH值,从而促进了产SCFAs菌株的生长,进一步提高了肠道中SCFAs的含量。
2.2.4 所选菌株对小鼠粪便菌群的影响

图11 小鼠粪便菌群门水平相对丰度Fig. 11 Relative abundance of mouse fecal microbiota at phylum level
由图11可知,小鼠粪便菌群中共检测出7 个门,主要由Firmicutes((26.7±4.5)%)和Bacteroidetes((61.6±0.3)%)组成,除干酪乳杆菌LC9-H外的所有干预组小鼠粪便中Verrucomicrobia的相对丰度与空白组相比均明显增加,其中干酪乳杆菌LC9-H、发酵乳杆菌LF37-H、鼠李糖乳杆菌LR45-L干预组小鼠粪便中Firmicutes的相对丰度明显降低,干酪乳杆菌LC9-M、LC9-L干预组小鼠粪便中Proteobacteria的相对丰度明显增加。
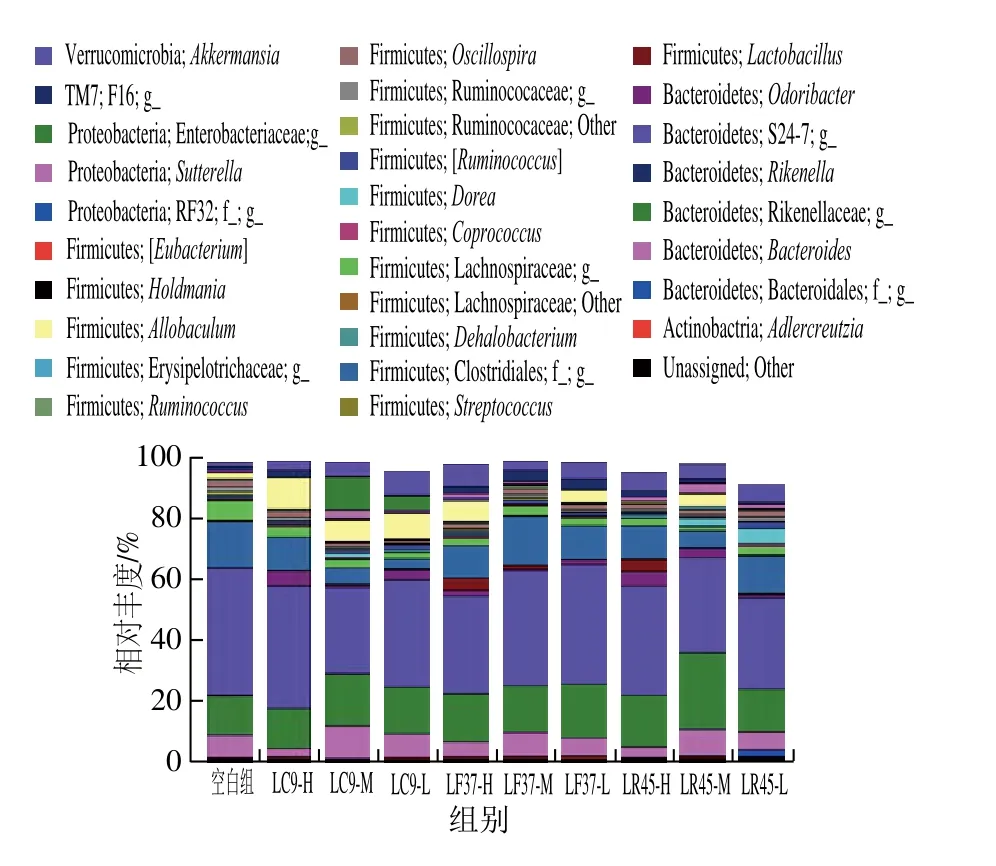
图12 小鼠粪便中相对丰度大于0.1%的菌属Fig. 12 Relative abundance of genera above 0.1% in mouse fecal microbiota
由图12可知,小鼠粪便菌群中共检测出254 个属,其中相对丰度超过0.1%的属有30 个。小鼠肠道菌群中相对丰度最高的2 个优势属分别属于S24-7与Rikenellaceae。与空白组相比,所有干预组小鼠粪便中Lactobacillus、Akkermansia的相对丰度均明显增加,除发酵乳杆菌LF37-M、鼠李糖乳杆菌LR45-H、LR45-L外,其余干预组Allobaculum的相对丰度明显增加,而Clostridiales的相对丰度明显下降。此外,所有干预组Lachnospiracea未知菌属的相对丰度明显降低。
Akkermansia属于Verrucomicrobia门,研究表明,Akkermansia能通过降解黏蛋白产生SCFAs,对宿主代谢异常如肥胖以及免疫疾病如肠道炎症等有一定调节作用[35],而Allobaculum、Clostridiales属于Firmicute门,其中Allobaculum与饮食中脂肪含量的高低密切相关,能促进肠道丙酸的产生,改善肠道微环境[36],Akkermansia、Allobaculum相对丰度的提高进一步解释了小鼠肠道内SCFAs含量的增加。此外,有研究显示,Clostridiales相对丰度的增加可能与一些肠道并发症如结肠炎等的发生有关[37]。综合门、属水平的菌群差异可知,所选乳杆菌对肠道菌群结构有一定的调节作用。
3 结 论
诸多研究表明,肠道功能紊乱与功能性便秘等肠道疾病密切相关,而外源性益生菌的补充能有效地调节肠道功能[38]。本实验通过乳杆菌生理特性体外实验的筛选与动物实验的功能评价,最终从45 株乳杆菌中筛选出3 株具有调节肠道功能的乳杆菌,分别为干酪乳杆菌LC9、发酵乳杆菌LF37和鼠李糖乳杆菌LR45,这3 种乳杆菌在耐受模拟胃肠道消化后仍能保持一定的活性,能发酵3 种低聚糖,兼备良好的产SCFAs能力。通过动物实验发现,这3 株菌均可以提高小鼠的小肠推进率,缩短首粒排黑便时间,促进肠道蠕动,并进一步增加了有益菌在肠道菌群中的相对丰度,改善粪便菌群结构。因此,这3 株菌可以作为潜在的益生菌,应用于肠道功能的调节。

