Toll样受体4与NOD样受体3炎性小体在肥胖合并急性坏死性胰腺炎大鼠肝损伤中的作用
梅方超 余佳 洪育蒲 李满 周瑜 尤运冬 夏鹤 金洪忠 王卫星
武汉大学人民医院普外科,武汉 430060
肝脏是胰腺血液回流的第一站,急性胰腺炎(AP)时胰腺血流中的细胞因子及炎症递质可引起急性肝损伤,从而进一步加重胰腺炎病情,影响患者的预后。近年来随着人们生活水平的提高和生活方式的改变,肥胖发生率呈逐年上升的趋势,肥胖可增加AP的发病率且可加重AP的病情[1-2]。有研究发现肥胖合并AP的患者肝组织炎症因子如白细胞介素(interleukin,IL)-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)水平较非肥胖者明显升高,认为肥胖可以通过增加炎症因子的表达加重肝损伤[3]。但肥胖加重炎症反应进而加重肝损伤的机制尚不完全明确。本研究拟通过建立肥胖合并急性坏死性胰腺炎(ANP)大鼠模型,探讨肥胖加重AP时肝损伤的可能机制。
材料与方法
一、材料与试剂
高脂饲料(D12492)购自北京华阜康公司,普通饲料由武汉大学人民医院统一配制。牛磺胆酸钠购于美国Sigma公司,使用前用无菌生理盐水溶解配制成5%牛磺胆酸钠溶液。髓过氧化物酶(myeloperoxidase,MPO)、Toll样受体4(Toll-like receptor 4,TLR4)、NOD样受体3(NOD-like receptor 3,NLRP3)、核因子κB(nuclear factor-κB,NF-κB)、IL-1β、半胱氨酸蛋白酶3(caspase-3)抗体购自武汉谷歌公司,白细胞分化抗原68(cluster of differentiation 68,CD68)、荧光二抗购自英国Abcam公司,即用型非生物素免疫组织化学EliVisionTMsuper检测试剂盒购自福州迈新生物科技公司,丙二醛(malodiadehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自碧云天生物科技公司。
二、动物模型制备及实验分组
SPF级SD大鼠24只,体重180~200 g(湖南斯莱克景达实验动物有限公司提供)。按数字表法随机分为正常组、ANP组、肥胖组、肥胖ANP组,每组6只。正常组及ANP组给予普通饲料喂养8周;肥胖组及肥胖ANP组给予高脂饲料喂养8周。8周后,正常组及肥胖组大鼠直接处死;ANP组及肥胖ANP组通过胰管逆行注射5%牛磺胆酸钠溶液(1.0 ml/kg体重)制备ANP模型[4],造模后12 h处死。
三、血清生物化学指标检测
处死前经下腔静脉采血,离心分离血清,-80℃保存。用全自动生化仪(日本奥林巴斯2700)检测血清淀粉酶(amylase,AMY)、脂肪酶(lipase,LIP)、丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、三酰甘油(triglyceride,TG)及总胆固醇(total cholesterol,TC)水平。
四、胰腺和肝组织病理学检查
大鼠处死后取胰头和肝组织于4%甲醛溶液中固定,常规行病理学检查,并根据Schmidt等[5]的方法对胰腺水肿、腺泡坏死、出血、脂肪坏死、炎症和血管周围炎性浸润程度进行评分;根据Mota等[6]的方法对肝脏细胞的空泡变、炎症细胞浸润、坏死等进行评分。
五、肝组织SOD及MDA检测
取新鲜大鼠肝组织,制备肝组织匀浆,采用硫代巴比妥酸比色分析法检测肝组织MDA水平,采用黄嘌呤氧化酶法检测SOD水平。
六、肝组织中CD68、TLR4、NLRP3、MPO、IL-β、NF-κB及caspase-3表达检测
取肝组织切片,采用免疫荧光法检测CD68、TLR4、NLRP3、MPO、IL-β水平。在EDTA缓冲液中微波修复抗原,加入10%驴血清室温下孵育45 min,加入羊抗鼠CD68(1∶200)、TLR4 (1∶300)、NLRP3 (1∶300)、MPO (1∶300)及IL-1β(1∶300)抗体,湿盒中4℃孵育过夜。室温下复温1 h,加入二抗(1∶200)室温下孵育45 min,DAPI染核。荧光显微镜下观察拍照,细胞质呈红色或绿色为阳性,用Image pro-Plus软件进行分析。
采用免疫组织化学法检测肝组织NF-κB、caspase-3水平。肝组织切片在柠檬酸钠缓冲液中高压修复抗原,加入3%双氧水室温下孵育10 min,加入羊抗鼠NF-κB、caspase-3抗体(1∶300),湿盒中4℃孵育过夜。室温下复温1 h,加入试剂A液(35 μl)室温下孵育15 min,加入试剂B液(35 μl)室温下孵育15 min,DAB显色,苏木精复染,中性树胶封片。光镜下观察拍照,细胞核呈棕黄色染色或胞质中出现棕黄色颗粒为阳性,用Image pro-Plus软件进行分析。
七、统计学处理
结 果
一、各组大鼠血清AMY、LIP、ALT、AST、TG、TC水平比较
肥胖组血清TG、TC水平显著高于正常组,其他指标无显著差异。除TG外,ANP组其他指标均显著高于正常组和肥胖组(P值均<0.05)。肥胖ANP组所有指标与其他3组差异均有统计学意义(P值均<0.05,表1)。

表1 各组大鼠AMY、LIP、ALT、AST、TG、TC水平比较
注:与正常组比较,aP<0.05;与ANP组比较,bP<0.05;与肥胖组比较,cP<0.05
二、各组大鼠胰腺、肝脏病理评分比较
正常组和肥胖组胰腺结构正常,无胰腺腺泡水肿、出血及炎症细胞浸润,病理评分分别为(0.50±0.54)、(0.66±0.51)分,差异无统计学意义;肥胖ANP组胰腺腺泡水肿、出血、坏死、炎症细胞浸润程度较ANP组明显加重,病理评分显著高于ANP组[(12.50±1.04)分比(9.5±1.04)分],差异有统计学意义(P<0.05,图1A~1D)。
正常组和肥胖组肝脏病理评分分别为(0.33±0.51)、(0.66±0.51)分,差异无统计学意义;肥胖ANP组肝细胞水肿、坏死、炎症细胞浸润程度均较ANP组加重,病理评分高于ANP组[(6.66±1.21)分比(3.33±1.03)分],差异有统计学意义(P<0.05,图1E~1H)。
三、各组大鼠肝组织MDA、SOD、CD68、TLR4、NLRP3、NF-κB、IL-1β、MPO、caspase-3水平比较
肥胖组肝组织MDA水平较正常组明显升高,SOD水平较正常组明显降低,差异均有统计学意义,其他指标与正常组的差异无统计学意义;ANP组肝组织所有指标均较正常组及肥胖组明显升高,差异均有统计学意义;肥胖ANP组肝组织所有指标较其他3组差异均有统计学意义(表2,图2、3、4)。
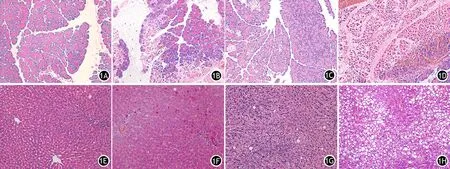
图1 正常组、肥胖组、ANP组、肥胖ANP组大鼠胰腺(1A~1D)及肝脏(1E~1H)组织病理学改变(HE染色,×200)

组别 MDA(nmol/mg)SOD(U/mg)CD68+/TLR4+CD68+/NLRP3+TLR4+/NLRP3+NF-κBIL-1βMPOcaspase-3正常组 2.01±0.3613.30±0.491.66±0.811.50±0.540.83±0.756.56±0.9613.43±2.161.83±0.7518.66±1.21ANP组 2.96±0.22a9.90±1.02a6.66±1.21a7.00±1.41a5.50±1.04a37.63±2.96a35.00±2.82a20.83±2.48a55.00±2.60a肥胖组 2.45±0.26ab11.31±1.03ab2.50±1.04b2.33±0.81b1.00±0.63b7.10±1.53b15.66±1.75b2.33±1.03b20.66±3.14b肥胖ANP组3.45±0.15abc6.71±0.70abc24.16±1.47abc25.00±2.60abc14.16±1.47abc58.80±6.75abc50.00±2.36abc35.33±6.88abc66.00±4.04abc
注:与正常组比较,aP<0.05;与ANP组比较,bP<0.05;与肥胖组比较,cP<0.05
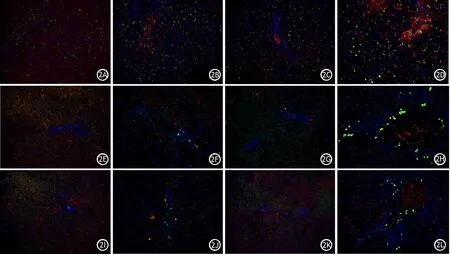
图2 正常组、肥胖组、ANP组、肥胖ANP组大鼠肝组织CD68(2A~2D)、TLR4(2E~2H)、NLRP3(2I~2L)表达(免疫荧光染色,×200)
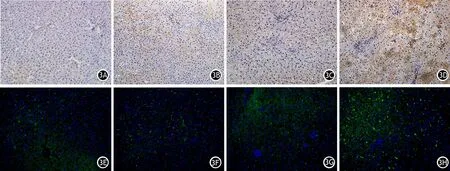
图3 正常组、肥胖组、ANP组、肥胖ANP组大鼠肝组织NF-κB(3A~3D,免疫组织化学染色)、IL-1β(3E~3H,免疫荧光染色)表达(×200)
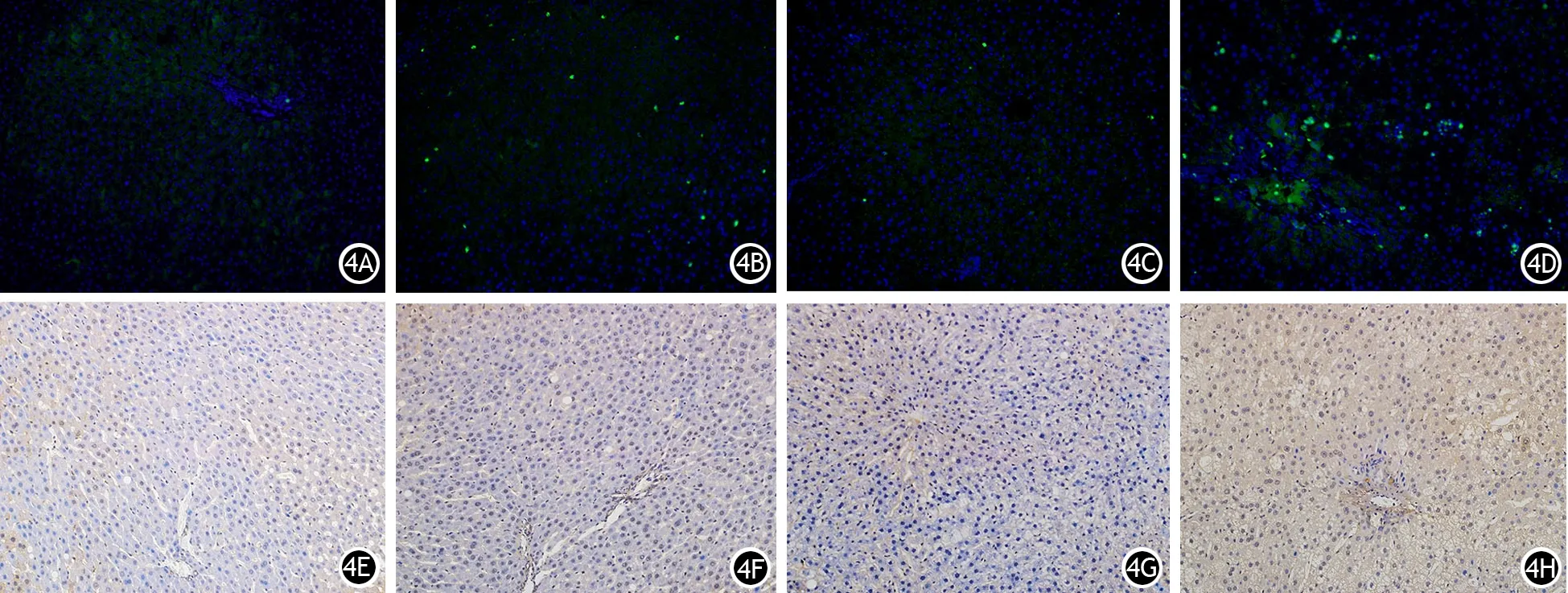
图4 正常组、肥胖组、ANP组、肥胖ANP组大鼠肝组织MPO(4A~4D,免疫荧光染色)、caspase-3(4E~4H,免疫组织化学染色)表达(×200)
讨 论
AP是临床上一种常见的消化系统急腹症,发病急、进展快,病情重者可出现全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)并伴有多器官功能障碍(multiple organ dysfunction syndrome,MODS),严重危害患者的生命健康[7]。AP的发病原因多样,主要有胆管疾病、酒精性、高脂血症、暴饮暴食、免疫性、手术、药物性等因素,少数患者病因不明[8]。近年来,有研究认为肥胖可增加AP的发病风险且可以加重AP的病情,影响患者的预后[2]。
急性肝损伤(acute hepatic injury,AHI)是AP时一种常见的并发症,约80%的AP患者可出现AHI,肝脏损伤可以加重患者病情,增加AP的病死率[1]。本研究结果显示,ANP组血ALT、AST的水平及肝脏的病理均较正常组明显升高,肥胖ANP组血ALT、AST水平及肝脏病理较ANP明显升高,提示ANP时出现了肝损伤且肥胖可以加重ANP时肝损伤。AP时肝损伤的机制复杂,有研究发现AP时受损肝组织中氧化应激及炎症级联反应加重,改善氧化应激及炎症反应后肝损伤程度相应减轻,提示氧化应激及炎症反应可能参与AP时AHI的过程[9],但有关肥胖合并ANP时肝损伤的研究较少。本研究发现肥胖ANP组肝组织MDA、NF-κB、IL-1β及MPO水平较ANP组明显增加,而SOD活性较ANP组明显降低,提示ANP时氧化应激及炎症反应参与了肝损伤,且肥胖可能加重氧化应激及炎症反应水平导致更严重的肝损伤。
氧化应激是由活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)大量生成,或机体内抗氧化保护能力的下降导致组织损伤。MDA是由机体脂质过氧化产生,SOD是一种可以清除机体代谢过程产生的氧化物质的抗氧化酶,氧化应激时组织内MDA含量增加,SOD活性降低,氧化应激得到改善后MDA含量减少,SOD活性升高[10-11]。机体氧化应激过程中产生的ROS可以通过多种途径参与组织细胞的损伤:ROS可以直接引起线粒体功能紊乱、溶酶体膜破坏;活化氧化应激敏感转录因子NF-κB介导炎症介质的释放;通过CD95受体诱导细胞凋亡[12]。有研究认为,肥胖者机体存在氧化和抗氧化失衡,呈现一种慢性炎症状态[13]。本研究发现肥胖大鼠合并ANP时肝损伤更加严重,可能与肥胖大鼠体内氧化应激更加严重,通过介导释放更多的炎症因子导致损伤相关。
巨噬细胞是一种重要的免疫细胞,在炎症反应中起到重要作用。CD68是一种常用的巨噬细胞标记[14]。TLR4是Toll样受体家族中的一种,TLR4/NF-κB信号通路的过度活化可以可产生大量的炎症因子,导致机体损伤[15]。NLRP3炎症小体在免疫系统起到重要的作用,NLRP3炎症小体调控失衡时,可导致过量的炎症因子的产生[16]。有研究发现,TLR4[17]、NLRP3炎症小体[18]与巨噬细胞的活化及其合成、分泌炎症因子相关。本研究发现,肥胖ANP组肝组织中CD68+TLR4+、CD68+NLRP3+细胞数量较ANP组明显增多,提示肥胖可能增加ANP时肝组织巨噬细胞内TLR4、NLRP3炎症小体的活化程度产生更多的炎症因子,进而导致AHI更加严重。另有研究发现,在炎症细胞内,TLR4可以调节NLRP3炎症小体活化,产生大量炎症因子,对机体产生损伤[19]。本研究也发现,肥胖ANP组TLR4+NLRP3+细胞数量较ANP组明显增多,结合文献及本结果推测肥胖可能导致ANP时肝组织巨噬细胞中TLR4活化更加明显,进一步调节NLRP3炎症小体的活化,产生大量的炎症因子,最终导致肝损伤更加严重。
利益冲突所有作者均声明不存在利益冲突

