剖腹引流术治疗重症急性胰腺炎包裹性坏死病灶的临床分析
耿诚 冉东辉 娄子彦 杜露 晏冬 王喜艳 徐新建
新疆医科大学第一附属医院胰腺外科,乌鲁木齐 830054
重症急性胰腺炎(SAP)病情进展凶险,病程中胰腺与胰周易形成包裹性坏死病灶(walled-off pancreatic necrosis,WOPN)[1-2]。目前有关WOPN的治疗方法尚无统一标准。胰腺坏死组织清除、灌洗引流治疗模式因术后并发症发生率和病死率高而逐渐被慎用;内镜微创、经皮穿刺引流和升阶梯式治疗模式等微创治疗的术后并发症有所下降,但病死率并未显著降低[3-4]。近年来笔者根据WOPN的病理解剖特点,设计了一种剖腹引流术治疗WOPN,取得了较好的效果。本研究比较剖腹引流术与传统剖腹清创灌洗手术治疗效果的异同,评估剖腹引流术的可行性和安全性。
资料与方法
一、一般资料
回顾性分析2005年1月至2016年10月新疆医科大学第一附属医院胰腺外科收治的154例SAP 并发WOPN患者的病例资料。2005年1月至2012年10月收治的83例患者采用传统剖腹清创灌洗术治疗(清创组),以清除坏死组织和置管灌洗为主;2012年11月至2016年10月收治的71例患者采用腹部小切口入路低位置管引流术(引流组),以通畅引流为主,不强求行清创。排除外伤性胰腺炎、ERCP相关性胰腺炎和胰周穿刺病例。
二、治疗方法
按照中国急性胰腺炎诊治指南[5]制定治疗方案,给予患者禁食水、胃肠减压、液体复苏、纠正电解质紊乱、抑制胰腺内外分泌、抗生素降阶梯疗法、多脏器保护支持、营养支持等综合治疗。病情危重者入院后立即进入ICU,监测呼吸、循环功能,必要时给予机械通气及连续肾替代治疗。手术指征:(1)临床治疗已渡过急性期,病情稳定后再次恶化,高热持续1周以上;(2)增强CT显示腹腔内或胰周病灶出现“气泡征”;(3)排除肺部感染、导管感染、尿路感染等非胰腺引起的发热或病情恶化。
引流组患者术前依据影像学资料(主要是增强CT)明确感染病灶位置、周围毗邻关系和病灶个数。手术取脐上正中切口,长约5.0 cm。病灶若累及横结肠脾区、降结肠、左肾区域,在横结肠系膜左侧病灶最低位置取引流口;病灶若累及升结肠、横结肠肝区、十二指肠区域,在横结肠系膜右侧病灶最低位置取引流口。引流口长度为3.0 cm。经引流口取出部分坏死组织。必要时通过术中超声引导定位,避开血管,不强求行清创。病灶内并排置入两根26号橡胶引流管以保持引流通畅。
清创组患者取上腹部正中切口或“人”字形切口,采用Beger等[6]提倡的清创和小网膜囊灌洗术,即手术清除坏死物质,留置引流,术后持续灌洗。
三、临床观察指标
记录患者的一般情况、术中情况、术后资料。一般情况包括性别、年龄、病因、各器官功能、ICU机械通气及术前感染情况等,术中情况包括引流位置、手术时间等,术后资料包括并发症和转归等。
四、统计学处理
结 果
一、一般情况
清创组和引流组患者性别、年龄、病因、器官功能不全、ICU机械通气情况等的差异均无统计学意义。术中细菌学培养证实引流组术前感染率为95.8%(68/71),清创组术前感染率为96.4%(80/83),两组间差异也无统计学意义(表1),两组患者具有可比性。

表1 两组患者术前一般情况比较
二、手术情况
清创组手术区域在胃结肠韧带,采用Beger等[6]提倡的清创和小网膜囊灌洗术,手术时间为(3.0±0.2)h。引流组的手术区域在横结肠系膜下缘,手术时间为(1.0±0.3) h。低位引流位置主要有4处:横结肠系膜左侧42例(图1),横结肠系膜右侧16例,左季肋处5例,右季肋处8例;其中12例横结肠系膜左侧和右侧均引流。术中吸尽脓液,清除块状坏死组织(图2),但不强求行全部清创。
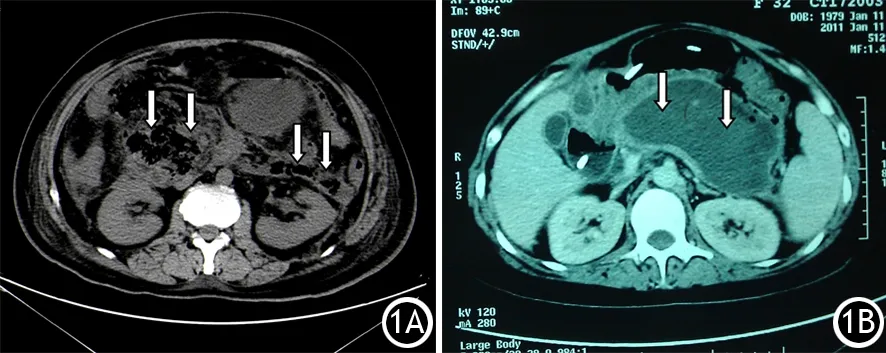
图1 CT平扫示病灶位于横结肠系膜右侧及左侧(↑),并有大量气体(1A);CT增强示病灶位于横结肠系膜左侧(↑),并有少量气体(1B)

图2 术中清除的块状坏死组织(2A、2B)
三、治疗结果
清创组术后发生腹腔出血9例、胰瘘47例、腹腔再感染43例、切口感染20例、切口疝5例;引流组术后发生腹腔出血3例、胰瘘36例、腹腔再感染13例、切口感染5例、切口疝1例。清创组发生手术相关消化道瘘18例,均采用手术治疗;引流组发生消化道瘘4例,其中2例结肠瘘经手术治愈,2例十二指肠瘘经非手术治疗治愈。两组腹腔出血、胰瘘、切口疝的发生率差异无统计学意义,但引流组腹腔再感染、切口感染、手术相关消化道瘘的发生率显著低于清创组,差异均有统计学意义(表2)。
引流组引流管拔除后病灶消失、直接治愈55例,胰瘘病例长期带管后期以小肠瘘方式愈合12例,行内引流术2例;清创组直接治愈62例,胰瘘病例后期以小肠瘘方式愈合3例,行内引流术3例。两组直接治愈率差异无统计学意义,引流组的后期小肠瘘治愈率显著高于清创组,差异有统计学意义。引流组因腹腔出血死亡1例,因严重腹腔感染放弃治疗1例,病死率为2.8%;清创组因腹腔出血死亡3例、结肠瘘死亡2例、腹腔感染死亡10例,病死率为18.1%,引流组病死率显著低于清创组,差异有统计学意义(表2)。

表2 两组患者术后并发症和转归情况比较[例(%)]
讨 论
随着诊疗技术的不断发展,近年来SAP病死率已降至10%~30%,但仍然是当前外科急腹症中尚未解决的难点之一[7]。SAP感染期的自然病程目前仍不清楚,其结局具有不确定性。胰腺和胰周出现WOPN是SAP发病4周左右形成的典型病灶,约30%的病例会继发坏死感染[8]。此类感染病灶位于后腹膜,囊腔内既有液性又有块状坏死组织,且存在胰瘘的病理基础,如何处理这些坏死感染病灶一直是外科棘手的问题[9-10]。
剖腹胰腺坏死组织清创术治疗SAP已有30多年的历史,它可一次性解决坏死组织,清创彻底,但因为创伤大、出血多、胰腺周围脏器易损伤,术后仍然存在反复发热、反复感染[11],并可出现胰瘘,后期仍需多次手术。本研究结果显示清创组83例患者中60例患者得到直接治愈,但术后腹腔出血发生率为10.8%,消化道瘘发生率为21.7%,腹腔再感染率为51.8%,切口感染率为24.1%,病死率为18.1%,说明清创手术创伤大,术后并发症率以及病死率高,应慎重选用。
近年来内镜微创、经皮穿刺引流和升阶梯式治疗模式等微创治疗在临床得到应用[12-13],但目前并没有证据显示这些方法能降低死亡率,其病死率仍为15%~20%[14]。本研究开展的剖腹引流术主要针对胰周感染的患者,以保证通畅引流为目的,对胰周坏死组织不强求清创,不破坏机体已形成的自保环境,创伤小,能够减少对机体的创伤,且胰周感染引流后肠道免疫功能及时恢复,术后严重并发症如腹腔再感染发生率、切口感染率、病死率均显著低于清创组,提示剖腹引流术更有利于病情恢复。
由于WOPN感染灶内容物既有液性(脓液)又有块状(坏死组织),经皮穿刺引流和升阶梯式治疗模式处理坏死组织病灶不彻底,块状坏死组织的引流受到局限[15];此外,WOPN感染灶术后存在胰瘘的可能,经皮穿刺引流和升阶梯式治疗模式对胰瘘的处理并没有优势。
本研究所采用的剖腹引流术治疗WOPN具有以下优点:(1)采用腹部小切口入路,术中不强求清除胰腺及其周围坏死感染组织,不破坏机体形成的保护机制,也不会损伤坏死区走行的重要血管,整体手术时间短、创伤小;(2)引流置管位置选取的横结肠系膜右侧和左侧均处于胰腺坏死病灶低位,空间大,无重要血管和脏器相邻,安全性高,易满足低位通畅引流策略;(3)病灶内并排置入两根26号引流管,不易发生引流管堵塞,块状坏死组织可从引流管或引流管之间的间隙排出;(4)引流管周围为小肠包裹,胰瘘病例长期带管可发生小肠瘘,有利于胰瘘病例的转归[16]。本组有12例胰瘘长期带管患者通过小肠瘘转化为内引流的方式治愈,有2例行再手术内引流术治愈,这可能是病死率低的主要原因之一。
综上所述,剖腹引流术治疗WOPN引流更通畅,与广泛清创引流术相比能够降低并发症发生率以及病死率,且病死率也低于升阶梯式治疗模式[14-15],提示该治疗方式对WOPN的解剖特点更具针对性,是治疗WOPN的较好方法。
利益冲突所有作者均声明不存在利益冲突

