局部进展期食管癌放射性心脏病的发病机制及其防治策略
顾艺荀,陈勇
(1扬州大学医学院临床医学院,扬州 225001;2苏北人民医院肿瘤内科,扬州 225001)
食管癌(esophagus cancer,EC)是一种高度恶性肿瘤,局部复发率和远处转移率均很高,5年生存率较低。放疗是局部晚期EC患者的主要治疗手段之一,食管癌放疗(radiotherapy for esophageal cancer,ECRT)时须尽量减轻危及器官(organ at risk,OAR)的辐射损伤。ECRT诱导的放射性心脏病(radiation-induced heart diseases,RIHD)已成为一个临床关注的问题,包括冠状动脉疾病、心脏瓣膜病、心包疾病、心力衰竭、心律失常、外周动脉疾病、高血压病、肺动脉高压和血栓栓塞疾病[1]。RIHD相关的死亡显著上升,甚至一些EC患者死于放疗毒性而非癌症复发[2]。一项对80例接受放化疗的EC患者进行了73个月随访的研究结果发现,5年总生存率与无复发生存率分别为74.6%和62.4%,死亡人数中34.6%由EC引起。13例患者出现严重心脏疾病,包括7例缺血性心脏病、3例心包积液、1例心房颤动和2例猝死。放化疗后心脏疾病主要危险因素是心脏接受剂量水平[3]。采用传统方法放疗期间,多达15%的患者出现3级或3级以上毒性。但随着三维适形放疗(three-dimensional conformal radiotherapy,
3D-CRT)、调强放疗(intensity modulated radiotherapy,IMRT)、容积旋转调强(volume modulated arc therapy,VMAT)、质子束治疗(proton beam therapy,PBT)和调强质子束治疗(intensity modulated proton therapy,IMPT)技术相继应用于临床,目前在实现给予靶区足够剂量的同时能更好地保护OAR,已显示有较好的病理完全反应、较高的肿瘤控制率、较低的RIHD发生率和较高的总生存率[4]。以往EC患者生存期短,而RIHD通常在放疗后10~20年才会发生,随着近年来EC治愈率的提高,RIHD防治则受到广泛关注[5]。为此,本文对现有ECRT相关文献进行综述,理解心脏与食管解剖学关系、放疗心脏损伤的机制与表现,评估不同EC放疗技术对心脏损伤影响程度及各种防治措施的价值。
1 心脏与食管解剖学关系
食管和心房的后壁相邻,两者之间只由薄层的结缔组织相隔,这层结缔组织只有约3 mm厚度,这种解剖学上的毗邻,是ECRT引发心脏损伤的解剖学基础(图1A,B,C)。
2 RIHD的机制和表现
ECRT可影响心脏的所有结构,包括心包、冠状动脉、心房肌、心室肌、心内膜、心脏瓣膜及心脏传导系统。放疗产生破坏DNA链的活性氧物质,导致炎症级联反应。炎细胞浸润降低内皮通透性,胶原沉积和纤维化导致毛细血管壁基底膜增厚,病理表现包括心内膜、心肌、心外膜间质等弥漫性纤维化和动静脉管腔狭窄。
2.1 心包疾病
主要病理表现为心包渗出、纤维化和增厚,组织蛋白渗出和毛细血管壁通透性增加而引起心包炎、心包积液等。急性放射性心包炎可能是ECRT导致的最早也是最常见的心血管并发症,通常在治疗数周后出现。心包炎通常为自限性,但10%~20%的患者在治疗后数年至数十年出现慢性或缩窄性心包炎。渗出性缩窄性心包炎是指脏壁层心包腔内存在异常多的积液,脏壁层的纤维融合并增厚,这一疾病被大量发现于经ECRT治疗的EC患者[6]。
2.2 冠心病
血管狭窄可能是由内膜增生、内膜损伤、动脉粥样硬化和冠状动脉痉挛共同导致,包括成纤维细胞替换受损心肌细胞及血小板沉积,引发典型的动脉粥样硬化级联事件。此外,体外研究还揭示了与血管性血友病因子释放相关的放射性促血栓形成机制,这可能引起冠状动脉血栓形成,而斑块形成的机制与自发性动脉粥样硬化类似。但受辐射患者的斑块更具纤维性,脂质成分较少。总的来看,严重的左主干病变发生率较高,其次是右冠状动脉和冠状动脉左前降支病变。此外,冠状动脉各区域均可见心肌灌注缺损,提示微血管损伤[7]。该病可表现为急性冠状动脉综合征,甚至心源性猝死,通常进展缓慢,10余年后才出现典型症状[8]。
2.3 心肌损伤
心肌细胞本身不分裂的特性使其相对抗辐射。然而,即使低剂量的辐射即可能损伤毛细血管内皮细胞,导致微血管功能不全和缺血。心肌纤维化在延迟性心脏损伤中更为突出,可增加心肌硬度、降低心肌舒缩功能,导致心电生理紊乱,甚至猝死,因此心肌纤维化是RIHD的终末期表现,发生率高达20%~80%[9]。近期研究表明,Sestrin2参与心肌纤维化的调控,其过表达参与了放疗引起的心肌损伤,并阐明纤维化是急性及晚期组织辐射损伤的结果,而辐射损伤包括炎症、氧化应激和基因过表达等[10]。
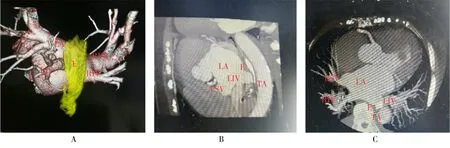
图1 心脏CTA与食管造影显示心脏与食管解剖学关系
A: frontal view based on three-dimensional reconstruction; B: sagittal plane; C: transection plane. LA: left atrium; LSV: left superior pulmonary vein;LIV: left inferior pulmonary vein; RSV: right superior pulmonary vein; RIV: right inferior pulmonary vein; E: esophagus; TA: thoracic aorta.
2.4 瓣膜功能异常
包括食管在内的纵膈放疗可直接导致心脏瓣叶、瓣环、腱索及乳头肌等整个瓣膜系统的损害,引起不同程度瓣膜增厚、回缩和钙化。瓣膜的增厚和钙化位于基底部和内侧,而瓣叶尖部受影响小。其中二尖瓣前叶瓣与主动脉根部交界处的钙化是RIHD的特征性损伤[1]。
2.5 心脏起搏传导系统损伤
有报道高达16%~36%的RIHD患者有心脏起搏传导系统的异常,包括不同程度的窦房、房室和室内传导阻滞,各种室上性和室性心律失常。由于左心房与食管最邻近,心房颤动多见,通常涉及心房和肺静脉的纤维化。由于右束支位于心内膜下方,最易受辐射影响,所以右束支传导阻滞在ECRT中常见[11]。
2.6 外周动脉损伤
放疗除了对心脏影响外,同样损伤血管,包括血管壁的直接损伤、纤维化及加速动脉粥样硬化。动脉血管损伤的严重程度取决于放疗辐射剂量和时间。有研究表明,高血压和高胆固醇血症等冠心病危险因素对放射性动脉疾病的发生有协同作用[8]。
3 ECRT不同放疗技术对心脏的影响
3.1 传统放疗技术
传统的放疗技术因其照射视野途径上几乎无剂量梯度,心脏受照射剂量大,3级或以上严重心包积液的发生率可高达10%[12]。Morota等[13]收集了11年间采用传统方式治疗的101例胸段进展期EC患者,其3年、5年心脏毒性发生率分别为17.4%和20.8%。
3.2 三维适形放射治疗
适应肿瘤大小的3D-CRT技术一定程度上可减少心脏受照体积和剂量,但在其照射视野途径上剂量梯度较小,对心脏等OAR区域仍产生相对高的辐射剂量,对心脏毒性仍较大[14]。
3.3 调强放射治疗
一项基于2004~2013年美国国家癌症数据库的2 445例食管腺癌患者放疗结果的分析表明,IMRT较3D-CRT更能改善生存率[15]。Welsh等[16]研究表明综合增强IMRT可选择性地增加总肿瘤体积的剂量,同时减少OAR区域剂量。因此,IMRT无论是靶区剂量均匀性、适形度、还是对OAR的保护,都较3D-CRT更具优势。
3.4 容积旋转调强放射治疗
一项针对VMAT与普通IMRT治疗EC患者的对比分析显示,VMAT较IMRT有更高的靶区适形性,减少OAR区域剂量的同时显著缩短治疗时间[17]。
3.5 质子束放疗技术
与3D-CRT、IMRT和VMAT相比,PBT技术通过增加靶区剂量,更显著降低OAR区域毒性。其机制为质子具有尖锐的侧向半影、有限的穿透范围,射野途径中的辐射剂量远小于肿瘤区域,具有独特的布拉格峰(Bragg峰),从而大大减少OAR区域剂量(图2)[18]。最新开发的IMPT作为迄今为止最先进的粒子治疗方式,保证靶组织剂量的同时,较PBT进一步降低OAR区域剂量和相关毒性[19]。

图2 光子束和质子束对心脏、脊髓和食管辐射剂量比较
A: anterior posterior positions show the radiation dose curves of the proton beam and the photon beam to the heart, esophagus and spinal cord; B: posterior anterior position shows the radiation dose curves of the proton beam and the photon beam to the spinal cord, esophagus and heart. The green line represents the photon beam; the black line represents the Bragg peak; the pink region is a single proton peak. H: heart; E: esophagus; S: spinal cord.
4 RIHD的防治
4.1 RIHD的预防
放疗前应对患者行全面评估,包括详细的病史,尤其是心血管病危险因素与体格检查、实验室及影像检查等。同时,应用放疗新技术可能会降低RIHD概率及程度[7]。监测与早期诊断对降低RIHD的风险尤为重要。RIHD筛查应在放疗后5年启动,且每年行心电图、动态心电图了解心电传导功能,心脏彩超观察心脏结构和功能,B型脑钠肽、心肌损伤标记物监测心肌损伤程度等[20]。另外,从发育和病理生理学角度看,microRNAs可调节各种心脏组织的再生与修复,有望成为RIHD预防的潜在靶点[21]。
4.2 RIHD治疗策略
阿司匹林、硝酸酯类及他汀类等药物治疗冠状动脉疾病。激素、心包穿刺引流甚至手术治疗心包炎。血管紧张素转化酶抑制剂或血管紧张素受体拮抗剂、利尿剂及β受体阻滞剂等治疗心肌病和心力衰竭。对心脏瓣膜病患者,初期密切随诊,后期症状严重者须手术治疗[22]。心律失常及传导异常需胺碘酮或β受体阻滞剂等药物及植入心脏起搏器或除颤器治疗。另外,需重视各种心血管因素及健康教育[23]。近期研究显示血管紧张素转化酶抑制剂或血管紧张素受体拮抗剂具有抗炎及抗氧化等作用,从而减轻辐射毒性,缓解心脏损伤[9]。氨磷汀可预防血管损伤和血管炎的发生,因此,该两大类药物为RIHD的防治提供了新路径[24]。
5 小结
随着ECRT技术的不断进步,EC患者生存率不断提高,但局部进展期ECRT不可避免地引起心脏损伤,其主要机制为早期中小血管急性炎症、微血管损伤和间质纤维化导致心肌细胞缺氧坏死。RIHD产生及预后主要取决于总辐射剂量、每天接受的剂量、辐射的部位、放疗方式、心脏与EC空间关系以及合用的心脏毒性药物等因素。对ECRT幸存者,心血管病专家、肿瘤学家等组成的多学科团队有必要就心脏筛查的计划和范围提出准确的建议,以便早期诊断和有效治疗RIHD。心血管预防指南,包括健康饮食、戒烟酒、减轻体质量和有氧运动,这些对防治心脏毒性同样有帮助。

