保温发酵鱼露中细菌群落的16S rDNA分子生态分析
王香君,段 杉
(1.四川省农业科学院蚕业研究所,四川南充 637000; 2.华南农业大学食品学院,广东广州 510642)
鱼露,又名鱼酱油,是一种在高盐条件下利用鱼体自身酶系和多种微生物的协同作用,将海产低值鱼等原料中蛋白质、脂肪等成分进行数年发酵分解而成的营养丰富、风味独特的液体调味品[1]。
目前,关于鱼露中微生物的研究多采用平板计数、分离等传统的纯培养法,基于此方法在鱼露微生物的研究中取得了一定的成果[2-3]。Kilinc等[4]和Harikedua等[5]利用平板计数法研究鱼露发酵过程中细菌、真菌的数量变化情况,而一些文献报道从发酵鱼产品中筛选出一些耐盐或嗜盐的乳酸菌[3-4]。但由于自然环境样品中仅有不到1%的微生物可培养,因此用纯培养法不能很好反映微生物群落存在的真实状态。而基于高通量测序的16S rDNA分子生态分析技术,通过对细菌16S rDNA序列进行扩增、分析,可以准确分析样品中细菌群落的组成,利于鉴定低丰度物种,现已成为研究细菌群落结构及多样性的重要手段[6]。胡小喜等[7]利用此技术研究了不同发酵条件的虾油细菌群落结构的组成情况,结果检测出虾油中细菌多达1285属,全面的揭示虾油中的细菌组成,相对于筛选和计数微生物的平板计数法具有明显优势。
传统鱼露生产常采用露天发酵方式,工艺受气候条件影响较大,工艺稳定性差,卫生条件不易控制,大量杂菌滋生,安全性低。胡小喜等[7]研究指出,35 ℃条件下,虾油中蛋白酶失活较少,且存在大量产生良好风味的细菌。张豪等[8]、黄紫燕等[9]对(30±5) ℃发酵条件下的鱼露进行研究。王香君等[10]用FQ-PCR法和平板计数法检测到发酵鱼露样品的真菌总数远低于细菌总数。Kilinc等[4]和Harikedua等[5]研究指出在鱼露发酵过程中真菌数量很少,在鱼露发酵过程中真菌作用很小。因此试验采用16S rDNA高通量测序技术研究35 ℃发酵条件下鱼露的细菌多样性及群落结构,从而揭示鱼露发酵过程中细菌群落的演替规律。
1 材料与方法
1.1 材料与仪器
鱼露原材料:5种新鲜鱼(包括头、内脏等)混合而成,质量百分比分别是双斑瓦鲽(Poecilopsettaplinthus)2.3%、短尾大眼鲷(Priacanthusmacracanthus)5.2%、翼红娘鱼(Lepidotriglaalata)5.4%、鲬(Platycephalusindicus)6.3%、眶棘双边鱼(Ambassisgymnocephalus)80.8% 阳江市海陵岛,加冰块方式及时运到实验室快速处理;D6005真菌/细菌DNA提取试剂盒 ZYMO RESEARCH生物科技公司;GeneJET胶回收试剂盒 Thermo Scientific公司;NEB Next® UltraTMDNA Library Prep Kit for Illumina建库试剂盒 New England Biolabs公司;食盐 广东省盐业集团有限公司;硝酸银、铬酸钾等均为分析纯 国药集团化学试剂有限公司。
DPX-9082B-2型电热恒温培养箱 上海福玛实验设备公司;LX-C50L立式压力蒸汽灭菌器 合肥华泰医疗设备有限公司;JA2003电子天平 上海精密科学仪器有限公司;SW-CJ-1FDA 型超净工作台 苏州安泰空气技术有限公司;5415D高速冷冻离心机 德国Eppendorf公司;TL-MM-1型微量振荡器 广州云荟贸易有限公司;DYCP-31CN水平电泳仪 北京六一仪器厂;GEL-DOL 2000电泳凝胶成像分体系统 BIO-RAD公司。
1.2 实验方法
1.2.1 鱼露样品的制备 按照工厂生产鱼露的工艺进行制备,将原料鱼与食盐按3∶1的质量比直接混匀,然后再将鱼露样品放置于35 ℃的恒温箱中恒温发酵,发酵时间12个月,发酵过程中每隔5 d取样测定含盐量后,用无菌水补加蒸发的水分以保持盐度恒定(25%,w/w)。并于发酵0、2、8、12个月时用灭菌的100 mL离心管取样(取样时,将鱼露发酵液混匀),备用。
1.2.2 鱼露样品中细菌DNA的提取 将1.2.1取得的样品在无菌条件下先用快速滤纸(灭菌处理)过滤掉粗颗粒后,用0.22 μm无菌滤膜过滤菌体,然后用无菌水将滤膜上的菌体洗下来。使用D6005真菌/细菌DNA提取试剂盒提取菌体总DNA。所有DNA样品均于-20 ℃保存备用。
1.2.3 细菌计数 根据Castillo等[11]报道,采用FQ-PCR法对鱼露中的细菌总数进行计数,并照王香君等[10]方法对样品进行菌落计数。
1.2.4 16S rDNA 分子生态分析 以稀释后的细菌总DNA为模板,用带Barcode的16S rDNA V4区特异引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rDNA 的V4区,用GeneJET 胶回收试剂盒回收纯化后的PCR产物,再使用NEB Next® UltraTMDNA Library Prep Kit for Illumina建库试剂盒进行文库构建,构建好的文库经过Qubit定量和文库检测,合格后,使用MiSeq进行上机由北京诺禾致源科技股份有限公司完成测序,测序得到原始数据(Raw Data)。
原始数据包含一定的接头污染序列、低质量数据等,会影响后续的分析,为了使信息分析的结果更加准确、可靠,需要对原始数据进行过滤。数据过滤得到clean data后,根据PE reads之间的重叠关系,将成对双端reads拼接为一条序列,再以97%序列相似性为阈值,对clean data进行OTUs(Operational Taxonomic Units)聚类和物种分类分析,并将OTUs和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。通过对OTUs进行丰度、α-多样性、β-多样性分析,同时对物种注释在各个分类水平上进行群落结构的统计分析,得到细菌群落组成及结构。
1.2.5 指标测定 含盐量(以氯化钠计):参照GB/T 5009.39-2003《酱油卫生标准的分析方法》。
1.3 数据处理
测定和分析结果采用Excel进行处理,结果采取均值±标准差形式。
2 结果与分析
2.1 OTU数目统计及物种注释分析
图1、表1显示,发酵0、2、8、12个月的鱼露中细菌分别测得78524、44031、29512、26744条序列,在科水平上,各样品的序列占比在70%以上,在属水平上,各样品的序列占比在50%以下。其中分别有69869、33520、21531、19742条注释到科,分别有34919、21182、12453、11777条注释到属。4个样品测得的序列分别聚类了1197、1385、1286、1170个OTUs,图2中有492个OTUs是所有发酵鱼露样品共同的,而8个月和12个月共同的OTU数量最多,达到818个,这说明发酵8个月和发酵12个月的鱼露中细菌群落构成差异小。

表1 各分类水平上的序列数以及各自占比Table 1 The numbers of tags and their proportions at the different levels

图1 不同样品的序列和OTUs数量统计Fig.1 Statistics of the numbers of tags and OTUs in different samples

图2 OTU交集韦恩图Fig.2 Intersected Venn diagram analysis of OTU注:图中数字代表样品的OTUs数量。
热图展示了每个样品中的物种组成及丰度信息,图3显示,不是所有的序列聚类到OTU后都能注释到种,部分OTUs只能注释到目、科、属,有的只能注释到界。结合表1可知,由于注释到种的序列较少,并且种与种之间的差异性不明显,会存在测序错误等情况,同时所有细菌OTUs中有50%左右的未能注释到属,因此本文选择对注释到目和科的物种进行研究。

图3 不同样品的OTU及分类注释结果的热图Fig.3 Heatmap analysis of OTU and species annotation from different samples注:热图中的颜色表示一个OTU或分类所包括的序列数目的高低水平(颜色越深表示越高), 数字表示某个样品中某个OTU或分类所包括的序列数;k:界,p:门,c:纲,o:目,f:科,g:属,s:种。
2.2 鱼露样品中细菌群落的α-多样性分析
多样性分析用于分析样品内的群落多样性,主要包含指标:稀释曲线、Chao1指数曲线、Shannon指数曲线,结果分别见图4、图5、图6。
由稀释曲线(见图4)可知,当随机抽取的测序条数逐渐增加时,4个样品的稀释曲线均逐渐趋于平缓,说明4个样品的测序结果基本反映了鱼露样品中的细菌群落结构。分析Chao1指数曲线(见图5)可知,当样品测序量在5000~10000条之间时,Chao1指数曲线逐渐趋于平缓,当达到10000条后,Chao1指数曲线几乎保持水平,进入一个稳定的平台期。韩亚飞等[12]指出Chao1指数值越高表明群落物种的丰富度越高,而除了发酵0个月的样品外,各发酵鱼露样品的Chao1指数值是发酵2个月>发酵8个月>发酵12个月,这说明发酵过程中鱼露中细菌群落的丰富度逐渐降低。样品的Shannon指数曲线(见图6)显示,当样品的测序条数在1000左右时,曲线逐渐趋向平坦,并进入平台期,说明测序数据量足够大,可以反映样品中绝大多数的细菌群落信息。韩亚飞等[12]指出Shannon指数值越大说明群落多样性越高,鱼露发酵0个月时Shannon指数值为4.4,鱼露发酵2个月、8个月、12个月时Shannon指数值为6.7,其中8个月时Shannon指数值最高,这说明2个月、8个月、12个月的发酵鱼露中细菌群落多样性明显比0个月的高。
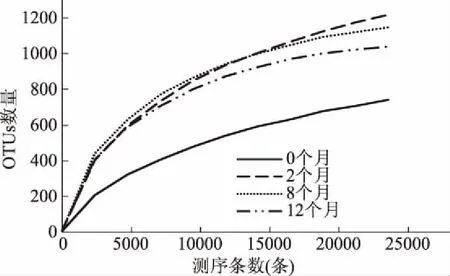
图4 稀释曲线Fig.4 Rarefaction curve

图5 Chao1指数曲线Fig.5 Chao1 index curve
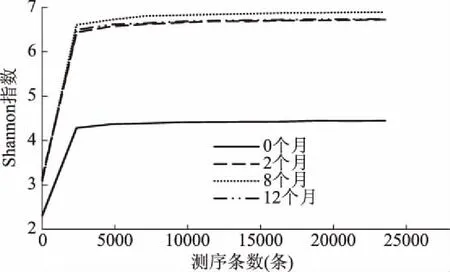
图6 Shannon指数曲线Fig.6 Shannon index curve
2.3 鱼露样品中细菌群落的β-多样性分析
β-多样性分析是对不同样品的微生物群落构成进行比较,反应不同样品的微生物群落构成的主要指标有加权Unifrac(定量)/非加权Unifrac(定性)距离、主成分/主坐标分析、样品聚类分析等,其中以(非)加权Unifrac距离绘制的β-多样性指数热图的结果见图7。

图7 β-多样性指数热图Fig.7 β-diversity heatmap analysis注:同一方格中,上下两个值分别代表加权unifrac和非加权unifrac距离。
由于两个样品间的相异系数是由加权Unifrac距离来衡量,距离越小,表示这两个样品在物种多样性方面存在的差异越小。图7显示,鱼露发酵0个月和2个月之间、0个月和8个月之间、0个月和12个月之间的加权Unifrac和非加权Unifrac距离值分别为(0.249,0.432)、(0.332,0.423)、(0.318,0.426);发酵12个月和2个月之间、12个月和8个月之间的加权Unifrac和非加权Unifrac距离值分别为(0.134,0.357)、(0.042,0.328)。可见,鱼露发酵前(0个月)的细菌群落结构与后期(8、12个月)的群落结构差异较大;而发酵后期,8个月与12个月的群落结构差异较小。这说明在鱼露发酵初期,细菌群落结构的变化较大,越到发酵后期,细菌群落结构的变化越小,群落结构趋于稳定。
2.4 鱼露中细菌群落结构分析
2.4.1 发酵鱼露中细菌群落在各分类水平上的组成 根据物种注释结果显示,发酵鱼露中细菌多达37个门、99个纲、144个目、200个科,有的序列甚至无法鉴定,细菌群落构成复杂。由于部分分类相对丰度较低,推测这些细菌属污染的细菌,因此我们只选取了相对丰度排名前10的分类进行统计,并根据FQ-PCR测得细菌总数算出它们各自的数量,结果分别见图8、图9、图10、表2、表3、表4。

表2 鱼露发酵各阶段中细菌群落在门分类水平上的各自数量(lg(个/mL))Table 2 Comparison of the number of bacteria in fish sauce at the level of phylum(lg(个/mL))
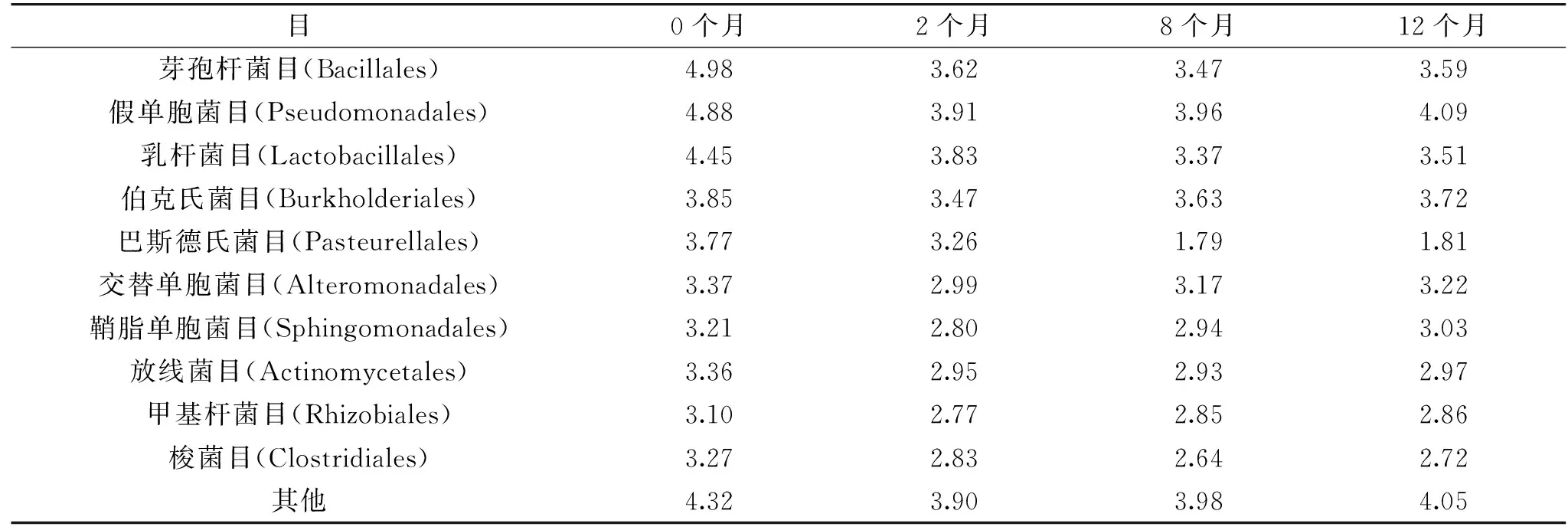
表3 鱼露发酵个阶段中细菌群落在目分类水平上的各自数量(lg(个/mL))Table 3 Comparison of the number of bacteria in fish sauce at the level of order
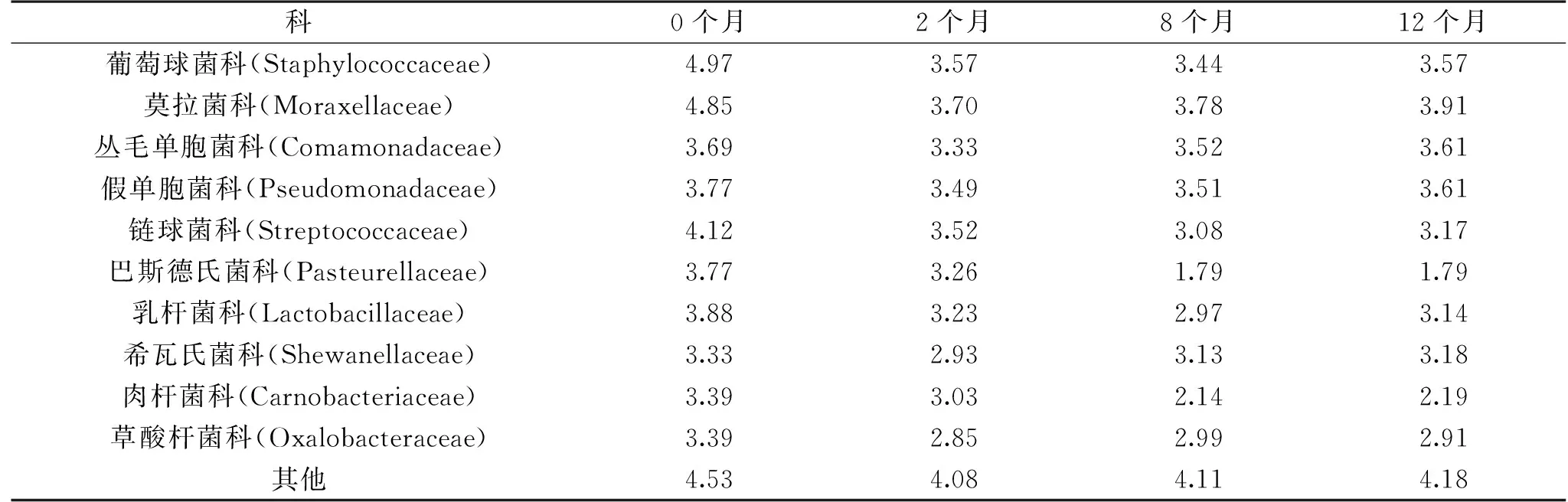
表4 鱼露发酵个阶段中细菌群落在科分类水平上的各自数量(lg(个/mL))Table 4 Comparison of the number of bacteria in fish sauce at the level of family

图8 鱼露中细菌群落在门分类水平上的组成Fig.8 Composition of bacterial community in fish sauce at the level of phylum

图9 鱼露中细菌群落在目分类水平上的组成Fig.9 Composition of bacterial community in fish sauce at the level of order
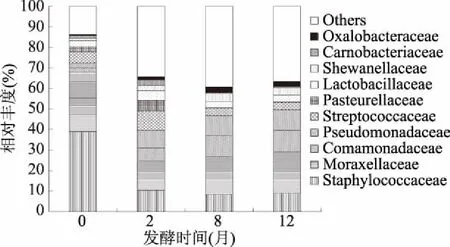
图10 鱼露中细菌群落在科分类水平上的组成Fig.10 Composition of bacterial community in fish sauce at the level of family
图8和表2显示,通过16S rDNA高通量测序分析得出发酵鱼露在各个发酵阶段中的细菌主要分布在变形菌门和厚壁菌门,其他优势菌所属的门还有酸杆菌门、放线菌门、拟杆菌门。变形菌门的相对丰度逐渐增加,由发酵0个月的43.69%逐渐增加到发酵12个月的68.79%,相对丰度波动相对较小,数量从1.07×105个/mL逐渐减少到2.82×104个/mL。而厚壁菌门的相对丰度波动相对较大,从发酵0个月的52.63%逐渐减少到发酵12个月的19.39%,数量从1.29×105个/mL逐渐减少到7.94×103个/mL,推测是由于鱼露发酵是开放式的,不断受到环境中各种微生物的污染,同时在发酵过程中要定时搅拌,促使鱼盐混匀,因此可能使得鱼露中污染的细菌数量增加、厌氧微生物和兼性厌氧微生物的生长受到抑制。在好氧微生物和厌氧微生物的分类中,变形菌门中假单胞菌目、交替单胞菌目基本都是好氧微生物,而厚壁菌门中乳杆菌目、芽孢杆菌目的大部分是厌氧或兼性厌氧微生物[13]。
在目类水平上(见图9、表3),鱼露在各个发酵阶段中的细菌主要分布在假单胞菌目、芽孢杆菌目、乳杆菌目。芽孢杆菌目的相对丰度在发酵初期降低明显,从0个月的39.42%降低到2个月的11.84%,数量从9.55×104个/mL降到4.17×103个/mL;假单胞菌目的相对丰度变化不明显,0个月和12个月相对丰度分别为31.31%和 30.12%,但数量呈降低趋势,数量分别为7.59×104个/mL和1.23×104个/mL;乳杆菌目的相对丰度呈先增加后降低、再趋于平缓的变化趋势,数量从0个月的2.82×104个/mL降低到12个月的3.24×103个/mL。
图10和表4显示,在科类水平上,主要分布在葡萄球菌科、莫拉菌科、链球菌科、乳杆菌科、假单胞菌科,其中芽孢杆菌目所包含的葡萄球菌科的相对丰度波动较大,从0个月的38.77%降低到12个月的9.12%,数量从9.33×104个/mL降到3.72×103个/mL,数量降低明显,降低了1.4个数量级,推测可能是由于发酵初期高盐抑制了大部分的葡萄球菌科细菌的生长。假单胞菌目所包含的莫拉菌科相对丰度和数量在发酵初期迅速降低,然后再缓慢增加,而假单胞菌科的相对丰度一直呈增长趋势,数量变化不明显,数量在3.0~5.9×103个/mL范围内,但这些细菌部分是食品的优势腐败菌,会产生腥臭味、硫化氢味等不良气味,影响鱼露的风味和安全性[14]。乳杆菌目所包含的链球菌科、乳杆菌科的相对丰度呈先降低、后增加、再降低、后再趋于平缓的曲线增减,而数量分别从0个月的1.32×104个/mL、7.59×103个/mL降低到12个月的1.48×103个/mL、1.38×103个/mL,数量降低了1个数量级左右,这说明链球菌科、乳杆菌科能在高盐的环境中生存,并随着发酵时间的延长逐渐成为优势菌。
2.4.2 发酵鱼露中乳酸菌类群细菌的构成分析 16S rDNA测序结果显示发酵鱼露中细菌多达238个属,同时在测序得到的所有细菌OTUs中有50%左右的未能注释到属,细菌群落结构复杂。而现有报道指出一些耐盐或嗜盐的乳酸菌是发酵鱼产品的优势菌群,产生的蛋白酶能将蛋白质分解成活性肽、游离氨基酸等风味物质,对鱼露发酵过程中风味的形成具有重要作用[2-3]。参考《乳酸菌:生物学基础及应用》[15]中Bergey氏细菌鉴定手册、《乳酸细菌分类鉴定及实验方法》[16]以及盛海圆等[17]对于乳酸菌类群细菌的分类,对鱼露发酵过程中乳酸菌的菌属构成进行分析,结果见表5。

表5 鱼露中乳酸菌类群细菌的构成分析结果Table 5 Composition of lactic acid bacteria in fish sauce at different fermentation stages
由表5可知,检测到鱼露样品中有10个为乳酸菌的属或其中部分种为乳酸菌的属,主要分布在链球菌属、乳杆菌属、葡萄球菌属,他们的相对丰度分别由发酵0个月的5.34%、3.05%、2.11%逐渐变为12个月的3.62%、3.23%、1.20%,链球菌属、乳杆菌属的相对丰度变化呈先增加、后降低、再趋于平缓的曲线增减趋势,其中链球菌属的相对丰度波动较大;葡萄球菌属呈先降低、后增加的趋势,但相对丰度波动较小。乳杆菌很少有致病菌,是食品发酵的主要功能菌,部分种能水解精氨酸产NH3;链球菌部分种能产生吡咯烷基芳酰胺酶以及水解精氨酸、马尿酸;葡萄球菌属能在高盐的环境中生存,具有较强耐盐性,部分种具有蛋白酶和脂肪酶活性,对于发酵肉制品风味成分的形成具有重要作用[18]。同时在鱼露中还检测到低丰度的芽孢杆菌属、片球菌属、气球菌属、营养缺陷菌属、魏斯氏菌属、奇异菌属、双歧杆菌属等乳酸菌。其中芽孢杆菌属中少数种属于乳酸菌,如凝结芽孢杆菌(Bacilluscoagulans)、斯密氏芽孢杆菌(Bacillussmithii)、嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)等,部分种会产吲哚;气球菌属是盐水腌肉的菌系,能耐高盐环境,部分种会产亮氨酸氨肽酶、吡咯烷基芳酰胺酶;营养缺陷菌属部分种会产亮氨酸氨肽酶;双歧杆菌属的部分种能产生丙氨酸、缬氨酸、天冬氨酸、苏氨酸等多种氨基酸;片球菌属、魏斯氏菌属、奇异菌属中部分种能水解精氨酸产NH3[16]。此外,由于50%左右的OTUs无法注释到属,在这些OTUs中是否是乳酸菌不得而知。
2.4.3 发酵12个月时鱼露中细菌群落分析 对每个样品进行物种分类,可以筛选出特别关注的物种。现有研究表明微生物对于传统发酵鱼产品风味和生物活性成分的形成具有重要作用[19]。选择对发酵12个月的鱼露中细菌进行物种分类树统计(默认在属水平上,选择样品中最大相对丰度前10的属所对应的结果进行展示),见图11。
发酵到12个月时,发酵鱼露的细菌在变形菌门(68.79%)、厚壁菌门(19.39%)、放线菌门(3.19%)、酸杆菌门(2.19%)、拟杆菌门(1.17%)等10个门类中均有分布,其中主要是变形菌门和厚壁菌门(见2.4.1)。变形菌门中以乳杆菌属、链球菌属、葡萄球菌属为主,而厚壁菌门中以不动菌属、嗜冷杆菌属、假单胞菌属为主(见图11)。多数研究报道指出乳杆菌属中部分细菌即有产蛋白酶能力又能对发酵食品风味的形成发挥重要作用,所以国内外学者都致力于从鱼露里筛选乳酸菌,并将它们应用于鱼露发酵中[20]。但在本试验中,乳酸菌目(7.93%)相对丰度和数量并不算高,推测是由于鱼露在发酵过程中要定时搅拌,促使鱼盐混匀,使得乳杆菌属中部分厌氧和兼性厌氧细菌的生长受到抑制。

图11 发酵12个月的发酵鱼露中细菌群落的特定物种分类树Fig.11 Classification tree of bacterial community in fish sauce during fermentation from 12th month注:不同颜色的圆圈表示不同的分类水平,对应左侧图例;圆圈的大小表示该分类的相对丰度大小;分类名下方的两个数字均表示相对丰度百分率,前者表示该分类占所有分类中的百分率(相对丰度前10的属占此分类的百分率);后者则表示该分类占所选取的分类中的百分率(以相对丰度前10的属为百分制计)。
现有研究在鱼露中发现的主要细菌还包括嗜盐四链球菌属、枝芽孢杆菌属、芽孢杆菌属、盐单胞菌属、片球菌属等[3,21-22]。本文也发现了高丰度的葡萄球菌属、乳杆菌属、链球菌属、嗜盐单胞菌属、片球菌属,但未发现嗜盐四链球菌、枝芽孢杆菌属等细菌,这可能是由于原料、发酵环境等不同导致细菌菌相的差异。
3 结论
研究表明,用16S rDNA技术检测出在35 ℃发酵条件下制得的鱼露中细菌多达37个门、238个属,能够比较真实地反映其细菌群落构成,较筛选和计数微生物的平板计数法具有明显优势。发酵前期菌相结构差异性较大,到发酵后期,菌相结构逐渐趋于稳定。在鱼露发酵各阶段都是优势菌的菌属有链球菌属、乳杆菌属、不动菌属、假单胞菌属、希瓦氏菌属。在发酵过程中,鱼露中假单胞菌目中嗜冷杆菌属、不动菌属、假单胞菌属的相对丰度波动较大,而耐盐和嗜盐的乳酸菌目中链球菌属、乳杆菌属的相对丰度波动较小。

