神经型一氧化氮合酶不同位点磷酸化在大鼠神经病理性疼痛中的作用机制
张博涵,董道松,郭欣欣,陶学恕,赵梦楠,王品莹,樊修元,宋涛
(1.中国医科大学附属第一医院疼痛科,沈阳 110001;2.锦州医科大学附属第三医院麻醉科,辽宁 锦州 121000)
神经病理性疼痛是一种难治性疾病,其发病机制尚不明确,目前认为在此过程中,一氧化氮(nitric oxide,NO)发挥了关键作用。实验证明,大鼠髓腔内给予NO供体(释放NO)可以直接引起神经病理性疼痛的疼痛反应,而使用NO清除剂减少NO生成可以减轻疼痛[1]。这表明NO参与了神经病理性疼痛的发生与维持。NO由一氧化氮合酶合成,一氧化氮合酶共有3种亚型,包括神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、内皮型一氧化氮合酶和诱导型一氧化氮合酶。其中nNOS被证实在神经病理性疼痛的发病机制中起重要作用[2],nNOS基因敲除可以减轻疼痛反应。
nNOS活性的调节可通过自身不同位点的磷酸化来实现。本课题组前期研究发现,nNOS Ser847位点的磷酸化可以使nNOS活性降低[3],而Ser1417位点的磷酸化可以增加nNOS活性[4]。目前在大鼠脑损伤模型的海马以及大鼠脊髓损伤模型的脊髓组织中,分别检测出了nNOS Ser847的磷酸化[5]。本研究拟观察在神经病理性疼痛发生时,脊髓中的nNOS是否发生了磷酸化及其与疼痛的关系。
1 材料与方法
1.1 材料
选用180~220 g标准月龄的SD大鼠(辽宁长生生物公司提供)56只,于SPF级动物实验室内分笼饲养,自由饮食,每日更换垫料。
钙离子钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)抑 制 剂KN-93和PKB/Akt抑制剂Wortmannin购自美国Sellct公司,溶于DMSO中,浓度分别为30 nmol/μL和40 nmol/μL。nNOS NP847兔单克隆抗体、nNOS NP1417兔单克隆抗体、辣根酶标记山羊抗兔抗体购自美国Abcam公司,SDS-PAGE快速凝胶试剂盒购自江苏凯基生物技术公司,能与nNOS特异性结合的2'-5'-ADP-agarose购自美国Sigma公司,BCA蛋白浓度检测试剂盒购自弗德生物技术公司,磷酸化蛋白酶抑制剂购自美国Roche公司,RIPA裂解液购自碧云天生物技术公司。
1.2 方法
1.2.1 建立坐骨神经分支损伤(spared nerve injury,SNI)疼痛模型:参考文献[6],异氟烷充分麻醉后,在大鼠右侧后肢股骨中点下方1 cm处切口,钝性分离后,暴露坐骨神经分支,可见坐骨神经于近膝关节处分为腓总神经、胫神经以及腓肠神经,将腓总神经、胫神经结扎并离断,仅剩腓肠神经,充分止血后缝合。
1.2.2 测量大鼠疼痛缩足阈值(pain withdrawal threshold,PWT):建立模型后,每天使用纤毛测试棒测试大鼠机械痛敏。采用不同粗细磅数的von Fray纤毛测试棒刺激大鼠足底及外侧足跟部至略微弯曲并持续5 s以上,若大鼠出现缩足反应则为阳性,记录此磅数,并根据CHAPLAN等[7]的方法处理数据,得到大鼠50% PWT。计算数值时,为了更加直观,采用log PWT进行分析。
1.2.3 鞘内置管:鞘内置管是将塑料毛细管置于大鼠椎管内,并将其固定于体外,以便于长期给药的一种给药方式。与传统的鞘内注射相比,鞘内置管具有效果更明确、大鼠术后生存率更高、给药时间更长等优点。大鼠麻醉后,于背部切开一纵行切口,钝性分离肌肉与皮肤,选用PE10导管在使用前进行消毒,并用生理盐水预充,置入穿刺针中,标记好长度。在穿刺针外预留1.5~2.5 cm。于L5~6或L6~S1节段进行穿刺,穿刺成功时,大鼠会有甩尾动作,此时将PE导管置入椎管内1~1.5 cm。将导管置入后拔出穿刺针,将导管分别固定于椎间及椎旁韧带上。利用硬膜外穿刺针行皮下隧道,将PE管从穿刺点引出至枕骨大孔处,皮肤外留置1.5~2.0 cm。可在导管中鞘内注射10 μL的1%利多卡因,并在末端套上塑料帽,将导管和塑料帽固定至皮肤,可将药物自体外导管口输入至椎管内。在大鼠苏醒后,测试大鼠麻醉平面和节段。正常状态下平面应在L3~6,鞘内置管后,在实验组中鞘内注射30 nmol/μL的KN-93 10 μL,对照组中注射DMSO 10 μL,每日连续给药[8]。
1.2.4 采用Western blotting测定样品中蛋白表达情况:将大鼠按实验预计天数处死后,取腰段脊髓并称重,在RIPA裂解液中加入磷酸化酶抑制剂。在每个样品中加入400 μL裂解液,超声裂解后4 ℃、15 000 r/min离心15 min取上清。采用BCA法定量蛋白浓度,取相同量蛋白配至300 μL,加入20 μL 2'-5'-ADP-agarose混合2 h,离心弃上清。清洗3次后,加入25 μL蛋白上样缓冲液煮沸3~5 min,离心取上清,放置至室温后于-20 ℃冰箱保存,用于Western blotting[9]。
1.2.5 检测nNOS Ser847及Ser1417磷酸化:按照随机分组的原则,将32只大鼠随机分为对照组、假手术组以及SNI 模型组,其中SNI模型组在大鼠的右侧后肢建立SNI模型,根据术后天数的不同分为SNI模型1、3、7、10、14、21 d组,每组4只。假手术组只暴露神经,不结扎直接缝合。对照组不做任何处理。
1.2.6 检测CaMKⅡ及PKB/Akt阻断剂的作用:取24只SD大鼠再分组,随机分为6组,每组4只。假手术组:大鼠暴露神经后不结扎神经直接缝合;SNI模型组:建立SNI模型后不进行鞘内注射,并根据术后天数不同分为SNI模型7、10 d组;DMSO组:建立SNI模型后鞘内注射DMSO;KN-93组:建立SNI模型后鞘内注射KN-93;Wortmannin组:建立SNI模型后鞘内注射Wortmannin。
1.3 统计学分析
Western blotting法显色后的条带导出后,采用ImageJ 图像分析软件分析各条带灰度值,得到的数据采用SPSS 20.0软件进行分析。数据用x-±s表示,2组比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 PWT检测结果
各组大鼠PWT的基线值无统计学差异(P>0.05)。SNI模型建立后,SNI模型组与对照组、假手术组相比PWT显著降低(P< 0.001),SNI模型1 d组与假手术组相比有统计学差异(P< 0.001),SNI模型10 d组与假手术组相比仍有统计学差异(P< 0.001)且PWT值相对最低,然而从14 d开始PWT呈逐渐增加的趋势。SNI模型组术后各时间点间比较,PWT无统计学差异(P> 0.05)。见图1。
2.2 神经病理性疼痛大鼠脊髓nNOS磷酸化表达情况
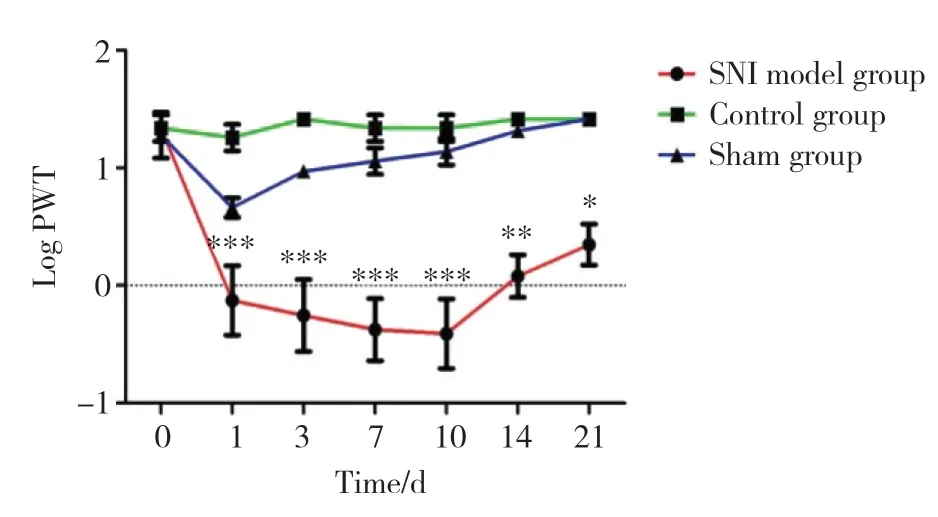
图1 SNI模型建立后大鼠后足PWT明显降低Fig.1 The pain withdrawal threshold of the hind paw was significantly reduced after the establishment of the SNI model in rats
2.2.1 nNOS Ser847的磷酸化表达情况:对各个样本中nNOS Ser847磷酸化进行检测,结果发现,SNI模型10 d组的磷酸化程度最高,与术前相比有统计学差异(P< 0.001),10 d后Ser847的磷酸化水平呈逐渐减少趋势。见图2A。
2.2.2 nNOS Ser1417的磷酸化表达情况:对各个样本中nNOS Ser1417磷酸化进行检测,结果发现,疼痛发生后磷酸化量迅速上升。SNI模型1 d组磷酸化表达量最多,与术前相比差异有统计学意义(P< 0.05),术后各时间点间比较无统计学差异(P> 0.05)。见图2B。
2.3 鞘内注射实验中nNOS磷酸化的变化
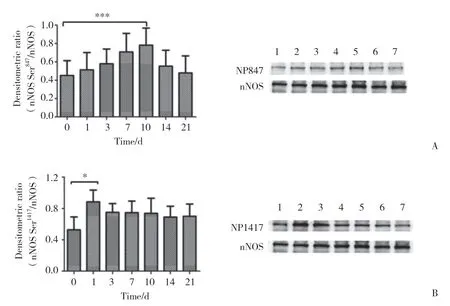
图2 神经病理性疼痛模型大鼠脊髓中nNOS在不同位点发生磷酸化Fig.2 Phosphorylation of nNOS at different sites in the spinal cords of SNI model rats
2.3.1 鞘内注射KN-93后nNOS Ser847磷酸化表达量的变化:术后第1天开始鞘内注射KN-93,取nNOS Ser847磷酸化水平最高的10 d时检测大鼠脊髓中Ser847磷酸化。SNI模型10 d组与假手术组相比磷酸化明显增加,有统计学差异(P< 0.001);DMSO组与SNI模型10 d组相比无统计学差异(P> 0.05);而KN-93组与SNI模型10 d组相比磷酸化明显减弱,有统计学差异(P< 0.05)。见图3A。
2.3.2 鞘内注射Wortmannin后 nNOS Ser1417磷酸化表达量的变化:从术后第1天开始鞘内注射Wortmannin,至术后7 d时,检测大鼠脊髓中nNOS Ser1417磷酸化。结果发现,SNI模型7 d组与假手术组相比磷酸化明显增加,有统计学差异(P< 0.05);DMSO组与SNI模型7 d组相比无统计学差异(P> 0.05);而Wortmannin组与SNI模型7d组相比磷酸化明显减弱,有统计学差异(P< 0.01)。见图3B。
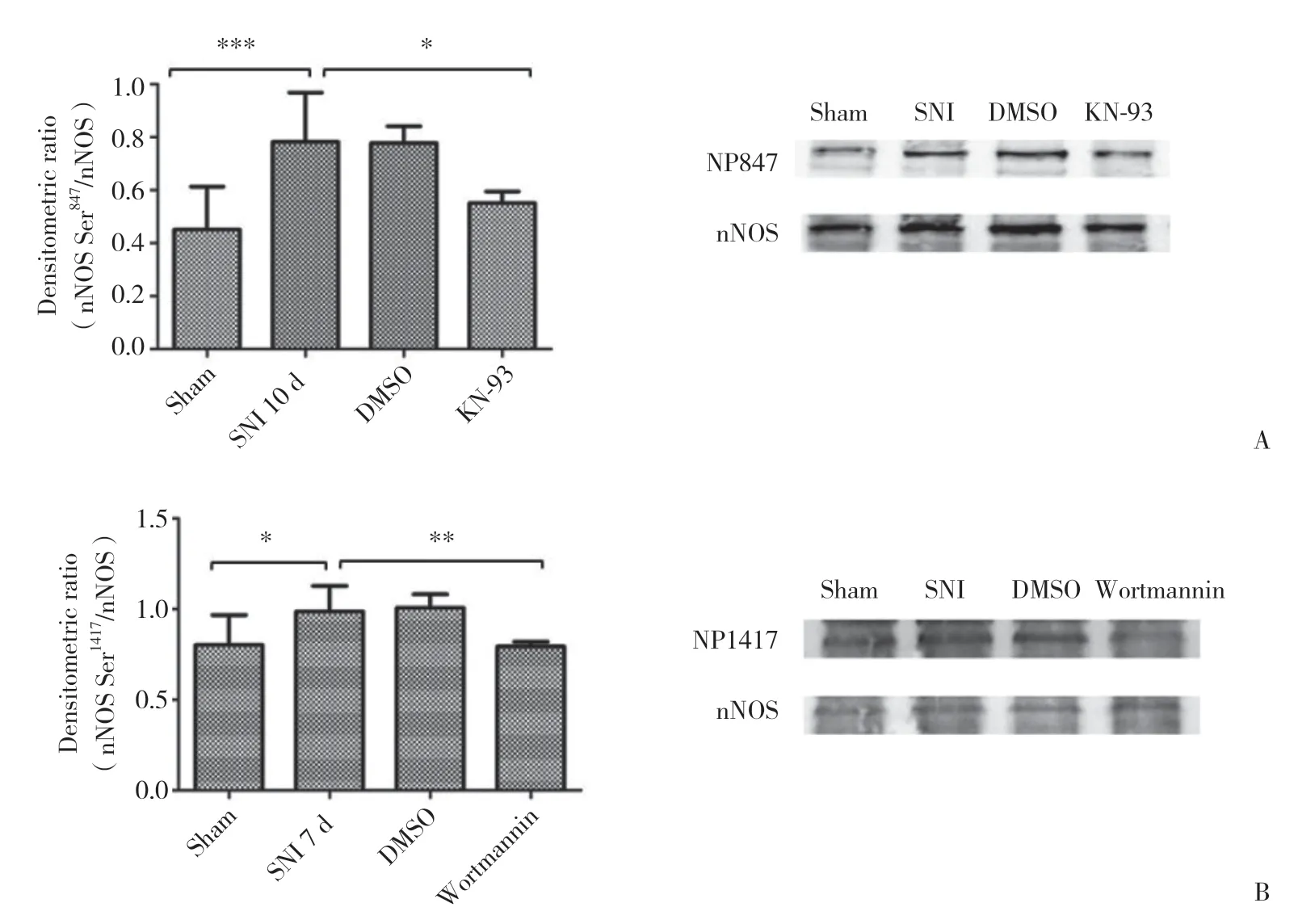
图3 鞘内给予蛋白激酶抑制剂后nNOS磷酸化的表达降低Fig.3 The phosphorylation of nNOS was decreased after intrathecal injection of protein kinase inhibitors
3 讨论
本课题组前期研究[4]发现,蛋白激酶CaMKⅡ可以使nNOS发生Ser847位置的磷酸化并使其活性下降,PKB/Akt则可以使nNOS发生Ser1417位置的磷酸化并使其活性上升。研究[10]发现,nNOS Ser847位置的磷酸化在脑缺血、脊髓损伤等动物模型中出现,并通过降低nNOS活性、减少NO合成而发挥了重要作用。而在蛛网膜下腔出血、脑缺血再灌注损伤中发现,nNOS发生了Ser1417位置的磷酸化,并导致NO合成增多[11]。CaMKⅡ、PKB/Akt、nNOS在脊髓都有表达,而发生在脊髓背角的中枢敏化是神经病理性疼痛重要的发生机制,CaMKⅡ与nNOS在此过程中均起到了关键的作用,而nNOS磷酸化的作用尚不清楚[12]。
本研究证实了在大鼠SNI模型中,脊髓的nNOS发生了Ser847和Ser1417的磷酸化。其中Ser847磷酸化在神经损伤后的第10天最多,而后逐渐减少。而Ser1417的磷酸化在神经损伤后的第1天就达到最高,而后亦维持了较高的水平。与此同时,代表机械痛阈的大鼠PWT,在神经损伤后第1天即显著下降,至第10天达到最低,疼痛最为剧烈,而后逐渐缓解。这一现象考虑为神经损伤后nNOS迅速发生的Ser1417磷酸化,导致NO大量合成,加重了神经病理性疼痛的痛觉超敏,使其PWT在Ser1417磷酸化最大化的术后第1天即显著下降。而nNOS的Ser847磷酸化可以降低nNOS活性,减少NO合成,并缓解疼痛。本研究发现,在Ser847磷酸化最大化的第10天,大鼠PWT亦达到最低,而后疼痛开始逐渐缓解。说明nNOS不同位点的磷酸化均参与了神经病理性疼痛的发生与维持,但起到了不同的作用。这种nNOS在同一疾病中,同时被不同蛋白激酶磷酸化不同位点的现象,在其他研究中也有报道,如在神经损伤导致阴茎勃起障碍的动物模型中,就同时观察到了nNOS Ser847与Ser1417的磷酸化,且起到了不同的作用[13]。
很多蛋白激酶都可以使nNOS发生磷酸化,如PKC、CaMKⅡ、RSK1可以使nNOS发生Ser847磷酸化,而Akt、PKA、PKD等可以使nNOS发生Ser1412磷酸化[14]。本研究采用鞘内置管的方法,精确给予CaMKⅡ阻断剂KN-93,可以显著逆转神经损伤导致的nNOS Ser847磷酸化,证明SNI大鼠神经损伤后CaMKⅡ被激活,并使nNOS发生Ser847磷酸化,降低了nNOS活性,在神经病理性疼痛中起到了保护作用。与此同时,本研究采用PKB/Akt阻断剂Wortmannin逆转了nNOS Ser1417的磷酸化,证实PKB/Akt使nNOS发生Ser1417的磷酸化,增强了nNOS的活性,在神经病理性疼痛中起到了致痛作用。
综上所述,本研究揭示了nNOS不同位点的磷酸化在神经病理性疼痛中发挥了不同的作用。提示将来临床上,在神经病理性疼痛的不同时间点,以不同的蛋白激酶及nNOS不同的磷酸化位点为靶点进行治疗,可能取得良好的效果。

