重型颅脑损伤患者肠内营养起始剂量的研究
王珞丁,王爱平,刘琰
(中国医科大学附属第一医院神经外科,沈阳 110001)
近年来我国颅脑损伤发病率呈逐年上升势态。目前,研究[1-2]显示我国颅脑损伤发病率约为100/10万。重型颅脑损伤伤情严重,死亡率(60%以上)高、残疾率高,在脑外伤中占13.0%~21.0%[3]。患者早期处于高应激状态,代谢率是正常人2.5倍,机体耗能增大,蛋白质大量分解,出现一系列免疫和代谢改变[4]。患者机体长期处于高代谢状态或负氮平衡状态,通常会发生免疫力下降、营养失衡、伤后愈合延迟等现象,最终影响患者预后。因此早期营养支持是治疗重型颅脑损伤患者的重要手段。有研究[4]表明,现代临床营养支持能有效预防重症患者营养不良,同时营养素能刺激免疫细胞、调整代谢、提高机体免疫能力和抗感染能力,调控细胞因子产生以及释放,改善患者结局。近年来研究[3-4]发现早期小剂量逐渐增至足量能缓解肠内营养支持时不耐受现象。本研究比较重型颅脑损伤患者肠内营养2种起始剂量的应用效果,旨在为重型颅脑损伤患者选择合适起始肠内营养剂量提供依据。
1 材料与方法
1.1 研究对象及分组
选取2017年6月至2018年6月中国医科大学附属第一医院神经外科收治的120例重型颅脑损伤患者。纳入标准:(1)伤后24 h内入院接受治疗,入院时格拉斯哥昏迷指数(Glasgow coma scale,GCS)3~8分;(2)营养风险筛查NRS2002评分[5-6]≥3分;(3)有肠内营养指征,无严重消化道病变;(4)入院无休克,48 h内无严重应激溃疡;(5)18岁≤年龄≤70岁;(6)住院时间≥1个月。排除标准[7-8]:(1)入院24 h内脑死亡;(2)合并严重上消化道出血,血压明显下降,合并其他部位严重多发伤;(3)合并严重代谢性疾病、内分泌系统紊乱以及心、肝、肾等器官疾病;(4)持续鼻饲<10 d;(5)使用免疫抑制剂等药物;(6)任何原因导致的中途退出患者。患者家属均知情同意并签署知情同意书,本研究已获得中国医科大学附属第一医院伦理委员会批准。
依据简单随机数法将入选患者均分为观察组(早期小剂量肠内营养,n=60)和对照组(早期足量肠内营养,n=60),干预实施过程中对患者采用盲法。观察组患者营养支持起始剂量为10 mL/h,之后每12 h增加10 mL/L,直到达到目标剂量;对照组患者营养支持起始剂量为25 mL/h,之后每12 h增加25 mL/L,直到达到目标剂量。营养液均选用由纽迪希亚制药(无锡)有限公司生产的能全力肠内营养混悬液(500 mL/瓶,1.5 kCal/mL),目标剂量为30~35 kCal/(kg·d)。2组患者性别、年龄、身高、体质量、入院时GCS评分、NRS2002评分以及致伤原因差异均无统计学意义(均P> 0.05),具有可比性。见表1。
1.2 观测指标
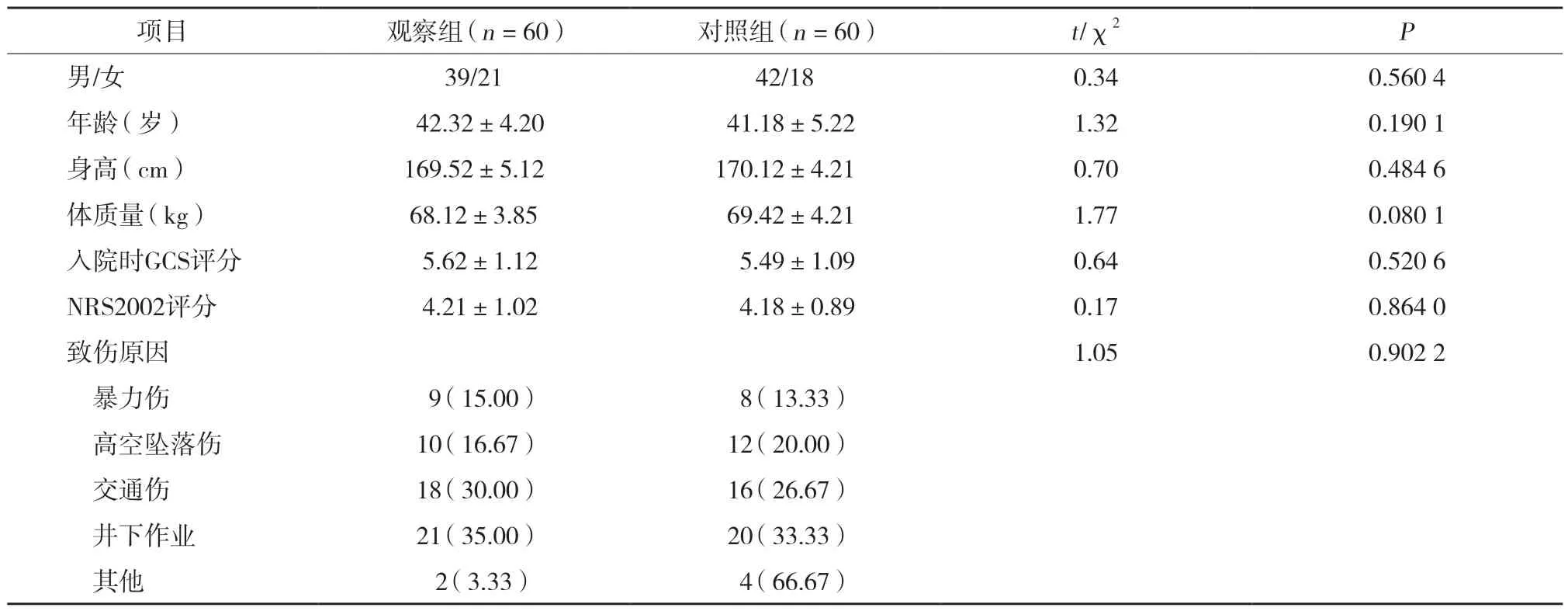
表1 2组患者临床资料比较
1.2.1 血糖:动态监测患者入院后1周内血糖水平,每4 h监测1次血糖;血糖≤7.8 mmol/L为血糖达标、血糖>7.8 mmol/L为血糖未达标,记录并计算1周内血糖达标次数、未达标次数及血糖达标、未达标率;血糖调节根据世界卫生组织相关标准用胰岛素进行控制,记录1周内患者平均胰岛素用量[9]。
1.2.2 免疫指标及T淋巴细胞亚群:记录给予肠内营养10 d时2组患者免疫指标(IgE、IgA、IgG、IgM)以及T淋巴细胞亚群(CD3和CD4)。
1.2.3 营养指标:记录给予肠内营养1个月时2组患者营养指标[三头肌皮褶厚度(triceps dermal fold thickness,TSF)、上臂肌围(arm muscle circumference,AMC)、总 蛋 白(total protein,TP)、白 蛋 白(albumin,ALB)、前白蛋白(prealbumin,PA)、转铁蛋白(transferrin,TRF)]。
1.2.4 预后评估:给予肠内营养1个月后评估2组患者不良反应发生情况,随访最后1 d利用GCS 评分[10]进行预后评估,死亡、重度残疾为预后不良;恢复良好、轻度残疾评为预后良好,计算预后不良及预后良好率。
1.3 统计学分析
采用Excel建立数据库,应用SPSS 18.0软件对数据进行统计学分析。计量资料采用x-±s表示,组间比较采用t检验;计数资料采用百分数表示;组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 2组治疗1周内血糖控制及胰岛素用量比较
结果显示,观察组、对照组血糖达标率分别为56.15%(1 415/2 520)、38.02%(958/2 520),胰岛素用量分别为(184.20±21.23)U、(234.62±32.10)U,差异均有统计学意义(χ2=6.47,P=0.011;t=10.15,P< 0.000 1)。
2.2 2组治疗10 d时免疫指标、T淋巴细胞亚群比较
结果显示,观察组IgA、IgG、IgM水平高于对照组(均P< 0.000 1);IgE、CD3+、CD4+水平2组比较差异无统计学意义(均P> 0.05),见表2。
2.3 2组患者治疗1个月时营养指标比较
结果显示,2组营养指标TSF、AMC、TP、ALB、PA、TRF比较均无统计学差异(均P> 0.05)。见表3。
2.4 2组患者治疗1个月后不良反应及预后比较
结果显示,腹泻、胃潴留发生率2组比较均有统计学差异(均P< 0.001),观察组、对照组GCS评分分别为10.21±1.23、9.80±0.95,差异有统计学意义(t=2.04;P=0.043 2),预后不良率2组比较差异无统计学意义(P> 0.05)。见表4。
3 讨论
本研究比较起始小剂量与足量肠内营养在重型颅脑损伤患者的治疗效果,结果发现,早期小剂量起始肠内营养能达到与足量营养相当的治疗效果,且起始小剂量肠内营养在血糖控制、免疫指标、不良反应以及预后方面都优于起始足量肠内营养。
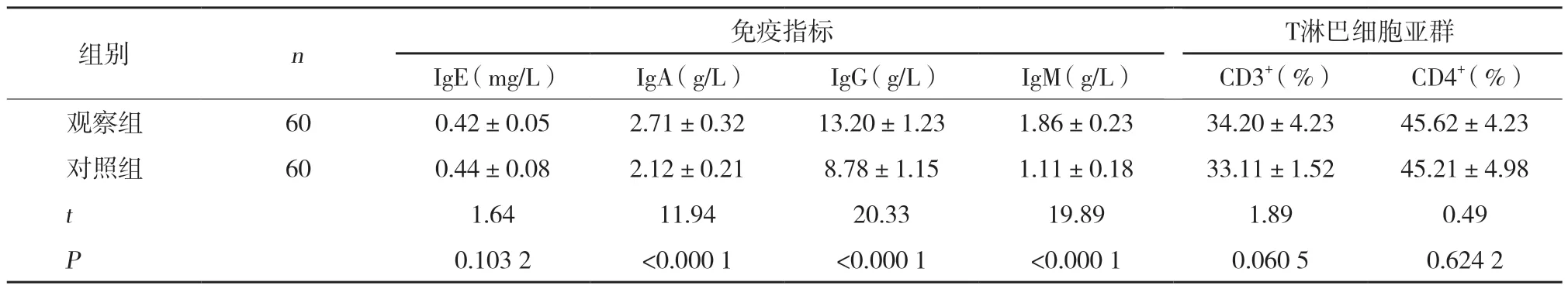
表2 2组治疗10 d时免疫指标、T淋巴细胞亚群比较

表3 2组患者治疗1个月时营养指标
重型颅脑损伤患者普遍存在高血糖明显升高状态,血糖上升而机体糖耐力降低,对糖负荷反应性下降;肾上腺皮质激素、儿茶酚胺等分泌增加,血糖含量快速上升[11-12]。重型颅脑损伤患者在创伤性应激状态下及下丘脑-垂体-肾上腺轴调节功能障碍下,容易出现血糖过高情况[13-14]。研究[15]表明早期足量肠内营养起始剂量较大,虽然能给予更充足的营养,但容易导致血糖波动,血糖控制更加困难,与本研究结果一致。因此早期小剂量起始肠内营养对于严格控制血糖,预防重型脑损伤加重有重要作用。
重症颅脑损伤患者是营养问题高危人群和创伤高应激人群,患者胃肠黏膜上皮细胞缺血损伤,肠黏膜通透性变大,菌群容易移位,患者胃肠道功能减弱。如果肠内营养初始剂量较大会加大胃肠道刺激,容易出现不耐受现象,出现腹泻、胃潴留等不良反应,而这些不良反应不但会影响营养支持效果,对患者免疫恢复也有影响[16]。本研究结果显示观察组不良反应发生率较对照组低,部分免疫指标较对照组优;营养支持效果相当。因此认为初始小剂量肠内营养更适合重型颅脑损伤患者。
综上所述,重型颅脑损伤患者早期肠内营养采用小剂量能达到与足量营养相当的治疗效果,且更利于血糖控制和免疫修复,减少不良反应,使患者获益。因此小剂量起始肠内营养可以作为重型颅脑损伤患者的首要营养方式。

