磷脂酰肌醇3-激酶/丝氨酸苏氨酸蛋白激酶信号传导通路在慢性阻塞性肺疾病发展“快”“慢”表型中的作用差异研究
马红霞,王兵
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是一种可防可治的疾病,主要临床特征为持续气流受限,与肺部、气道对气体或有害微粒的慢性异常反应有关[1]。COPD患者肺功能呈进行性下降,且其下降速度表现出两种极端表型,一种是发展“快”,即发病短时间内病情迅速进展,全身状况和肺功能迅速恶化;另外一种是发展“慢”,即发病很长时间内病情、全身状况及肺功能相对稳定[2]。既往研究表明,磷脂酰肌醇3-激酶(phosphatidylinosito1-3-kinase,PI3K)/丝氨酸苏氨酸蛋白激酶(Akt)信号传导通路通过调控炎性递质释放、炎性细胞活化及气道重构等在慢性气道炎性疾病中发挥重要作用[3]。本研究旨在探讨PI3K/Akt信号传导通路在COPD发展“快”“慢”表型中的作用差异,以期对COPD防治工作提供一定参考价值。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 (1)年龄30~80岁;(2)未伴有严重α1-抗胰蛋白酶缺乏者;(3)近1个月内未服用激素及其他免疫抑制剂、未接受过脱敏治疗者。
1.1.2 排除标准 (1)行人工机械通气治疗者;(2)伴有重度呼吸衰竭者〔动脉血氧分压(PaO2)<40 mm Hg(1 mm Hg=0.133 kPa),伴或不伴有动脉血二氧化碳分压(PaCO2)>90 mm Hg〕;(3)合并活动性结核、肺癌、肺纤维化等其他类型严重慢性呼吸系统疾病者;(4)合并心力衰竭、糖尿病、高血压等可能影响试验结果的慢性疾病者;(5)合并肺性脑病、自身免疫性疾病、恶性肿瘤、任何部位迁延不愈或急慢性感染性疾病者;(6)无法准确提供病史及有精神疾病者。
1.2 一般资料 选取2017—2018年新疆医科大学附属中医医院呼吸科门诊或住院的COPD患者116例,均符合2015年修订版慢性阻塞性肺疾病全球防治创议(GOLD)中COPD的诊断标准[4],其中发展“快”表型者26例(A组)、发展“慢”表型者90例(B组)。A组患者中男14例,女12例;年龄38~68岁,平均年龄(52.1±9.3)岁。B组患者中男46例,女44例;年龄37~69岁,平均年龄(52.8±9.4)岁。另选取同期新疆医科大学附属中医医院体检中心体检健康者90例作为对照组,其中男47例,女43例;年龄39~68岁,平均年龄(53.0±9.1)岁。三组患者性别(χ2=0.07)、年龄(F=0.10)比较,差异无统计学意义(P>0.05),具有可比性。本研究经新疆医科大学附属中医医院医学伦理委员会审核批准,所有受试者对本研究知情并签署知情同意书。
1.3 诊断标准 (1)COPD发展“快”表型诊断标准:①体质指数<21 kg/m2,②慢性阻塞性肺疾病评估测试(CAT)评分>20分,③改良英国医学研究学会呼吸困难指数(mMRC)≥3级,④年住院次数≥2次,⑤年急性加重次数≥3次,⑥病程≤5年但肺功能分级≥Ⅲ级;满足⑥及①~⑤中任意两个条件者为发展“快”表型。(2)COPD发展“慢”表型诊断标准:①体质指数≥21 kg/m2,②CAT评分≤20分,③mMRC≤2级,④年住院次数≤1次,⑤年急性加重次数≤2次,⑥病程≥15年但肺功能分级≤Ⅱ级;满足⑥及①~⑤中任意两个条件者为发展“慢”表型[5]。
1.4 观察指标
1.4.1 PI3K、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、Akt及磷酸化丝氨酸苏氨酸蛋白激酶(p-Akt) mRNA相对表达量 自NCBI中GEO数据库中获取PI3K和Akt基因信息,设计实时荧光定量聚合酶链反应(qRTPCR)引物,以cDNA为模板,采用qRT-PCR分析三组受试者PI3K、p-PI3K、Akt及p-Akt mRNA相对表达量。
1.4.2 PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量采用Western blot法检测PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量[6],具体方法如下:采集三组受试者外周静脉血2 ml,与15 μl PMSF和200 μl细胞裂解液进行匀浆,之后于冰上裂解30 min,4 ℃环境下12 000 r/min离心5 min(离心半径60 cm),去上清液;将1/4倍量5×SDS上样缓冲液与蛋白质样品混合均匀,热水煮沸7 min,用10%SDS-PAGE 115 V电泳,200 mA恒流2 h,湿转至硝酸纤维膜上,再以5%脱脂奶粉TBST缓冲液室温封闭3 h,加一抗(即鼠抗人PI3K、p-PI3K、Akt及p-Akt,以1:500稀释)。TBST洗膜3次,10 min/次,然后与结合有辣根过氧化物酶标记的山羊抗小鼠免疫球蛋白G(IgG)(1:4 000稀释)室温孵育1 h,TBST洗膜3次,10 min/次,与化学发光试剂(ECL)反应,X线胶片曝光显影。PI3K、p-PI3K、Akt、p-Akt蛋白含量测定采用灰度值扫描,并将β-actin作为内参,灰度值之比为蛋白相对表达量。
1.4.3 炎性细胞因子 抽取三组受试者外周静脉血3 ml,离心,分离血浆并置于-80 ℃环境下保存备用。采用CBA流式液相多重蛋白定量技术检测血浆白介素4(IL-4)、白介素6(IL-6)、白介素10(IL-10)、肿瘤坏死因子α(TNF-α)水平。
1.4.4 肺功能指标 采用德国耶格MasterScreen PFT System肺功能仪检测三组受试者第1秒用力呼气容积占预计值百分比(FEV1%pred)、用力肺活量占预计值百分比(FVC%pred)及第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)。记录三组受试者mMRC评分、CAT评分,mMRC评分越高提示患者呼吸困难越严重,CAT评分越高提示患者肺功能越差[7]。
1.5 统计学方法 采用SPSS 17.0统计学软件进行数据处理,符合正态分布的计量资料以(x± s)表示,多组间比较采用单因素方差分析,两两比较采用q检验;计数资料分析采用χ2检验。以(双侧)P<0.05为差异有统计学意义。
2 结果
2.1 PI3K、p-PI3K、Akt及p-Akt mRNA相对表达量三组患者PI3K、p-PI3K、Akt及p-Akt mRNA相对表达量比较,差异有统计学意义(P<0.05);A组和B组患者PI3K、p-PI3K、Akt及p-Akt mRNA相对表达量高于对照组,B组患者PI3K、p-PI3K、Akt及p-Akt mRNA相对表达量低于A组,差异有统计学意义(P<0.05,见表1)。
2.2 PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量 三组患者PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量比较,差异有统计学意义(P<0.05);A组和B组患者PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量高于对照组,B组患者PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量低于A组,差异有统计学意义(P<0.05,见表2)。
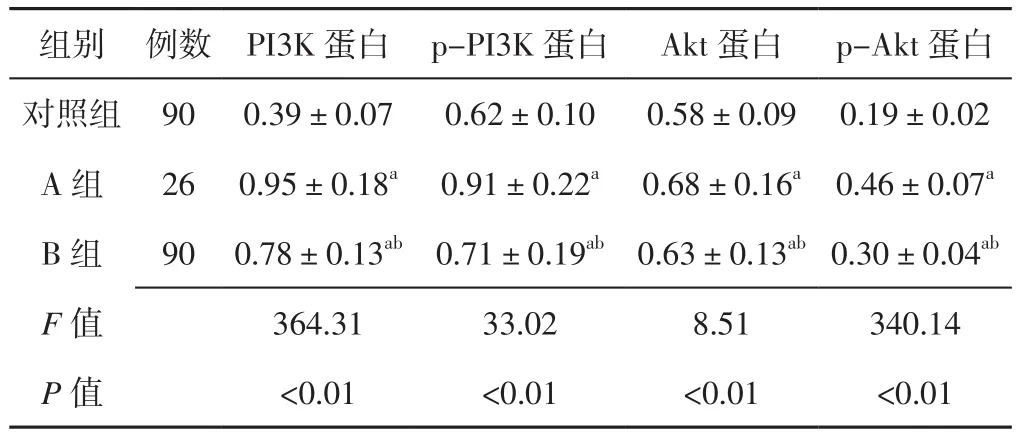
表2 三组患者PI3K、p-PI3K、Akt及p-Akt蛋白相对表达量比较(x±s)Table 2 Comparison of relative expression quantity of PI3K,p-PI3K,Akt and p-Akt protein in the three groups
2.3 炎性细胞因子 三组患者血浆IL-4、IL-6、IL-10、TNF-α水平比较,差异有统计学意义(P<0.05);A组和B组患者血浆IL-4、IL-6、IL-10、TNF-α水平高于对照组,B组患者血浆IL-4、IL-6、IL-10、TNF-α水平低于A组,差异有统计学意义(P<0.05,见表3)。

表3 三组患者炎性细胞因子比较(x±s,ng/L)Table 3 Comparison of inflammatory cytokines in the three groups
2.4 肺功能指标 三组患者FEV1%pred、FVC%pred、FEV1/FVC、mMRC评分、CAT评分比较,差异有统计学意义(P<0.05);A组和B组患者FEV1%pred、FVC%pred、FEV1/FVC低于对照组,mMRC评分和CAT评分高于对照组,差异有统计学意义(P<0.05);B组患者FEV1%pred、FVC%pred、FEV1/FVC高于A组,mMRC评分和CAT评分低于A组,差异有统计学意义(P<0.05,见表 4)。
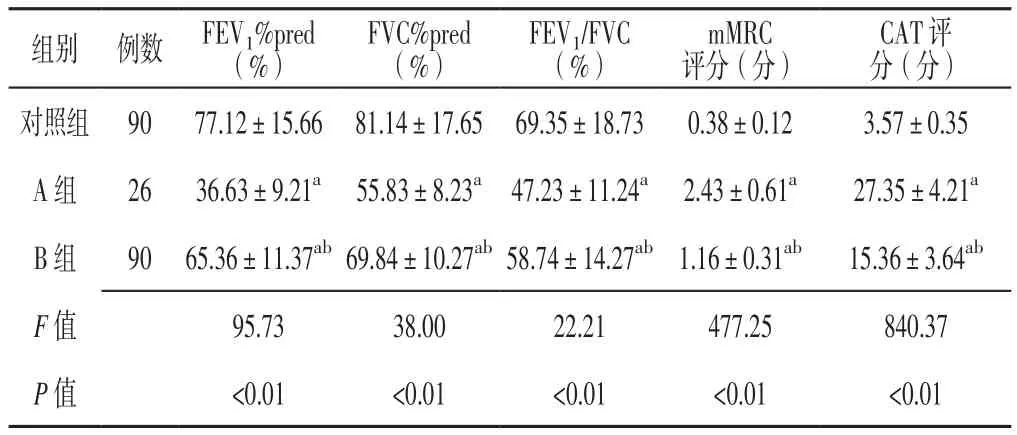
表4 三组患者肺功能指标比较(x±s)Table 4 Comparison of pulmonary function indexes in the three groups
3 讨论
COPD是一种常见的呼吸系统疾病,也是全球范围内发病率和病死率升高的重要原因之一[8]。临床实践中发现,COPD虽然呈进行性发展,但病情发展速度不同,主要表现为发展“快”“慢”两种表型,而研究COPD发展“快”“慢”表型的发生机制对COPD防治工作具有重要参考价值。
PI3K/Akt信号传导通路是细胞内的经典信号通路,其可参与细胞炎症、细胞凋亡及自噬等环节[9]。PI3K是一个异源性二聚体,作为联系细胞应答效应和外信号的中介分子,属于催化磷酸肌醇3-OH端磷酸化的一类蛋白质家族,具有重要生物学特征[10-11]。Akt被称为蛋白激酶B,是PI3K信号通路中的关键信号传导分子,对细胞凋亡、增殖等具有重要调控作用[12]。近年来,PI3K/Akt信号传导通路在COPD炎性反应机制及抗炎治疗中的作用受到临床关注[13]。本研究结果显示,A组和B组患者PI3K、p-PI3K、Akt、p-Akt mRNA及蛋白相对表达量高于对照组,B组患者PI3K、p-PI3K、Akt、p-Akt mRNA及蛋白相对表达量低于A组,提示COPD发展“快”表型与PI3K、p-PI3K、Akt、p-Akt基因及蛋白表达上调有关。
既往研究表明,COPD患者气道内存在炎性细胞活化及大量化学因子、细胞因子及炎性递质,它们参与调节气道炎性反应,其中TNF-α是COPD的主要细胞因子之一[14]。既往研究表明,TNF-α过度表达导致肺组织损伤加重及炎性反应慢性化,在COPD患者肺组织损伤过程中起重要作用[15]。近年来随着临床对炎性因子研究深入发现,IL-4、IL-6、IL-10等细胞因子与COPD发生、发展密切相关[16]。本研究结果显示,A组和B组患者血浆IL-4、IL-6、IL-10、TNF-α水平高于对照组,B组患者血浆IL-4、IL-6、IL-10、TNF-α水平低于A组,提示与COPD发展“慢”表型相比,COPD发展“快”表型患者气道炎性反应更严重。本研究结果还显示,A组和B组患者FEV1%pred、FVC%pred、FEV1/FVC低于对照组,mMRC评分和CAT评分高于对照组;B组患者FEV1%pred、FVC%pred、FEV1/FVC高于A组,mMRC评分和CAT评分低于A组,提示与COPD发展“慢”表型相比,COPD发展“快”表型患者肺功能更差。分析COPD发展“快”表型患者气道炎性反应更严重、肺功能更差的机制可能与PI3K/Akt信号传导通路有关:PI3K/Akt信号传导通路能调控炎性递质释放、炎性细胞活化,其磷酸化使炎性递质过度释放,进而导致气道重塑及气管收缩,同时其产生的基质金属蛋白酶(MMPs)、弹性蛋白酶等可破坏肺实质,导致肺功能迅速降低[17-21]。
综上所述,COPD发展“快”表型与PI3K、p-PI3K、Akt、p-Akt基因及蛋白表达上调有关;与COPD发展“慢”表型相比,COPD发展“快”表型患者肺功能更差,可能与PI3K/Akt信号传导通路调控炎性细胞因子有关,但具体作用机制仍有待进一步研究。此外,COPD和哮喘均是气流受限疾病且存在明显易感交互作用,故本研究未排除哮喘患者,可能在一定程度上影响研究结果。
作者贡献:马红霞进行文章的构思与设计,研究的实施与可行性分析,进行结果分析与解释,负责撰写论文,负责文章的质量控制及审校;马红霞、王兵进行数据收集、整理、分析,对文章整体负责,监督管理。
本文无利益冲突。

