64层螺旋CT灌注成像在原发性肝癌中的诊断价值
荣霞,刘肖,牛淑君,徐淋立
肝癌属临床常见消化道恶性肿瘤之一,据相关统计,肝癌发病率在我国恶性肿瘤中位居第3位,并呈逐步上升趋势,我国肝癌病死率约占全球肝癌病死率1/2[1]。肝癌可分为原发性肝癌(primary liver cancer, PLC)与继发性肝癌(secondary liver cancer, SLC)两大类,而临床主要以原发性肝癌多见[2]。由于原发性肝癌发病早期对肝功能影响较小,症状不显,多数肝癌确诊时已发展至中晚期,错过了最佳手术时间。因此采取有效手段及早诊断尤为必要[3]。相关研究发现,肝癌极易引起患者门脉血供增加,影响血流血供变化,而CT灌注成像可有效检测其血流变化,为肝癌患者的临床诊断和治疗提供重要依据[4-5]。同时随着CT灌注成像技术的不断发展,临床诊断准确率也进一步提升。故本研究回顾性分析2012年7月至2016年12月在我院行64层螺旋CT灌注成像检查的原发性肝癌、肝硬化、健康者的临床资料,旨在探讨64层螺旋CT灌注成像在原发性肝癌中的诊断价值,现将结果报道如下。
1 材料与方法
1.1 一般资料
本研究回顾性分析2012年7月至2016年12月我院行64层螺旋CT灌注成像检查者的临床资料,根据诊断标准确诊结果分为原发性肝癌组(60例)、肝硬化组(30例)、健康组(60例)。原发性肝癌组中,男31例,女29例,年龄30~78岁,平均(58.6±7.8)岁,体重45~79 kg,平均(61.8±6.5)kg。肝硬化组中,男18例,女12例,年龄32~80岁,平均(59.2±8.1)岁;体重43~81 kg,平均(62.2±7.1)kg。健康组中,男33例,女27例,年龄34~80岁,平均(58.9±8.8)岁;体重45~80 kg,平均(62.5±7.4)kg。三组性别、年龄、体重等一般资料比较,无显著性差异(P>0.05),三组基础资料具有可比性。
1.2 入选标准
1.2.1 诊断标准 PLC患者符合《原发性肝癌诊断标准》[6]中相关诊断标准:①不明原因出现肝区疼痛、消瘦、乏力等表现;②经血清生化检查肿瘤标记物,如甲胎蛋白升高;③经CT增强扫描初步判定为肝癌门静脉内无栓子存在;④肿瘤层面无瘤肝实质、门静脉主干或肠系膜上静脉;⑤手术前穿刺取活体组织病理检查确诊为原发生肝癌。肝硬化患者符合《肝硬化的诊断标准和治疗方案》[7]中相关诊断标准:①腹部超声检查显示肝实质回声增强,肝脏表面不光滑,粗糙不匀称,肝被膜增厚;②肝脏CT检查显示门歌曲却脉直径增宛,腹腔积液;③有脾大、侧支循环的建立和开放、腹水;④肝功能检查血清球蛋白水平升高,白蛋白降低,A/G倒置;⑤临床出现腹胀、乏力、黄疸、蜘蛛痣、肝掌、双下肢水肿等表现。
1.2.2 纳入条件 ①在我院行64层螺旋CT灌注成像检查的原发性肝癌、肝硬化和健康者,并符合上述诊断标准;②受检者年龄30~80岁;③本研究经我院医院伦理委员会审批通过后执行。
1.2.3 排除标准 ①合并严重心、肺、肾等器官功能障碍;②合并其它心血管疾病;③感染性疾病、凝血功能异常、肿瘤转移、其它系统肿瘤疾病;④精神病史与肝脏手术史。
1.3 方法
所有患者均行CT灌注成像扫描。常规禁食8 h后,协助患者取仰卧位,指导患者进行正确扫描呼吸训练,叮嘱其扫描时屏住呼吸,无法屏气时行浅慢呼吸。采用西门子Sensation 64层螺旋CT机行动态灌注扫描,先平描其上腹部,以肿瘤面积较大位置为扫描中心,选取靠近病灶中心层面的相似层作为灌注层面后,行全肝脏灌注扫描[8]。采用高压注射器注射非离子对比剂优维显(碘300 mgL/mL),注射速率5 mL/s,注射剂量0.5 mL/kg,延迟8 s后每间隔5 s扫描一次,连续扫描50 s。将灌注扫描所得数据传送至Sun Ultra AW 4.1工作站,使用Perfusion3软件对肝脏肿瘤灌注模式进行处理,自动生成时间-密度曲线、四维灌注彩图[9]。扫描期间,灌注患者生命体征变化,并在发现异常后及时停止灌注。四维灌注彩图均有资深影像学医师负责审阅,出具诊断报告,并存在工作站中,以便术后对比。
1.4 观察指标
①观察原发性肝癌患者的CT灌注图像表现,包括在肝动脉灌流量(HAP)彩图、门静脉灌流量(PVP)的彩图表现;②观察患者病灶大小;③利用Perfusion3软件测量并观察受检者肝血流量(BF)、肝血容积(BV)、毛细血管表面通透性(PS)、HAP及平均通过时间(MTT)灌注参数值。其中, BF正常范围764~1713 mL/min;BV正常范围<30 mL/100 g;PS正常范围<25 mL/(min·100 g);HAP正常范围<0.25 mL/(min·mL);MTT诊断临界值2.175 s。
1.5 统计学方法
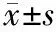
2 结果
2.1 CT灌注图像表现
以DSA结果为表现,CT灌注成像对肝内病灶诊断的准确率为100%,而在HAP彩图中,肝癌病灶具有不同程度的高血流灌注表现,其中均匀高灌注27例,不均匀高灌注33例,且高血流灌注明显高于周围正常肝组织;其中有3例肿瘤中心坏死区呈明显低灌注,且低于边缘部灌注程度,周围液化坏死区则无血流灌注情况;在PVP彩图中,肝癌病灶具有不同程度低血流灌注表现,且明显低于周围正常肝组织;多数肿瘤边界与周围肝组织无明确界限,仅少数较为清晰,边缘部分灌注程度明显高于中心灌注程度。CT均匀灌注的HAP、PVP灌注图,见图1,CT不均匀灌注的HAP、PVP灌注图,见图2。显示肿瘤呈低门静脉和高动静脉灌注,坏死区域则无血流灌注。
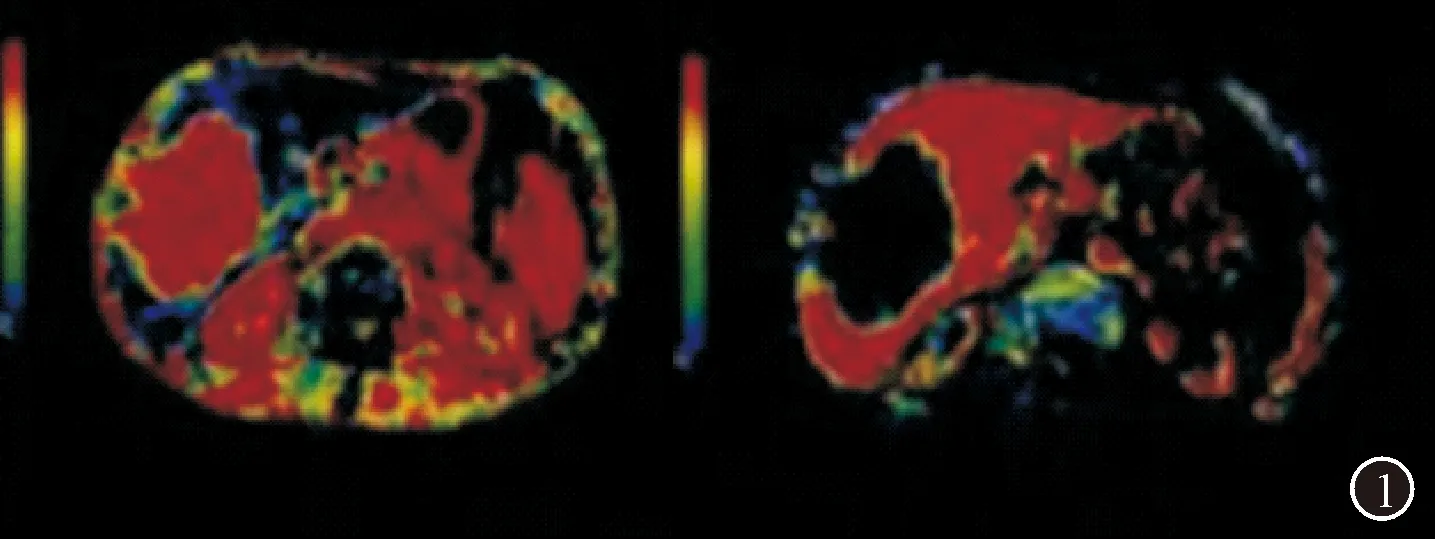
图1 CT均匀灌注的HAP、PVP灌注图
图2 CT不均匀灌注的HAP、PVP灌注图
2.2 不同类型肝癌病灶的CT灌注参数比较
60例肝癌患者中,病灶横轴直径为2.5~15 cm,平均(6.15±1.71)cm。将病灶按肿瘤大小划分:病灶>10 cm为巨块型,4例;5 cm<病灶≤10 cm为肿块型,30例;3 cm<病灶≤5 cm为结节型,17例;病灶<3 cm为小病灶,9例。由此可见,肿块型病灶最为多见。不同病灶大小CT灌注参数值比较差异无统计学意义(P>0.05),见表1。
2.3 三组CT灌注参数值差异比较
原发性肝癌组BF、BV、PS、HAP值明显高于肝硬化组与健康组(P<0.05);原发性肝癌组与肝硬化组的MTT值比较无显著差异(P>0.05),但两组MTT值均显著低于健康组(P>0.05),见表2。

表1 不同类型肝癌病灶的CT灌注参数比较

表2 三组CT灌注参数值差异比较
注:与肝硬化组比较,①P<0.05;与健康组比较,②P<0.05
3 讨论
肝癌即肝内胆管细胞或肝细胞发生的癌变,临床症状表现为肝区疼痛、肝脏肿大、腹水、腹泻等,具有发病率、病死率高等特点,是临床常见的恶性肿瘤疾病之一[10-11]。多数认为肝癌发病原因多与病毒感染、环境等因素密切相关,而由于原发性肝癌发病早期症状不显,极易给临床诊疗带来极大困难,而有效诊断是制定治疗措施和评估效果的重要前提和基础,因此及时进行准确有效检查,对患者疾病相关指标进行研究尤为必要[12-14]。据相关研究报道,肝癌中CT检查的准确率极高,且对微小病灶诊断价值也较高,因此临床采用CT检查的认可程度较高,CT检查也成为目前原发性肝癌诊断最为常见方式[15]。同时由于恶性肿瘤患者的病灶部位血流多处于明显异常状态,而CT灌注成像对患者病灶血流参数具有明显直观反应价值,因此对于肝癌患者血流相关参数变化研究成为我国医务工作者关注重点。
据相关调查显示,正常情况下,腹主动脉承担正常肝脏组织20%~25%的血供,门静脉承担75%~80%的血供[16]。陈亚娟等[17]研究发现,肝结节随恶性程度提高,肝动脉供血增加而门静脉供血减少。CT灌注成像根据扫描层面内不同区域参数值的不同,赋予彩阶及颜色差异形成伪彩灌注图像,从而直观、全面反映脏器、病灶的血流灌注特点,以判断病变程度[18]。本研究经回顾性分析研究,结果显示,60例PLC患者在肝动脉灌流量(HAP)彩图中肝癌病灶较周围正常肝组织具有明显高灌注血流表现,其中呈均匀高灌注血流27例,不均匀高灌注血流33例,其中有3例肿瘤中心坏死区呈明显低灌注,且低于边缘部灌注程度,周围液化坏死区则无血流灌注情况;在门静脉灌流量(PVP)彩图中肝癌病灶较周围正常肝组织具有明显低灌注表现,且多数肿瘤边界与周围肝组织无明确界限,仅少数较为清晰,边缘部分灌注程度明显高于中心灌注程度。结果表明肝癌主要通过肝动脉供血,而门静脉基本不提供血运,坏死区域则基本少或无血流灌注表现。
肝脏属于为肝动脉和门静脉双重供血脏器,肿瘤血管生成极易导致肝动脉血容量增加,而门静脉血容量缩小[19]。徐玉球[20]等研究指出,肿瘤患者肝动脉和门静脉血容量均明显高于周围肝硬化实质。楼益义[21]等研究发现,肝癌患者血容量和血流量较肝硬化实质明显升高,肝硬化极易导致肝动脉灌注总量降低。同时由于肿瘤内血管内皮生长因子促进血管生成,肿瘤无序生长,肝癌病灶血流量和血容量较正常肝组织明显增加呈显著高灌注状态[22]。本次研究结果显示,60例PLC患者中,病灶横轴直径为2.5~15(6.15±1.71)cm,将病灶按肿瘤大小划分,肿块型(5 cm<病灶≤10 cm)最为多见,共30例(50.00%),且不同病灶大小CT灌注参数值比较无显著差异;原发性肝癌组BF、BV、PS、HAP值明显高于肝硬化组与健康组;原发性肝癌组与肝硬化组的MTT值比较无显著差异,但两组MTT值均显著低于健康组。结果与相关研究基本一致,进一步证实了肝癌病灶与硬化实质之间、肝癌病灶与正常肝组织之间CT灌注参数值存在显著差异。
综上所述,64层螺旋CT灌注成像可全面、直观反映肝内血流灌注情况,而肝脏病变随灌注变化而变化,因此CT灌注成像在PLC临床诊断中具有重要的价值,为PLC临床诊断和治疗方案提供可靠的理论依据,推广应用价值较高。

