菲利普孢囊线虫侵染后小麦防卫相关UniGene表达特性
邢小萍,周荣华,张盼盼,袁虹霞,李洪连
(河南农业大学植物保护学院,河南郑州 450002)
菲利普孢囊线虫(Heteroderafilipjevi)系危害小麦的重要孢囊线虫种类,目前在全世界10多个国家发生危害[1-4],在我国,该线虫在黄淮麦区发生危害严重[5-6]。
病原物与寄主植物互作的过程中,植物体内的水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ETH)介导的抗病基础传导通路(basal signaling pathways,BSPs)产生的信号分子可激活一些防御基因的表达,可能会启动SA、JA和ET信号通路,植物出现对生物胁迫的广谱抗性[7-9]。前人报道,烟草[10]、马铃薯[11]、拟南芥[12-13]等受到病原物侵染后,SA、JA和ETH作为内源信号分子能够激活植物体内的系统抗性或抗病相关蛋白的表达[14]。在植物受病原物侵染后,已克隆的参与防御系统激活的基因主要有钝化病原物致病因子的酶类、参与细胞壁修饰功能的一些蛋白、抗菌活性物质、病程相关蛋白(pathogenesis-related protein,PRP)等[15]。植物病原物侵染寄主后诱导表达产物往往通过改变细胞代谢激发和调控防卫反应基因,或激活信号传导通路的基因[16]。Tak和Mhatre[17]从受到外界因素刺激后抗性增强的葡萄体内克隆得到bZIP转录因子基因VvbZIP23。在小麦体内也克隆得到与应激和防御有关的TabZIP基因[18-19]。研究证实,WRKY转录因子在植物受到外界刺激后被诱导表达,主要参与植物的抗逆反应[20-21]和防御反应[22-24]。MYB转录因子在植物受到外界生物或非生物刺激后被诱导表达,调控植物防卫反应[25-26]。小麦受病原菌侵染后诱导表达的与信号传导有关的TaPIM1基因参与植物的防御反应,该基因的表达可使植物抗性明显增加[27]。
综上所述,病原物诱导条件下,对植物防卫相关基因的表达及功能研究是植物抗病分子生物学的重要研究方向之一。鉴于此,本研究利用real time-PCR技术,对前期研究中筛选的与细胞结构、防卫反应、转录因子及信号传导有关的10个基因在抗、感小麦品种的幼苗接种菲利普孢囊线虫(H.filipjevi)后不同时段的相对表达量进行分析,旨在揭示该类基因在小麦受到H.filipjevi侵染后的合胞体建立阶段的可能作用机制。
1 材料与方法
1.1 供试材料
供试小麦品种:感病品种温麦19,由河南省农科院秋乐种业有限公司提供;抗病种质资源抗线2号,由中国科学院成都生物所提供。
供试线虫群体:H.filipjevi许昌群体[5],采自河南省许昌县河街乡半坡铺村小麦病田。
1.2 试验方法
1.2.1 小麦根组织的准备
供试小麦材料的种子经表面消毒后,在20±2 ℃的培养箱内催芽后播至装满灭菌沙土的营养钵(直径10 cm×高10 cm)中,在光/暗比14/10 h、昼/夜温度23±2 ℃/15±2 ℃的人工气候箱内培养1周,小心拔出幼苗,将根系的沙土轻缓地冲洗干净后放置在铺有灭菌湿滤纸的浅塑料盘(长40 cm,宽20 cm,深5 cm)中,每株小麦幼苗的根系均匀滴加0.5 mL从病田采集的孢囊孵出的二龄幼虫(J2s)配成2 000条·mL-1的悬浮液,对照组根系滴加0.5 mL的无菌水。之后在小麦根系上覆盖两层浸湿的无菌滤纸,浅塑料盘放置于育苗条件下的人工气候箱中培养。分别在接种后1、2、3、5、7和9 d采集幼苗根系组织,每个材料各时间点处理组和对照组分别采集4株,经液氮快速冷冻后置于-80 ℃保存备用。
1.2.2 总RNA提取、检测、纯化及反转录
小麦根系总RNA 参照Trizol (invitrogen)提取液操作手册提取。用1.5%的琼脂糖凝胶电泳分析所提取RNA 样品的28S和18S条带,检测其完整性。参照RQ1RNase-FreeDnase (Promega,USA)试剂盒说明书去DNA。随后,按照cDNA 合成试剂盒操作说明书以随机引物Oligo dT进行反转录成合cDNA,-80 ℃保存。
1.2.3 Real time PCR 分析
引物信息:利用Primer Premier 6.0设计各基因的引物 (表 1),小麦的肌动蛋白基因(actin) 做为内参基因,引物由生工生物工程 (上海) 股份有限公司合成。
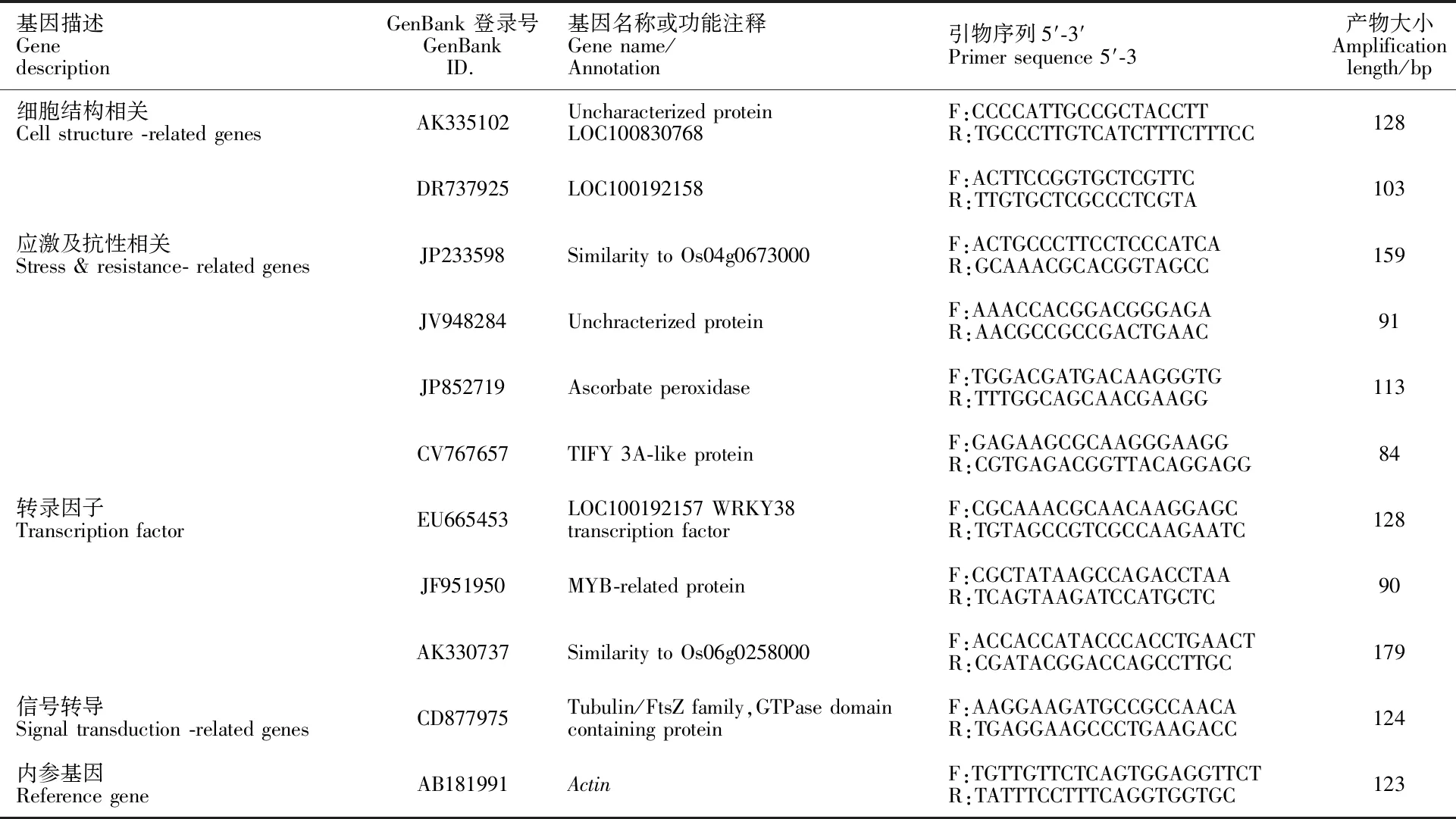
表1 基因的Real time PCR引物信息Table 1 Primer of genes for real time PCR
Real time PCR定量检测体系及结果分析:使用SYBR Premix (SYBR Green) 试剂盒进行real time PCR检测。反应体系为12 μL,包含SYBR Premix 6 μL,正反向引物 (10 μmol·L-1) 各0.48 μL,cDNA 模板1.2 μL, 50×ROX Reference Dye 0.26 μL,RNase-Free ddH2O 3.6 μL。反应程序为95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸20 s,40个循环。每个样品3个重复。根据扩增曲线得到每个基因的Ct值,采用2-△△Ct法分析检测基因的相对表达量[28]。采用 SPSS 20.0 统计软件对数据进行平均数及标准误分析。
2 结果与分析
2.1 RNA质量及PCR体系检测
提取的总RNA经紫外分光光度计检测,OD260/280均在1.8~2.1之间,随机挑取6个样本用1.5%琼脂糖凝胶电泳检测后,28 S和 18 S条带清晰,表明所提RNA无明显降解(图1)。采用常规PCR对所设计的引物进行扩增,1%琼脂糖凝胶电泳结果显示,扩增获得与目的条带大小相符的特异性基因片段,表明引物的特异性较好(图2)。real time PCR分析结果显示,各检测基因扩增后融解曲线均为单峰。
图1 所提取总RNA 的质量检测Fig.1 Quality detection of total RNA

1:DNA marker; 2:UniGene JV948284; 3:UniGeneAK335102; 4:UniGene AK330737; 5:UniGene CV767657; 6:UniGene JP233598; 7:UniGene JP852719; 8:UniGene JF951950; 9:UniGene CD877975; 10:UniGene DR737925; 11:UniGene EU665453; 12:Actin
图2 常规PCR 的扩增产物
Fig.2 Products amplified by conventional PCR
2.2 细胞结构相关基因的表达
接种菲利普孢囊线虫后,与细胞结构相关的UniGene AK335102和UniGene DR737925在抗病材料抗线2号和感病品种温麦19中不同时段的表达如图3。UniGene AK335102在温麦19中随时间延续其表达量增加;而在抗线2号中,在接种后1 d时,其表达量为1.079,在接种后的2、3和9 d,其表达量低于接种后1 d,而在5 和7 d其表达量远高于其他时段,以7 d 时表达量最高,接种后1、3、5和7 d,其表达量是温麦19中的 2.997、1.041、3.175和5.668倍,说明UniGene AK335102在抗线2号中表达量高于温麦19。UniGene DR737925在接种后的1和3 d时,在温麦19中的表达量低于其在2、5、7和9 d的表达量;在抗线2号中,接种后该基因的表达量均较低,只在9 d后,其表达量较高;UniGene DR737925在温麦19中各时间点的表达量均比抗线2号中高,尤其是在接种后的2、5和7 d,表达量是抗线2号中的15.353、12.442和 20.079倍。
2.3 应激与抗性相关基因的表达
在接种菲利普孢囊线虫2 d时,UniGene JV948284在温麦19中的表达量明显高于其他时段;而在抗线2号中的表达量在接种后5和7 d时明显高于其他时段。UniGene JV948284在温麦19中相对表达量较高,在接种菲利普孢囊线虫的1、2、3、5、7、9 d,在温麦19中的相对表达量分别是抗线2号中的7.553、44.071、17.655、 5.291、7.552和1.887倍 (图3)。
UniGene JP233598在接种后 2 d时,在温麦19中的表达量较高,随接种时间的延续,表达量逐渐减少;在抗线2号中,接种后5和7 d时表达量明显高于其他各时段,在接种的后期,表达量高于接种初始阶段。在接种后1~3 d,该基因在两种材料中的表达量差异相对较小,接种后的3、5、7和9 d,在抗线2号中的表达量分别是温麦19中的1.128、6.451、12.952和6.878倍。
在温麦19中,UniGene JP852719在接种后1和5 d时的表达量较低,其他各时段的相对表达量居于0.108~0.160之间;在接种后7 d时,在抗线2号中的表达量高于其他各时段;在接种5和9 d时的表达量高于接种后的1、2和3 d。在接种后2、3 d时,UniGene JP852719在温麦19中的表达量高于抗线2号,但在接种5和7 d时,在抗线2号中的表达量明显高于温麦19;在接种后9 d时,在两种材料中的表达量基本持平。
UniGene CV767657在温麦19中的表达量在接种后期低于早期;抗线2号中该基因在接种后的3和9 d时表达量明显高于其他各时段。接种线虫后的1、2和5 d,UniGene CV767657在温麦19中的表达量明显高于抗线2号,分别为 67.143、29.530和9.337倍,而接种后3和9 d时,在抗线2号中的表达量明显高于温麦19,分别为 3.969和51.762倍。
2.4 转录因子和信号转导基因的表达
UniGene EU665453属于WRKY转录因子,在接种菲利普孢囊线虫后的前3 d,该基因在温麦19中的表达量变化不明显,在接种后3 d,其表达量略有降低,在接种后5 d时,其表达量增加近1倍,在7 d和9 d时,该基因的表达量相较于接种早期明显增加。在抗线2号中,UniGene EU665453在接种后3 d时表达量较高,为接种后1 d时的15.962倍,在接种后5 d时,其表达量比3 d时低2.733倍,之后其表达量呈增加趋势(图3)。
UniGene JF951950和UniGene AK330737属于MYB族转录因子。在温麦19中,接种后 2 d时,UniGene JF951950表达量比其他各时间点略高;在抗线2号中,该基因仅在接种后5和 7 d表达量较高,在接种后1 d,该基因在温麦19和抗线2号中的表达量差异不大,在接种后2、3和9 d时,温麦19中的表达量是抗线2号中的 2.870、3.096和1.686倍。在接种后5和9 d时,UniGene AK330737在温麦19中的表达量比其他各时间点高;在接种3、5、7和9 d时,其在抗线2号中的表达量明显高于接种后的1和2 d;接种后3、5和7 d时,其在抗线2号中的表达量明显高于温麦19,分别为11.614、1.799和 10.498倍。
与信号转导相关的UniGene CD877975在接种菲利普孢囊线虫后,在温麦19中的表达量随接种时间的延续逐渐增加,在9 d时,其表达量为26.183;而在抗线2号中,该基因的表达量随接种时间的延续逐渐降低,在1 d时,抗线2号中的表达量为48.924,为温麦19中表达量的 55.532倍,而其表达量为1.645在接种后9 d 时,在温麦19中的表达量比抗线2号中的高15.917倍 (图3)。
3 讨 论
3.1 与细胞结构相关基因
果胶裂解酶和富含羟脯胺酸糖蛋白影响高等植物的细胞结构,果胶裂解酶,能降解植物细胞壁,软化植物组织,现已在番木瓜等多种植物中分离得到[29],富含羟脯氨酸糖蛋白广泛存在于高等植物细胞壁中,当植物受到病原物侵染等外界刺激时,细胞壁中该类蛋白含量增加,可能与细胞壁强固和植物受到外界刺激后早期的防御、抗性密切相关[30]。本课题组运用基因芯片技术分析了对菲利普孢囊线虫感病的小麦品种根系受到线虫侵染后早期的基因表达特征,发现与果胶裂解酶相关的UniGene AK335102表达受到抑制。本研究发现,在抗性材料抗线2号接种菲利普孢囊线虫后的1、5和7 d,该基因的相对表达量明显比感病品种温麦19高,推测该基因可能在线虫侵染后取食位点建立和合胞体发育过程中发挥作用。UniGene DR737925影响细胞壁中富含羟脯氨酸糖蛋白的含量,本研究中,接种菲利普孢囊线虫后的各时段,UniGene DR737925在感病品种温麦19中的表达量远高于抗性材料抗线2号,该基因可能在线虫侵染的过程中,发挥固化细胞壁的 作用。
3.2 应激与抗性相关基因
富脯氨酸蛋白是植物的一个细胞壁蛋白,在植物受到生物或非生物刺激后诱导表达[31],该基因可能在植物细胞发育及抗逆过程中发挥作用。Gothandam等[32]研究发现,水稻中新发现的一个在花中特异表达的富脯氨酸蛋白OsPRP3 在过表达时,植株的耐冷性显著增强,从而提高耐寒性。另外,当植物受伤后,伤口所在组织内富含脯氨酸蛋白[33-34]。本研究中,与线虫侵染应激反应相关的UniGene JV948284在接种菲利普孢囊线虫的不同时段,温麦19 中的表达量明显高于抗线2号,这可能与易感材料对线虫侵染的积极响应有关。外界因素诱导后,植物体内一些与抗性相关的基因被诱导表达。Yu等[35]研究发现,抗性小麦品种在接种条锈病菌后,过敏性诱导基因Ta-hir1表达量明显增高。转录因子往往在植物受到外界刺激后诱导表达,该类基因中有些基因已被证实与植物的各类抗性密切相关,如葡萄在受到逆境胁迫后,bZIP转录家族的基因VvbZIP23强烈表达,抗逆性明显增强[17];Zhang等[18]和张 毅等[19]研究发现,小麦在受到条锈病菌侵染后诱导表达的TabZIP基因与抗病和抗逆(低温、高盐)有关;小麦中存在多个WRKY转录因子与小麦抗逆反应[20-21]和防卫反应[22-24,36]有关。本研究中,UniGene EU665453在接种菲利普孢囊线虫后的早期,在温麦19 中的表达量变化不明显,而在抗线 2 号中,在接种后 3 d时相对表达量较高。在接种菲利普孢囊线虫的后期,在抗、感小麦中的表达量均逐渐增加,但在温麦19中变化更剧烈,推断该基因可能与合胞体维持有关。孢囊线虫侵染后8 d左右时合胞体形成,之后抗病小麦根系的合胞体逐渐衰亡,导致侵入的线虫不能继续发育[37]。在植物受到外界生物或非生物刺激后,植物体内诱导表达的MYB转录因子调控植物防卫反应[25],从拟南芥体内克隆的AtMYB44基因与植物对蚜虫的抗性有关[26]。本研究中,UniGene JF951950在温麦19和抗线2号中的表达量变化趋势基本相当,推测该基因可能在线虫侵染后植物早期的防卫反应和合胞体的建立阶段发挥作用较小;而UniGene AK330737在抗线2号和温麦19 中的表达差异较大,在温麦19中,该基因在接种5 d 时相对表达量比接种 1 d时增加6倍左右,在接种后7 d 时,其表达量急剧下降,而在9 d时强烈增加;在抗线2号中,该基因在接种后3 d时,其表达量比接种后1 d时增加近12倍,之后各时段,其表达量变化不大,推测该基因可能参与线虫侵染后植物的防御反应及在合胞体建立阶段发挥作用。
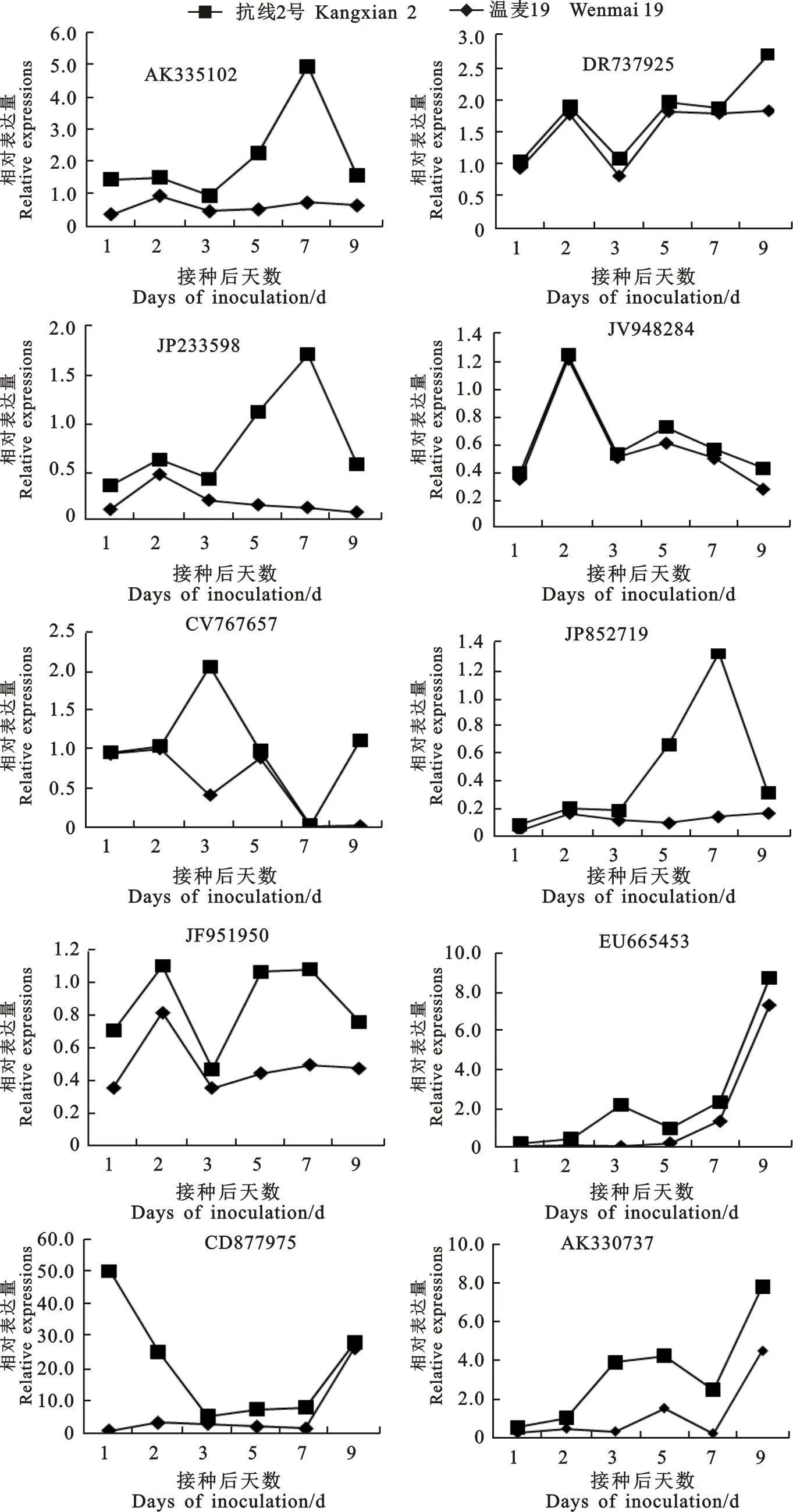
图3 菲利普孢囊线虫侵染后在不同时段的表达特性Fig.3 A time-course expression patterns of genes after H.filipjevi inoculated
3.3 转录因子和信号转导基因
信号转导相关的基因往往在植物早期的防御反应发挥信号传导作用。前人研究发现,小麦纹枯病菌、根腐病菌侵染小麦后诱导表达的TaPIM1基因在小麦中参与防御反应,转入该基因的烟草对青枯病菌的抗性明显增强[27]。本研究中的UniGene CD877975在温麦19中随接种后时间的延续其表达量呈逐渐增加趋势,而在抗线2号中,则随接种时间的延续,表达量呈逐渐降低趋势,由此推断该基因与小麦对菲利普孢囊线虫的抗性密切相关。

