转ZmPPDK基因小麦新品系的光合特性及产量分析
齐学礼,李 艳,王玉民,韩留鹏,张 磊,胡 琳,许为钢
(河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室/ 河南省小麦生物学重点实验室/河南省麦类种质资源创新与改良重点实验室,河南郑州 450002)
小麦是我国重要的粮食作物,其产量的持续提高对保障我国粮食安全具有重大战略意义。目前,小麦单产水平的提高主要是由于品种产量潜力遗传改良和生产条件改善的结果,而产量潜力的遗传改良主要通过形态性状改良来实现,但在现有小麦品种产量水平已相对较高、叶面积指数和收获系数都已接近极限的情况下,再单纯依靠形态性状遗传改良已很难提高产量[1-4]。因此,小麦产量的进一步提高在一定程度上取决于品种光合生理特性的进一步改善[5-6]。在光呼吸途径经多基因转化等技术重新设计后,转基因烟草和水稻的光合生理特性得到了极大改善,光能利用率、生物量和产量均较野生型对照大幅提高[7-8]。
目前,将丙酮酸磷酸二激酶(pyruvate orthophosphate dikinase, PPDK)、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)、依赖于NADP的苹果酸酶(NADP-Malic enzyme, NADP-ME)等C4光合途径关键酶的基因转入到小麦、水稻等C3作物中,改善C3作物光合作用的内在遗传基础,实现其光合速率和产量的提高一直是植物生物科学研究的前沿领域和热点之一[9-16]。其中,PPDK位于叶肉细胞的叶绿体中,催化CO2最初受体磷酸烯醇式丙酮酸(PEP)的再生,该酶催化的反应是C4光合途径的重要限速步骤[17]。Ishimaru[9-10]首先将玉米C4型PPDK基因导入到拟南芥和马铃薯中,获得的转基因材料PPDK活性较对照显著提高,但光合速率提高不显著;随后Ku等[11]将该基因转入到水稻中,使转基因水稻的光合速率较对照提高35%。本课题组长期开展玉米C4途径关键酶基因转化小麦的研究,从玉米中分离克隆了高光效ZmPPDK基因[12],采用基因枪法导入到河南省小麦大面积推广品种周麦23中,获得了转ZmPPDK基因小麦。本研究以其T2代转基因小麦株系T14和T39为材料,分析了其光合和产量特性,以期为C3植物高光效基因工程与小麦产量遗传改良研究提供理论参考。
1 材料与方法
1.1 试验材料与田间种植
供试材料为T2代转ZmPPDK基因小麦株系T14和T39及野生型对照周麦23。2016年10月将试验材料种植于河南省农业科学院试验基地,2017年4-6月进行试验。试验地耕层土壤有机质含量为12.61 mg·kg-1,碱解氮含量为85.18 mg·kg-1,有效磷含量为29.74 mg·kg-1,速效钾含量为188.50 mg·kg-1。播种前施鸡粪3 000 kg·hm-2和复合肥750 kg·hm-2,小区面积13.37 m2(8.52 m×1.57 m),基本苗270×104株·hm-2,3次重复,随机区组排列,常规栽培管理。
1.2 方 法
1.2.1ZmPPDK基因遗传转化过程
2015年5月取周麦23灌浆中期(花后15 d左右)的籽粒,用70%的乙醇进行表面消毒30 s,然后用无菌水冲洗3次,再用0.1%的HgCl2消毒10 min,无菌水冲洗3次,用解剖刀剥出幼胚,选用1 mm左右的幼胚,放到愈伤组织诱导培养基,于25 ℃暗培养3 d后转移至高渗培养基,渗透处理5 h后进行基因枪轰击,将玉米C4型ZmPPDK基因与BAR基因共同导入,完成轰击后继续高渗处理16 h,转至诱导培养基培养14 d,转至草丁磷抗性筛选(浓度为3 mg·L-1)再生培养基,连续筛选2次,非抗性愈伤褐化死亡,而抗性愈伤则正常生长发育并分化为小麦幼苗(图1A),然后将其转入到生根培养基上,待抗性植株长至10 cm、具有较好的根系时(图1B),打开培养瓶盖子,炼苗3 d后,移栽到花盆中,共获得具有草丁膦抗性的再生小麦植株190株(图1C),2016年10月获得T0代种子。基因枪轰击参数:靶距为9 cm,每枪含质粒DNA1 μg,金粉250 μg,金粉直径为1 μm,轰击压1 100 psi。诱导培养基配方:MS + 2 mg·L-12,4-D + 0.4%琼脂 + 3%蔗糖,pH 6.2;高渗培养基配方:MS+2 mg·L-12,4-D + 0.7%琼脂 +甘露醇 (0.4M)+ 3%蔗糖,pH 5.8;分化培养基:1/2 MS + 0.5 mg·L-1NAA + 2.0 mg·L-1KT + 0.4%琼脂+ 3%蔗糖,pH 6.2;生根培养基配方:1/2 MS + 0.2 mg·L-1NAA + 0.4%琼脂+3%蔗糖,pH 6.5。

A:抗性愈伤组织;B:抗性植株;C:移栽至花盆的抗性植株。
A: glufosinate-resistant callus; B: glufosinate-resistant plants in culture flask; C: glufosinate-resistant plants transplanted to flower box.
图1 具有草丁膦抗性的转基因植株获得过程
Fig.1 Process from callus to glufosinate-resistant plants
参考柴建芳等[18]的方法,提取拔节期小麦叶片的基因组DNA。以T2代转ZmPPDK基因小麦叶片基因组DNA为模板进行目的基因PCR检测,野生型对照周麦23为阴性对照,以转化的载体质粒为阳性对照,转基因小麦T14、T39与阳性对照均扩增到了预期的778 bp条带,阴性对照无目的条带(图2),T14和T39的基因阳性率分别为66.06%和71.43%,表明外源ZmPPDK基因已整合到受体品种周麦23基因组中且可遗传到下一代植株。

1~3:T14植株;4~7:T39植株;8:野生型对照植株;9:阳性对照;M:DL2000。
1-3:T14 plant;4-7:T39 plant; 8:Wild type plant; 9:Positive control; M: DL2000.
图2 转ZmPPDK基因小麦的目的基因PCR检测
Fig.2 PCR analysis ofZmPPDKgene in transgenic wheat
1.2.2 基因表达量测定
按照天根生化科技(北京)有限公司RNA提取试剂盒说明书,提取开花期和灌浆期(花后 15 d)小麦旗叶RNA;反转录试剂盒选用Rever Tre Ace qPCR RT Kit(TOYOBO, Japan),荧光定量试剂盒选用SYBRPremix Ex TaqTMII,均购于宝生物工程(大连)有限公司。荧光定量反应体系为25 μL。反应条件:95 ℃ 10 min;95 ℃ 15 s,57 ℃ 30 s,72 ℃ 30 s,40循环。基因的引物依据NCBI数据库中登录号所对应的序列,利用Primer premier 5.0软件设计。目的基因和内参基因及其引物见表1。在Bio-Rad CFX96型实时荧光定量PCR仪上进行扩增,3次重复,用2-△△Ct法计算基因相对表达量[19]。
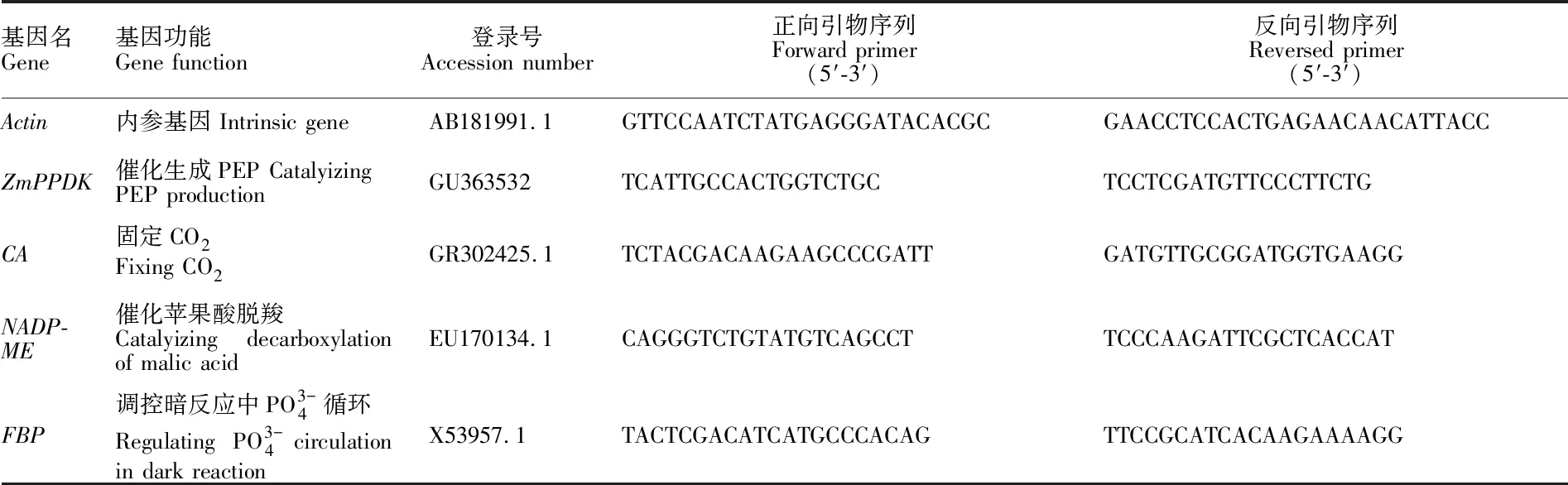
表1 qRT-PCR分析所用引物序列Table 1 Primers for real-time PCR analysis
1.2.3 光合速率测定
在小麦开花期和灌浆期(花后15 d),选择晴朗无云的天气,利用美国PP SYSTEMS公司生产的CIRAS-3型便携式植物光合作用测定仪,测定小麦旗叶净光合速率(net photosynthetic rate,Pn)日变化,每2 h测定3次重复,供气方式选择大气供气,气体流速设置为300 mL·min-1,光源选择自然光。
1.2.4 叶绿素荧光参数测定
按照Genty等[20]方法,在小麦开花期和灌浆期(花后15 d),选择晴朗无云的天气,利用英国汉莎公司生产的FMS-2便携脉冲调制式荧光仪,测定小麦旗叶的最大光化学效率Fv/Fm=(Fm-Fo)/Fm和实际光化学效率ФPSII=(Fm-Fs)/Fm;按照Strasser等[21]方法,利用英国汉莎公司生产的Handy PEA型连续激发式荧光仪,测定小麦旗叶的K点相对可变荧光WK=(FK-Fo)/(FJ-Fo)和J点相对可变荧光VJ=(FFj-Fo)/(Fm-Fo),3次重复。
1.2.5 产量性状测定
灌浆期调查1 m双行样段的有效穗数,折合成每公顷穗数。成熟期收获每小区全部穗子,实打测产,并测定千粒重。
1.3 统计分析
利用DPS 7.05进行统计分析,用LSD法进行多重比较,Microsoft Excel 2010绘图。
2 结果分析
2.1 转基因小麦的旗叶光合速率日变化
测定结果(图3)表明,转基因小麦T14和T39及野生型对照(WT)开花期和灌浆期的旗叶光合速率(Pn)日变化趋势一致,均呈现典型的“双峰”曲线,T14和T39的Pn值在10:00- 14:00显著高于WT。开花期T14和T39的最大Pn值分别为25.6和26.0 μmol·m-1·s-1, 14:00时Pn值与WT差异最大,分别较WT提高 12.46%和12.27%;灌浆期最大Pn值分别为 22.8和 21.9 μmol·m-2·s-1,12:00Pn值与WT差异最大,分别较WT提高17.24%和21.11%。
2.2 转基因小麦光合基因的表达变化
经检测,与WT相比,开花期转基因小麦T14和T39的ZmPPDK及内源基因CA、NADP-ME、FBP的表达量均显著升高,其中ZmPPDK的表达量升高幅度最大,较WT分别提高9.27和10.40倍;灌浆期ZmPPDK、CA、NADP-ME、FBP基因的表达量较开花期均显著降低,但4个基因在转基因小麦T14和T39中的表达量仍显著高于WT,且增幅高于开花期,其中ZmPPDK基因增幅最大,分别较对照提高14.13和15.28倍(图4)。
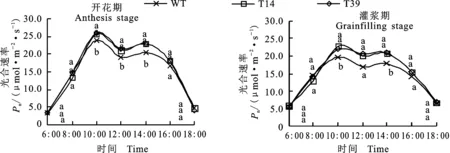
曲线上同一时刻数据上标注的不同小写字母表示材料间差异显著(P<0.05)。
Data at the same time followed by different letters are significantly different among the materials at 0.05 level.
图3 转ZmPPDK基因小麦与野生型对照(WT)的光合速率日变化
Fig.3 Diurnal variation of net photosynthetic rate in transgenic wheat and WT
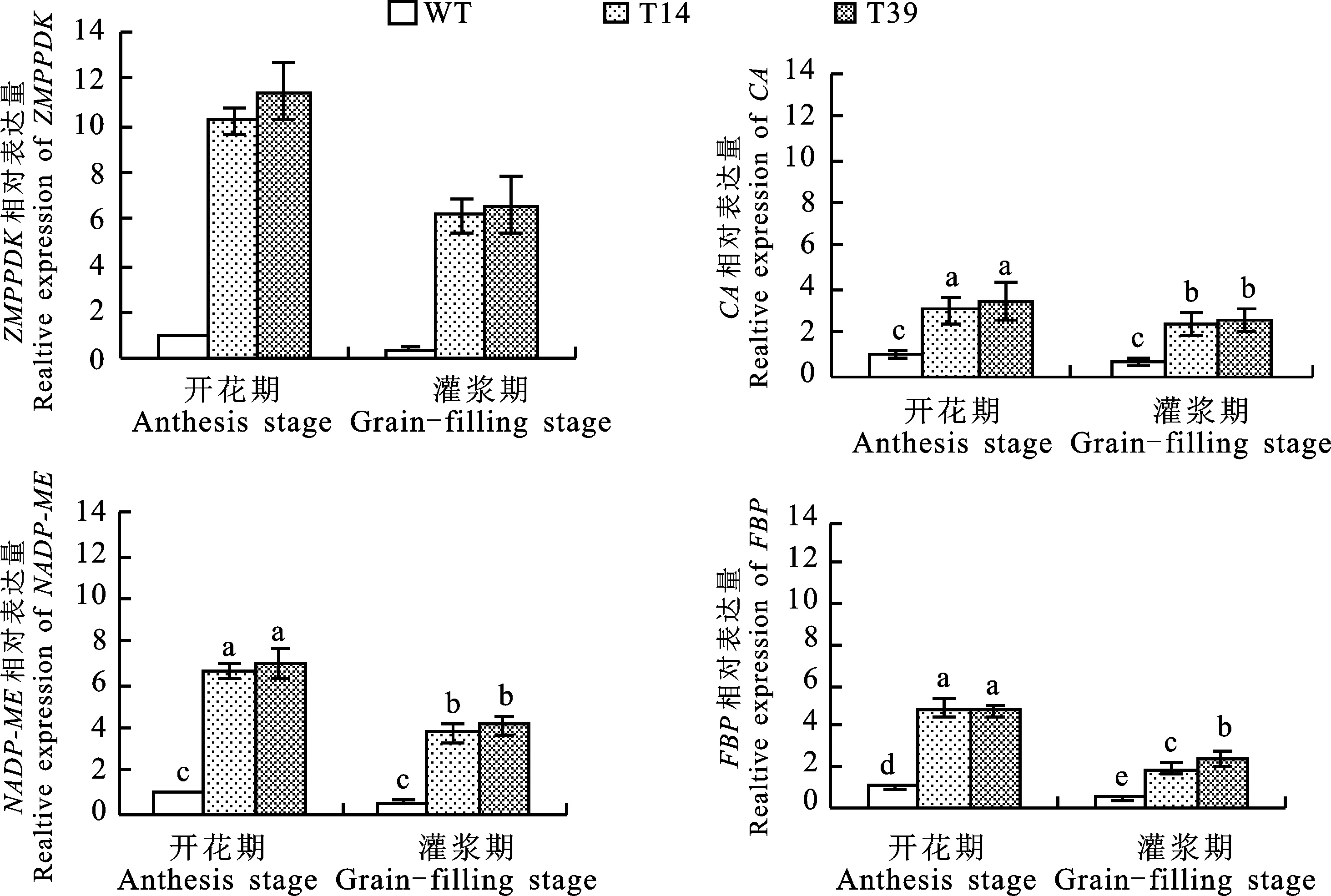
柱状图上不同小写字母表示材料间差异显著(P<0.05)。图5同。
Different letters above the columns are significantly different among the materials at 0.05 level.The same in figure 5.
图4 外源ZmPPDK基因及内源光合相关基因在转基因小麦与野生型对照(WT)中的表达量
Fig.4 Relative expression levels ofZmPPDKand genes related to photosynthesis in transgenic wheat and WT
2.3 转基因小麦的叶绿素荧光参数变化
8:00时转基因小麦的叶绿素荧光参数Fv/Fm、ΦPSII、WK、VJ值与WT均无显著差异(图5)。13:00时由于高温强光的胁迫,转基因小麦和WT的Fv/Fm和ΦPSII值均显著下降,但T14与T39显著高于WT;小麦WK与VJ值较8:00均显著上升,但T14与T39显著低于WT。这说明转基因小麦PSII的活性、光化学效率和电子传递能力均优于野生型对照。
2.4 转基因小麦的产量特点
与WT相比,转基因小麦T14与T39的产量两年均显著增加,两年平均产量的增幅分别为 6.40%和5.02%;转基因小麦的成穗数和穗粒数无显著变化,而千粒重显著增加,两年平均千粒重的增幅分别为6.63%和6.81%。这说明转基因小麦增产的主要原因是千粒重增加(表2)。
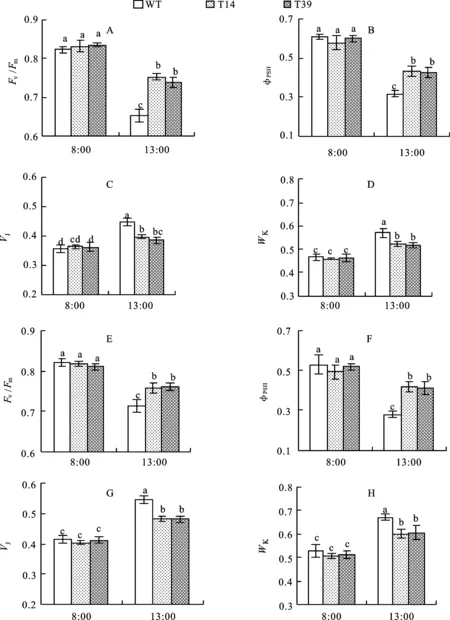
A~D:开花期,E~H:灌浆期。 A-D:Anthesis stage; E-H:Grain filling stage.
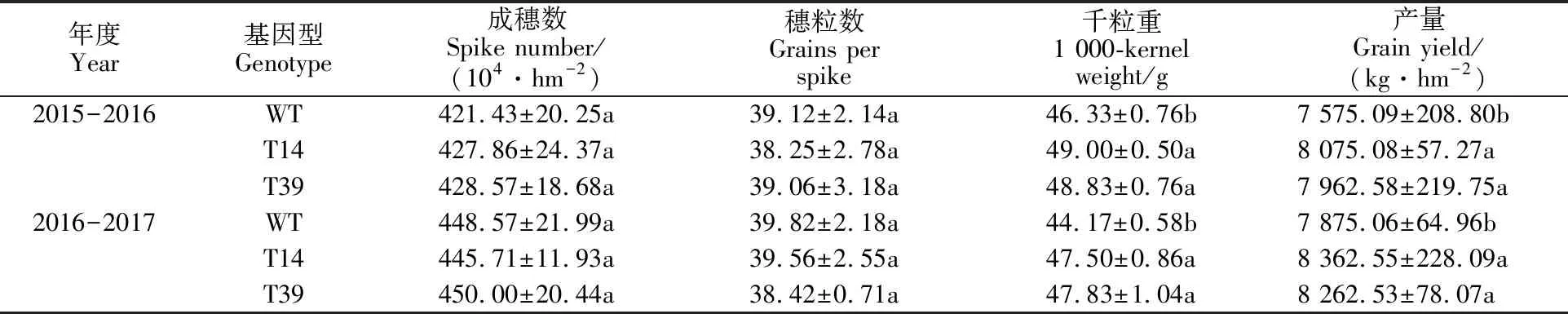
图5 转ZmPPDK基因小麦与野生型对照(WT)在8:00与12:00的叶绿素荧光参数
同列数据后的不同小写字母表示材料间差异显著(P<0.05)。
Data in same column followed by different letters are significantly different among the materials at 0.05 level.
3 讨 论
植物学家和作物育种学家一直都致力于将C4途径的光合关键酶转化到C3植物中,以达到提高C3作物光合效率,进而提高生物量和产量的目的。许多研究人员开展了将C4光合途径关键酶基因PPDK转化C3植物的研究[9-13]。Ku等[11]将玉米C4型PPDK基因转入到水稻后,转基因水稻的光合速率较对照提高35%。本研究也发现,在开花期和灌浆期转ZmPPDK基因小麦T14和T39的10:00-14:00光合速率显著高于野生型对照,最高可增加21.1%。但Ishimaru等[9-10]将玉米C4型PPDK基因导入到拟南芥和马铃薯后,转基因拟南芥和马铃薯的光合速率没有提高。上述结果说明,玉米C4型PPDK基因在不同C3植物中表现出的功能不尽相同,这可能与不同作物的遗传背景不同有关。此外,本课题组获得的转ZmPPDK基因小麦中部分株系的光合速率与野生型对照相比无差异或降低(未发表数据),这可能是基因插入位点与拷贝数不同所致。因此,转基因小麦新品种培育成功的前提是获得一定数量的转基因株系,转化体数量少则难以从中筛选出目标性状较对照显著改善的株系。
通过研究转基因小麦与对照的光合速率日变化发现,转基因小麦在10:00-14:00期间的光合速率显著高于野生型对照,其他时间则无显著差异。10:00-14:00是一天中气温最高的时刻,特别在小麦生育后期更是强光高温同时存在的时刻,说明转基因小麦较对照具有更好的耐强光高温特性,表现出了类C4植物特性。秦立琴等[28]和金立桥等[29]通过测定花生和黄瓜的快速叶绿素荧光诱导动力学曲线,发现强光高温胁迫影响植物的PSII活性。本研究表明,在中午13:00强光高温胁迫时刻,转基因小麦较对照具有较好的最大光化学效率和实际光化学效率,且PSII的电子供体侧与受体侧受伤害程度均显著低于对照,说明在中午强光高温等逆境胁迫下转基因小麦的电子传递链活性显著优于对照,可为暗反应阶段提供更多的能量,进而维持较高的光合速率。
在小麦生育后期经常遭遇高温、强光等逆境,影响小麦籽粒发育,降低千粒重[30]。超高产小麦的生育后期旗叶功能显著优于中产小麦,有利于形成高千粒重[31]。本研究发现,转基因小麦的千粒重显著高于对照,是其增产的主要因素,这主要因为外源ZmPEPC基因可提高小麦生育后期的光合速率,进而促进后期同化物生产和积累,为籽粒灌浆提供充足的底物,最终形成较高的千粒重,也说明转ZmPEPC基因小麦在生育后期较对照具有更好耐高温强光特性。Gu等[32]研究发现,干旱胁迫下玉米PPDK基因可提高水稻的千粒重和产量,与本研究结果相似。有关PPDK基因提高小麦千粒重的分子机制有待深入研究。

