食品用蜡对大白鼠肠道黏膜及其相关淋巴组织的影响
王宣敬,杨妍梅,杨 彪,王玉桂,扎西英派
(西北民族大学生命科学与工程学院,甘肃 兰州730030)
食品用蜡是一个广泛的概念,它指的是直接或间接用于食品及相关材料中的一些天然动植物分泌物,其质地如蜡,而又与其他化工产品的蜡质物有本质上的不同[1]。食品用蜡作为一种涂被剂而广泛用于水果和蔬菜表面,可以防止水分蒸发和细菌侵入,延长其保质期,从而达到果蔬保鲜的目的,常用做水果涂被剂的蜡有巴西棕榈蜡、液体石蜡等[2]。无论何种形式的食品用蜡,都会对人和动物体的消化系统造成不同程度的损害。蜡制品在动物机体内很难被消化,有报道称只有部分鸟类拥有消化蜡的能力[3],微量食品用蜡的摄入,一般不会对机体造成太大影响,但如果食用量过多或蜡制品在体内蓄积,会使得人体排毒和分解器官(肝脏、肾脏)负担过重,影响机体健康[4]。目前,食品用蜡进入消化道后其黏膜免疫系统的反应情况未见报道,食品用蜡对动物机体的安全性有待再次评估。试验以大白鼠为模型,选用食品用蜡中使用较多的巴西棕榈蜡(植物蜡)和液体石蜡(工业蜡)为试验材料,探究食品用蜡对大白鼠肠道黏膜及其相关淋巴组织的影响,对大白鼠肠道黏膜免疫系统有一个整体认识,为下一步研究食品用蜡对大白鼠黏膜免疫系统各项功能的影响奠定基础。从而为食品用蜡的限量以及食品安全提供参考依据。
1 材料
1.1 试验动物 健康的经检疫合格且生长良好体重200 g 的SPF 级SD 大鼠24 只(雌雄各半),购自甘肃省兰州市榆中县动物市场。
1.2 药品与试剂 食品用蜡(巴西棕榈蜡、液体石蜡),上海新诺化工有限公司生产;甲醛溶液、乙醇、冰醋酸和二甲苯(均为分析纯),天津市富宇精细化工有限公司生产;醇溶性伊红(Eosin Y)、苏木精(Hematoxylin),上海伯奥生物科技有限公司生产;石蜡,上海标本模型厂生产。
1.3 主要仪器 数码照相机(型号为Nikoncoolpix 4500),日本尼康公司生产;镀铬游标卡尺(型号为0 ~200 mm,精确度0.02 mm),上海申韩量具有限公司生产;电子天平(型号为SL-N),上海民桥精密科学仪器有限公司生产;可调式电热板(型号为ML-1.8-4),北京科伟永兴仪器有限公司生产;恒温干燥器(型号为KW-I),上海跃进医疗器械厂生产;石蜡切片机(型号为LEICA Histo stat 820)、光学显微镜(型号为LEICA-DM500),德国莱卡公司生产;摊片机(型号为HD-P)、烘片机(型号为HD-H),浙江省金华市科迪仪器设备有限公司生产;自动染色仪(型号为MICROM HMS70),德国MICROM 公司生产;光学显微镜及Pro-express 图像采集系统(型号为OLYMPUS BX-UCB/BX61),日本奥林巴斯公司生产。
2 方法
2.1 试验动物建立模型 所用试验动物为年龄平均2-3 月龄雌雄各半的大白鼠24 只,前期饲喂营养饲料适应2 日。将24 只大白鼠分为3 组,对照组(生理盐水灌胃)8 只,试验组1(巴西棕榈蜡灌胃)8只,试验组2(液体石蜡灌胃)8 只,参照相关文献每隔1 d 灌胃1 次[4],按等效剂量换算0.01 mL/100 g,灌胃15 d,灌胃期间按照大白鼠正常的采食量喂食鼠粮30 g。
2.2 样本采集 对大白鼠进行急性失血处死,迅速剖检,分离出消化道,结扎幽门口和回盲口,摘取完整的肠道,去除肠管周围脂肪及结缔组织,置于新配制的生理盐水(37 ℃)中(注意不要损伤肠黏膜),待肠道内容物自行脱落,肠黏膜结构清晰可见,迅速置4%甲醛溶液(pH 值7.4)中固定12 h 后换液固定10 d[5]。
2.3 检测指标
2.3.1 解剖学检查 每组随机选取4 只经急性失血处死的大白鼠完整肠道,去除肠管周围脂肪及结缔组织,沿肠系膜纵行剖开肠管,暴露黏膜面,观察黏膜的形态并统计黏膜表面派伊尔淋巴集结(Peyer′s patch,PP)。按照解剖学特征标记出十二指肠、空肠、回肠、盲肠、结肠和直肠,记录各肠段PP 的数量、形态特征和分布情况,并拍照采集各肠段黏膜及PP 的解剖学图片。用作解剖学数据采集的肠道,因其黏膜已经受到损伤,因此不再用于组织学检查。
2.3.2 组织学检查 对4%甲醛溶液固定的小肠及大肠肠段以5 cm 为间隔进行样本采集,样本长度约1 cm,按试验分组进行标记。对所采集样本进行石蜡包埋,常规切片(厚度为6 μm),苏木精-伊红染色(H.E.染色)和PAS 染色[6],经光学显微镜观察并用Pro-express 图像采集系统采集照片。
2.4 数据的统计分析 根据所得解剖学数据对试验组与对照组肠道PP 的形态特征、数量和分布情况进行对比分析。按照解剖学进行分段(十二指肠、空肠、回肠、盲肠、结肠和直肠),每个肠段随机选取10 张组织切片,使用Image-Pro Plus 6.0 图像测量分析系统,测算每10 mm2面积内固有层与黏膜下层内淋巴滤泡的数量,每张切片中选取3 根柱状排列整齐且最长的肠绒毛统计杯状细胞的数量[7]。采用SPSS 21.0 软件对试验数据进行统计分析,试验数据以“平均值±标准误”表示,P <0.05 表示差异显著。
3 结果
3.1 解剖学检查
3.1.1 肠黏膜变化及黏膜PP 形态特征 对试验组和对照组大白鼠的肠道黏膜表面进行解剖观察,各组仅在空肠、回肠、盲肠和结肠中发现结构明显的派伊尔淋巴集结,对比发现试验组与对照组大白鼠小肠的PP 均为结节状,大肠为火山口状和结节状,其形态无明显差异;且肠黏膜均无病理变化。解剖学检查未发现食品用蜡对肠道造成形态学损伤。各组小肠及大肠黏膜表面PP 的对比见图1、2、3、4。

图1 空肠黏膜表面PP 对比

图2 回肠黏膜表面PP 对比

图3 盲肠黏膜表面PP 对比
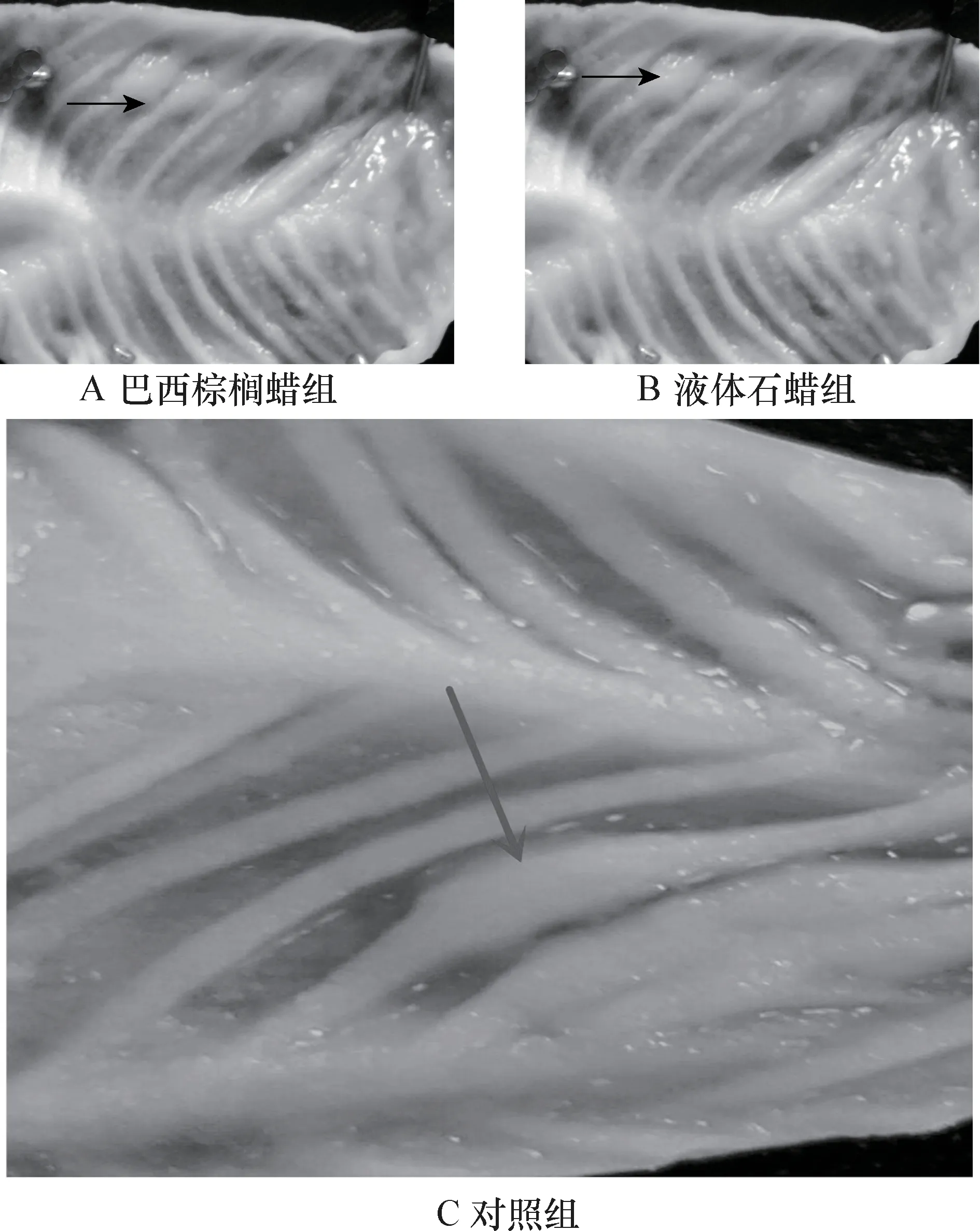
图4 结肠黏膜表面PP 对比
3.1.2 肠黏膜PP 数量及分布 对试验组和对照组大白鼠的肠道黏膜表面的PP 进行数量统计,小肠黏膜表面PP 主要分布于空肠和回肠;大肠黏膜表面PP 主要分布于盲肠和结肠。对比试验组和对照组各肠段PP 数量分布,三组数量分布差异不显著(P >0.05)。
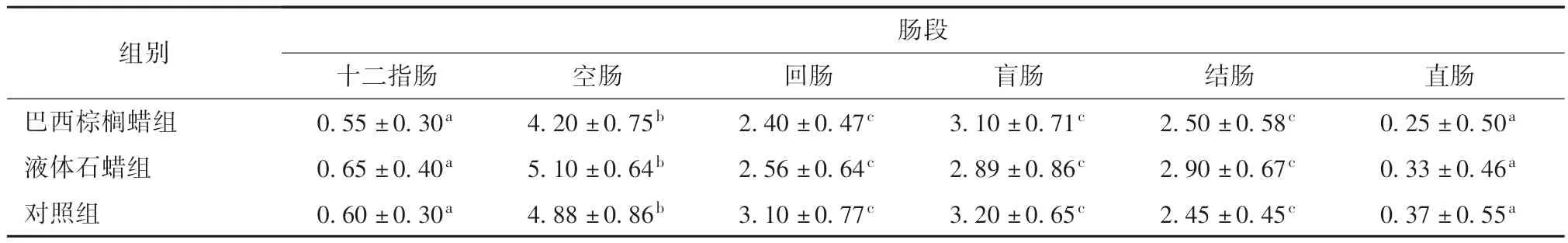
表1 各组肠道各段PP 分布数量分析
3.2 组织学检查
3.2.1 肠黏膜组织学特征 组织学结果选取了黏膜形成环状襞、内有密集肠绒毛、肠段最长的空肠,观察发现试验组肠黏膜完整性被破坏,肠黏膜部分脱落。 灌胃液体石蜡组较灌胃巴西棕榈蜡组严重,对照组无明显变化。 结果表明,食品用蜡对肠绒毛有损伤效果。 肠绒毛对比见中插彩版图5。
3.2.2 肠黏膜表面相关淋巴组织的组织学分布 组织学观察发现,肠道黏膜淋巴组织主要分布于肠黏膜固有层和黏膜下层,且在镜下表现为由固有层向下延伸到达黏膜下层,主要以弥散的淋巴组织(Diffuse lymphoid tissue , DLT)、孤立的淋巴小结(ILF)和淋巴集结(ALN)的形式存在。对PP 单位面积内(每10 mm2内)淋巴滤泡数量计数并统计,结果发现,食品用蜡并未刺激肠道黏膜表面相关淋巴组织数量的显著改变。肠黏膜表面PP 内淋巴滤泡的数量的测定结果见表2。
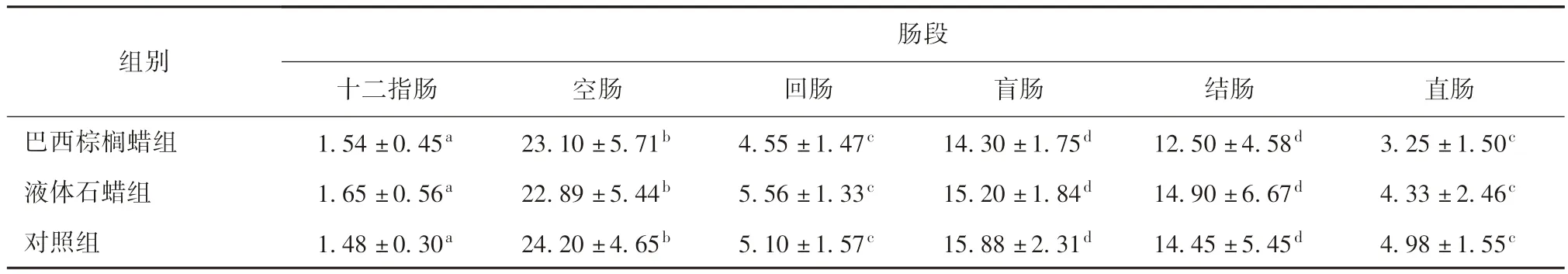
表2 各组肠道各段淋巴滤泡数量分析
3.2.3 肠黏膜表面杯状细胞的数量 灌胃巴西棕榈蜡组与对照组对比,杯状细胞的数量无显著差异(P >0.05);灌胃液体石蜡的试验组与对照组对比,杯状细胞的数量差异显著(P <0.05),说明液体石蜡的存在使肠道黏膜表面的杯状细胞数量增加。 肠黏膜表面杯状细胞的数量的测定结果见表3。空肠怀状细胞数量对比见中插彩版图6。

表3 各组肠道各段杯状细胞数量分析
4 讨论
4.1 食品用蜡对大白鼠肠道黏膜的影响 肠道是机体内消化与吸收营养物质的主要场所,食品用蜡被摄入后在肠道存在的时间最长,不同种类的食品用蜡对肠黏膜产生的效果也不相同,巴西棕榈蜡为植物蜡,液体石蜡为工业蜡,组织学结果显示,液体石蜡造成肠黏膜绒毛的脱落,其程度高于巴西棕榈蜡,试验结果未发现肠黏膜中存在试验用蜡,从而不能确定肠道对试验用蜡是否有吸收作用,但可以确定试验用蜡可以对肠道黏膜造成不同程度的损伤。
杯状细胞是一种典型的糖蛋白分泌细胞,其分泌的黏蛋白释入管腔内成为润滑性黏液涂布于黏膜表面,对肠黏膜表面有保护作用[8]。肠道上皮内杯状细胞来源于肠腺内杯状细胞分化,逐步向上迁移至绒毛,最后从绒毛顶端死亡脱落。Grant 等[9]研究发现,大鼠肠道的杯状细胞位于结肠腺底部的干细胞在向表面迁移的过程中增殖、分化形成,而且在肠腺基底部增生速度最快,但其迁移速度比其他上皮细胞慢得多。结果显示,液体石蜡可以刺激肠黏膜杯状细胞数量的增加。原因可能是在大白鼠灌胃液体石蜡后,激活了机体肠道黏膜保护功能,在刺激因子作用下,杯状细胞增生,细胞分泌功能增强,参与肠道内的石蜡乳糜的清除。杯状细胞分泌的黏液润滑了肠道,使得消化道内粪便软化,从而排除消化道内不能被吸收的石蜡乳糜。而巴西棕榈蜡对肠黏膜的刺激较小,杯状细胞的数量变化不明显。
4.2 食品用蜡对大白鼠肠黏膜相关淋巴组织的影响 通过试验组和对照组数据的对比,未发现试验用蜡对肠黏膜相关淋巴组织的形态和数量分布产生明显的影响。试验组与对照组肠黏膜表面PP 从十二指肠到直肠,形态结构均未发生明显变化,与前面肠段相比在直肠的PP 有缩小退化的趋势,因为直肠位于肠道的后段,消化吸收和免疫功能减弱,淋巴组织逐渐退化。在空肠处PP 为结节状,在盲肠处为火山口状,在结肠处为结节状,火山口状和结节状的外观可以达到既不影响正常的内容物运行,又能起到类似于“陷窝”的效果,在抗原物质沉积到该结构内部后,引起免疫诱导反应[10]。试验组和对照组肠黏膜表面PP 和淋巴滤泡的数量差异不显著(P >0.05)。从十二指肠到直肠的整个肠道,PP 和淋巴滤泡的数量分布呈空肠最多,其他肠段次之,这种分布特点是由于大白鼠的肠道内容物从十二指肠起始,根据肠段的长度不同,在各肠段停留时间不同,为了发挥更好的免疫效果,PP 和淋巴滤泡的数量分布也就不相同[11]。
综上所述,试验所用食品用蜡对肠道黏膜及其相关淋巴组织产生不同程度的影响,其影响主要表现在对肠黏膜表面绒毛的破坏和引起杯状细胞数量的增加,但未发现食用蜡对黏膜相关淋巴组织的明显损伤,在肠道是否引起免疫反应,有待于后续试验和研究。巴西棕榈蜡作为植物蜡应用于食品用蜡对肠道的损伤相对于液体石蜡小。试验研究为进一步研究食品用蜡对动物机体消化与免疫系统的影响提供基础。为食品用蜡的选择、限量和食品安全提供了参考。

