实验小鼠粪便中致病性病原微生物检测与耐药性分析
杨全中,张 煜,谢永生
(1.新乡医学院三全学院基础医学院,河南 新乡453000;2.新乡医学院基础医学院,河南 新乡453000)
实验小鼠是属于野生鼷鼠变种中鼠属,是实验室主要的使用的模式动物之一,在动物传染病、微生物、药品等多种研究领域中广泛应用,实验小鼠常用的品种是昆明系小鼠,为科学研究工作提供可靠的支持[1-3]。动物粪便中含有多种有害物质,成为了生物污染的重要来源之一,给人类的健康造成严重的威胁,成为公共卫生问题[4]。相关研究表明了在每年我国畜禽养殖业中产生的粪便总量为32.64×108t 以上,粪便中含有沙门菌、大肠杆菌、志贺菌、金黄色葡萄球菌、粪肠球菌等多种病原微生物,粪便处理不当,这些含有病原微生物的粪便流入环境中、水源中,造成严重的污染,同时也可以引起其他动物的感染[5-7]。因此,在养殖过程中动物粪便的处理,应该引起重视。病原微生物的携带的致病性及耐药性可以随着消化道排泄的粪便中,这些病原微生物携带的致病性及耐药性可以通过多种途径转移到人的体内,危害人类健康的[6-7]。因此,对实验小鼠粪便中致病性病原微生物分布与耐药性具有重要的意义。
本试验从某市的实验小鼠养殖基地采集粪便样品120 份中分离到大肠杆菌、沙门菌、志贺菌3 种病原菌,并对分离的病原菌进行了致病性及耐药性检测与分析。为实验小鼠健康养殖及细菌病防治提供了研究基础。
1 材料与方法
1.1 病料来源 从某市的实验小鼠养殖基地采集粪便样品120 份,装入含有无菌的PBS 的采集管中,经过处理进行病原菌检测。
1.2 主要试剂 大肠杆菌显色鉴别培养基、S.S.培养基、7%绵羊血培养基、XLD 培养基、普通营养肉汤购自青岛海博生物有限责任公司;ID32E 肠道菌鉴定试条、16 种常用的药敏纸片,均购自杭州天和微生物试剂有限公司;DL-2 000 Marker,购自北京中科瑞泰生物公司、2×Taq Marker Mix,购自北京康为世纪生物科技有限公司;细菌基因组DNA 提取试剂盒,购自北京天根生物科技有限公司;常规的试剂和仪器由本实验室提供。
1.3 实验动物 450 只体重22 g 左右的健康的昆明系小鼠由某市的实验小鼠养殖基地提供。
1.4 分离与鉴定 取无菌的PBS 的采集管中样品,无菌分区接种于7%绵羊血培养基上,一个样品一个区,在37 ℃恒温箱进行扩大培养,并挑取7%绵羊血培养基上单个优势菌落分别接种于S.S.培养基、XLD 培养基、大肠杆菌显色鉴别培养基3 种培养基进行鉴别培养,挑取鉴别培养基上的单个菌落接种于营养肉汤中进行纯化培养后,进行生化试验和染色镜检。
1.5 生化试验鉴定 按照ID32E 肠道菌鉴定试条说明书,用全自动细菌生化鉴定系统对纯化的菌株进行生化试验鉴定。
1.6 分离菌株PCR 的检测与测序 参考文献[8],根据大肠杆菌、沙门菌、志贺菌保守区基因序列设计特异引物23 Sr RNA 基因、invA 基因和志贺菌ipaH 基因(表1),引物由生工生物工程(上海)股份有限公司合成。按照试剂盒说明书提取分离菌株的基因组DNA,以提取的分离菌株的基因组DNA为模板,进行PCR 鉴定,并将分离菌株的PCR 扩增产物送生工生物工程(上海)股份有限公司进行测序,分离菌株的测序结果与GenBank 数据库中登录参考株的基因序列进行同源性比较。见表1。

表1 引物序列
1.7 动物致病性试验 参照文献[9],进行动物致病性试验。将取纯化培养的分离株培养至对数期进行计数,每株分离菌株灌胃攻毒5 只小鼠,剂量为0.25 mL(1×108CFU/mL),对照组给予等量的无菌的PBS。攻毒12 h 后观察6 d 并记录每组小鼠的死亡情况,并进行病原菌鉴定。
1.8 药敏试验 分离菌株的药敏试验参照用美国临床检验标准委员会(NCCLS)推荐的标准K-B 纸片法进行,按照CLSI 的标准判断耐药(R)、敏感(S)或中介(I)进行结果判断,分析耐药性分析。
2 结果
2.1 分离培养结果 疑似沙门菌在S.S.琼脂培养基长出了半透明,圆形的、个别的中间带有黑色心的菌落,分离菌株革兰染色为阴性、两端略圆的小直杆状。疑似志贺菌分离菌株在XLD 培养基上长出光半透明的、滑的、圆形、表面光滑的中等大小粉红色或者无色的菌落。疑似大肠杆菌的分离菌株在大肠杆菌显色鉴别培养基长出湿润的、圆形的、大小一致的浅绿色或者绿色的菌落,分离菌株革兰染色为阴性,呈两端钝圆杆状菌;分离菌株革兰染色为阴性、呈两端略圆的短杆状。
2.2 生化鉴定结果 分离的30 株分离菌株均能发酵枸橼酸盐、葡萄糖、麦芽糖、甘露醇;吲哚试验呈阴性,个别的菌株产生H2S,被鉴定为沙门菌,评定结果合格率为98.9%~100%;分离的25 株分离菌株均能发酵葡萄糖、麦芽糖、甘露醇,硝酸盐试验、M.-R.试验、枸橼酸盐试验和吲哚试验均为阳性;尿素酶试验和V-P 试验阴性。被鉴定为志贺菌,评定结果合格率为98.9%~99.9%;分离的35 株均能分解甘露醇、葡萄糖、麦芽糖产酸产气,V-P 试验呈阴性、吲哚和甲基红反应为阳性,被鉴定为大肠杆菌,评定结果合格率为99.0%~100%;
2.3 PCR 检测与测序结果 分离的30 株分离菌株用沙门菌invA 基因引物均扩增出大约为184 bp 大小的目的条带,分离的25 株分离菌用志贺菌ipaH基因引物均扩增出大约为393 bp 大小的目的条带,分离的35 株用大肠杆菌23 Sr RNA 基因引物均扩增出大约为652 bp 大小的目的条带(图1)。测序结果显示,30 株分离菌株测序结果与GenBank 库中登录的沙门菌参考株基因序列同源性在98.9%~99.9%之间;25 株分离菌株测序结果与GenBank 库中登录的志贺菌参考株基因序列的同源性在97.9%~99.9%之间;35 株分离菌株测序结果与GenBank 库中登录的大肠杆菌参考株基因序列同源性99.0%~100.0%之间;因而证实了从采集的120份样品中分离得到了30 株沙门菌、25 株志贺菌、35株大肠杆菌。
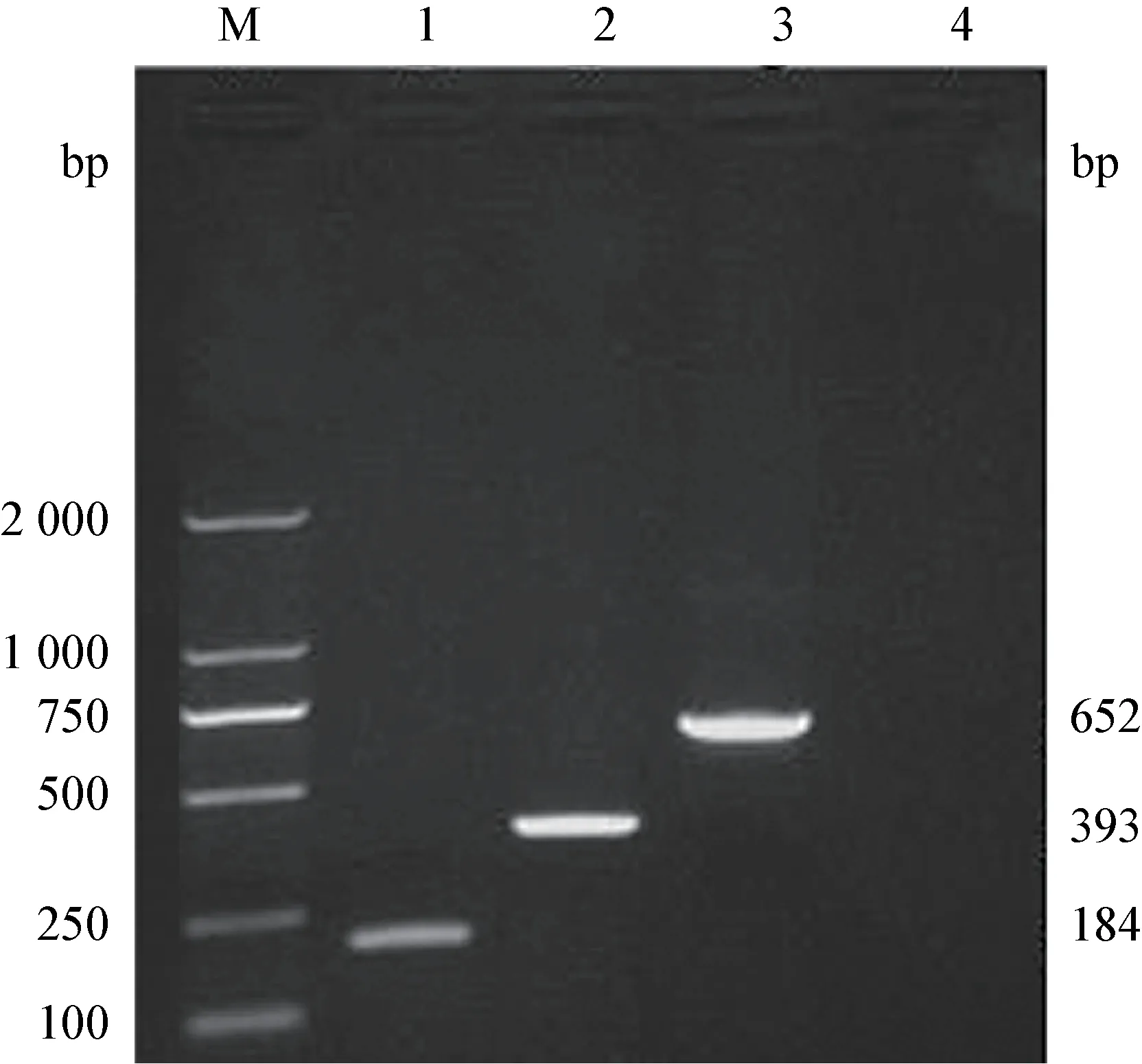
图1 分离菌株PCR 鉴定结果
2.4 致病性试验结果 在攻毒后的48 ~96 h,攻毒的不同的分离菌株小鼠出现不同程度的死亡,直到试验结束。从死亡的小鼠的肝脏内分离到了沙门菌、志贺菌、大肠杆菌。对照组的小鼠健康存活,经过统计与分析,24 株为致病性沙门菌、20 株为致病性志贺菌。25 株为致病性大肠杆菌。
2.5 药敏试验结果 结果由表2 可知,分离的24株致病性沙门菌、大肠杆菌对氨苄西林、阿莫西林、青霉素、氨曲南、氟苯尼考、链霉素、庆大霉素、万古霉素、多西环素、磺胺间甲氧嘧啶10 种药物耐药性比较强,耐药性在50.0%~100.0%之间,对头孢噻呋、头孢曲松 大观霉素、林可霉素、环丙沙星、恩诺沙星6 种药物相对较低,耐药性在16.7%~37.5%之间;分离的20 株致病性志贺菌对氨苄西林、阿莫西林、青霉素、氟苯尼考、磺胺间甲氧嘧啶、大观霉素、多西环素、链霉素、庆大霉素10 种药物耐药性较高,耐药率在65.0%~100%之间,对头孢噻呋、头孢曲松、氨曲南、林可霉素、恩诺沙星、环丙沙星6 种药物耐药率在10.0%~35.0%之间;分离的25 株致病性大肠杆菌对氨苄西林、阿莫西林、青霉素、氟苯尼考、链霉素、庆大霉素、多西环素、磺胺间甲氧嘧啶9 种药物耐药性较高,耐药率在60.0%~100.0%之间,头孢噻呋、头孢曲松、氨曲南、大观霉素、万古霉素、恩诺沙星、环丙沙星等8 种药耐药率在12.0%~48.0%之间。
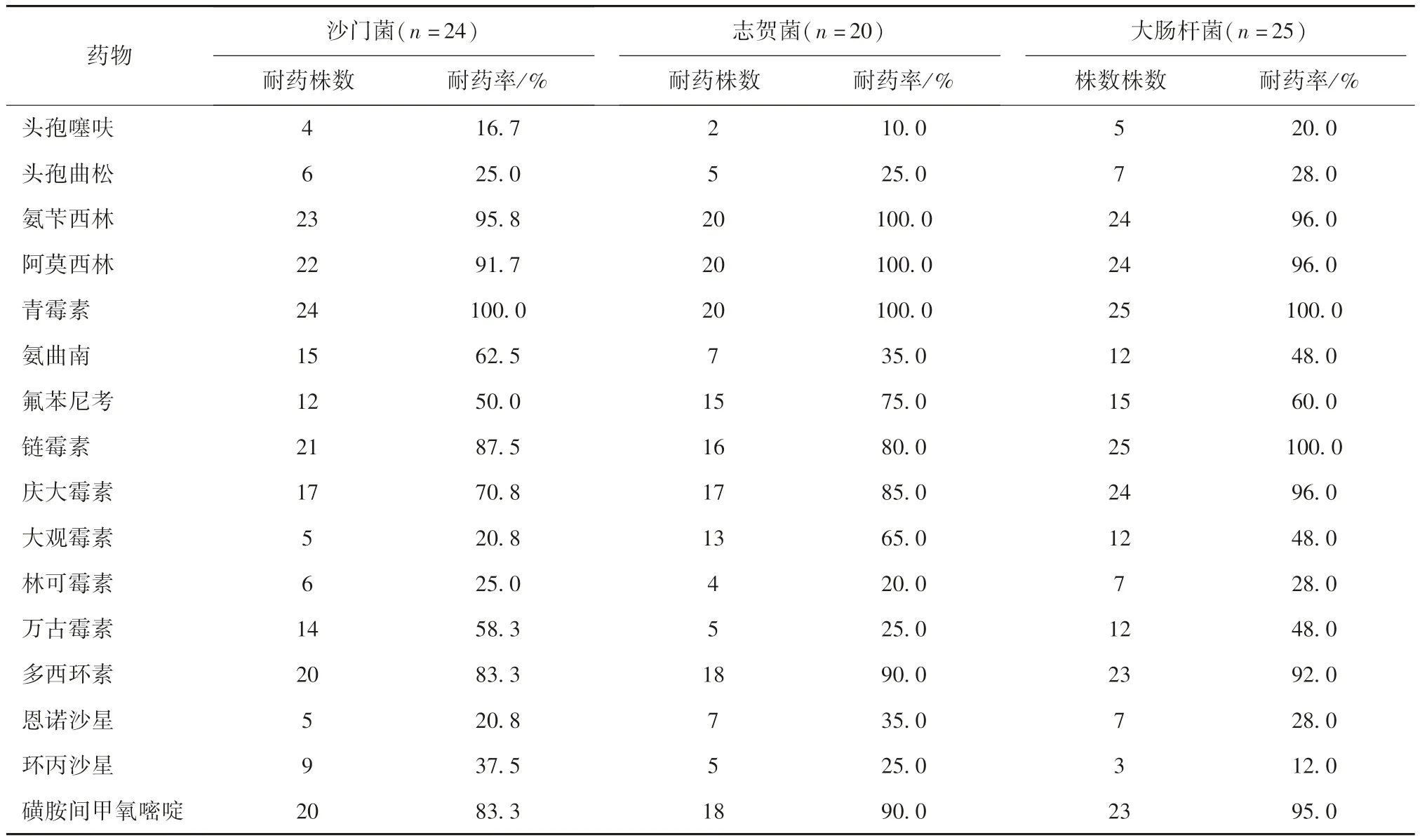
表2 分离菌株耐药性分析结果
3 讨论
动物粪中含有细菌、益生菌、噬菌体等多种微生物,粪便中所含的微生物具种类繁多复杂 呈现多样性化分布、易污染环境等特点,粪便中的一些致病性的病原微生物所携带致病因子和耐药性可以通过多种途径污染食品传播给人类,给人类的健康带来严重的威胁[10-11]。相关研究表明了致病性病原菌,如大肠杆菌、沙门菌、志贺菌、葡萄球菌等广泛存在动物粪便中,同时这些致病病原菌也是引起人们食物中毒的病原菌[13]。本试验从某市的实验小鼠养殖基地采集粪便样品120 份中分离了25 株致病性大肠杆菌、24 株致病性沙门菌、20 株致病性志贺菌。说明了致病性大肠杆菌、致病性沙门菌、致病性志贺菌在某市的实验小鼠养殖基地的粪便中广泛存在,应引起重视。大肠杆菌、沙门菌、志贺菌为条件致病菌,当外界条件改变时,有可能引起实验小鼠发病,在实验小鼠养殖过程中应该引起重视,勤换垫料、注意环境中的消毒。 李基棕等[14]研究表明了在贵州省养猪场中粪便样品中分离到了4 种致病菌。文明等[15]研究表明了在猪粪便中分离到大肠杆菌、葡萄球菌和链球菌3种病原菌。与本试验存在一定差异性,可能与宿主有关。
相关研究表明了从粪便中分离的沙门菌、大肠杆菌、葡萄球菌、链球菌等多种致病菌具有很强的耐药性,且出现多重耐药性,这些致病菌的耐药性可以通过环境、畜产品等途径传播给人类[13-16]。本试验研究表明,分离的24 株致病性沙门菌对氨苄西林、阿莫西林、青霉素等10 种药物的耐药率在50.0%以上,对其他药物耐药率在16.7%~37.5%之间;分离的20 株致病性志贺菌对氨苄西林、阿莫西林、青霉素等10 种药物耐药率在65.0%以上,对其他药物的耐药率在10.0% ~35.0%之间;分离的25 株致病性大肠杆菌对氨苄西林、阿莫西林、青霉素等9 种药物耐药率在60.0%以上,对其他药物耐药率在12.0% ~48.0%之间。说明了从实验小鼠粪便中分离的病原菌耐药性严重,应该引起重视。国内关于猪粪便中分离的病原菌耐药性报道较多,关于实验小鼠粪便中病原菌及耐药性国内未见报道,有待进一步研究。

