目标检测算法在乳腺癌病灶的影像学诊断上的应用
陈志刚,黄斯彤
(广州市第一人民医院采购中心,广州510180)
0 引言
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤,乳腺癌其中99%为女性患者,男性患者仅占1%。原位乳腺癌并不致命,但由于乳腺癌细胞丧失了正常细胞的特性,细胞之间连接松散,容易脱落,一旦癌细胞脱落,游离的癌细胞就会随血液或者淋巴液播散全身,形成转移,危及生命。虽然中国女性乳腺癌发病率和死亡率相对于全球来说处于较低水平,但是呈现疯狂增长的趋势,尤其在我国沿海发达地区,乳腺癌发病率已成为女性恶性肿瘤发病率的第一位[1-2]。乳腺癌的早期诊断与准确分析能为临床指定合理的治疗方案提供客观依据,并且能帮助部分患者获得治愈的机会,准确检测乳腺癌病灶是提高乳腺癌患者生存率的关键。
我国人均医疗资源相对短缺。将目标检测方法应用到医学影像上,实现高度自动化精准检测乳腺癌僵尸乳腺癌影像学诊断的发展趋势。这样不仅有助于解决基层医疗诊断资源匮乏的困境,同时还能提高乳腺癌筛查的效率和质量。
近年来,在乳腺癌的诊断和治疗的影像学方法主要包括乳腺钼靶X 照相(MM)、超声(US)、计算机体层扫描(CT)、磁共振成像(MRI)以及核医学核素示踪技术检测等[1]。
由于价格低廉,成像简单并且迅速等优点,目前MM 是检测早起乳腺癌的一种最基本、最有效的检查方法[3],乳腺钼靶X 射线摄影检查对微钙化较为敏感,能够从整体上对乳腺进行观察,并且对直径较小的乳腺肿瘤的检查率很高。但是当乳腺含脂肪较少时,MM探测乳腺癌的灵敏度会下降。超声检查则是根据集体组织阻抗的不同而形成微小界面成像,有着较高的软组织分辨率[4],但对微小钙化的检出率低。
目前,计算机辅助诊断(Computer-Aided Diagnosis,CAD)系统已经逐渐用于医学检测,性能好的计算机辅助检测系统能够有效地防止因为视觉疲劳和人为精神疏忽而造成的误诊和漏诊,帮助医生更好地识别图像中的微小病变。王曙燕等人[5]利用决策树算法对乳腺癌图像数据进行分类,提出了一个基于决策树算法的医学图像分类器。结果实现了ID3 和C4.5 算法对图像数据的分类,获得了分类的实验结果。王颖等人[6]提出了结合图像增强和支持向量机(Support Vector Machine,SVM)的方法来识别肿块区域。该方法首先根据增强图像和原图中像素的灰度和对比度等特征,提取出饱满的种子区域,然后在感兴趣区域进行了特征提取后,将SVM 分类器应用于肿块区域和正常组织的分类中。这些方法尽管都取得了一些可见的有效成果,但是这些方法都只是浅层行,往往需要由人工设计提取数据的特征,而后再利用这些特征作为算法的输入从而进行分类或者回归,这时特征的质量就成为决定系统性能的关键。
而深度学习则可以从大量数据样本中直接从原始高维数据中发掘出复杂的结构特征,高层网络所需的特征可以通过组合低层网络提取到的特征形成,从而形成降低原始数据的冗余信息并且具有更高级语义信息的高层特征,大大增强了模型的表达能力。
常见的基于卷积神经网络(CNN)的目标检测算法Faster R-CNN[7]首先使用一组基础的卷积和池化层提取输入图像的特征图,然后得到相应的候选区域,通过对感兴趣区域池化将不同的候选区域的特征图转化为固定的长度给全连接层,最后通过Softmax 分类,它是利用损失函数完成边框回归,获得目标的精确位置信息。R-CNN[7-8]系列方法都是先通过卷及审计网络产生一系列稀疏的候选框,然后再对这些候选框进行分类与回归,这类型的方法往往有更高的准确度。
基于深度学习的另一个目标检测算法YOLO[9]能将目标区域预测和目标类别预测整合于单个神经网络模型中,实现在准确率较高的情况下快速目标检测与识别,更加适合现场应用环境,但是目标区域定位误差较大。
本研究提出的基于SSD[10]的乳腺癌病灶检测方法,相比Faster R-CNN 有明显的速度优势,相比YOLO 又有明显的mAP 优势,从而可以获得更加稳健的模型,适用于医院的CAD 系统,有利于减轻医师负担,明显提高乳腺癌病灶的检测正确率。
1 算法实现
选取乳腺超声图像一万余张,人工标注每张图所含有的病灶区域;随机选取其中1/5 的数据作为测试数据,其余的作为训练数据。
检测乳腺癌病灶主要分为两个步骤:①采用一系列图像变换的方法对US 原图像数据进行预处理,增加超声图图像多样性,以更好地提取乳腺癌病灶特征;②将预处理后的图像数据输入到SSD 网络进行检测以及定位。流程图如图1 所示。
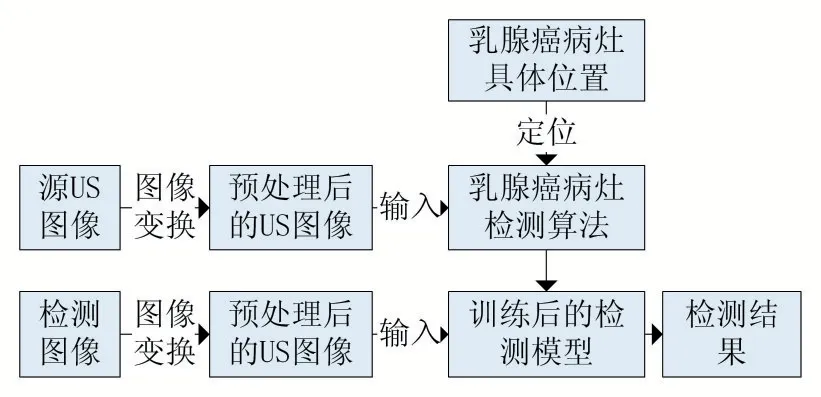
图1 检测乳腺癌病灶流程图
(1)图像预处理
在深度学习过程中,如果数据量过少就很难体现出深度学习算法的优势,往往会造成数据过拟合或者网络无法收敛。为了提高神经网络的泛化性,本文通过数据增强算法对原始图像数据进行几何变换,改变图像像素的位置并保证特征不变,从而扩大数据集规模。在扩增后的数据集上训练网络比直接在原来的数据集上训练得到的网络模型性能更好,并且可以减少过拟合现象的发生,增强了泛化能力。
为了不影响临床诊断结果,本研究将不考虑采用涉及到色彩、形变和噪声改变的图像变换算法,而是对其中一部分数据采用反射变换,随机旋转图像一定角度,使图像内容的朝向发生改变;对另一部分数据进行尺度变换,参照SIFT 特征提取思想[11],利用指定的尺度因子对图像滤波构造尺度空间。改变图像内容的大小和模糊程度。通过对原始图像进行尺度变换,获得该图像在多尺度下的尺度空间表示序列。在每个候选位置上,通过一个精细拟合的模型来确定关键点的位置和尺度,基于图像局部的梯度方向,分配给每个关键点位置一个或者多个方向;在每个关键点邻域内部,在选定的尺度上测量图像局部的梯度,这些梯度被变换成允许比较大的局部形状和光照的变化的一种表示。除此以外,我们还采用了水平翻转以及随机加噪(噪声为均值为0 的高斯噪声,方差分别为10,20,30)的数据扩增方法,最后我们的数据集为原来的x 倍。
(2)基于SSD 检测乳腺癌病灶
将扩增后的数据集图像作为SSD 的输入进行特征提取,SSD 的第一层使用的是VGG16 特征提取网络[12]提取特征图。VGG 本身也是一种物体分类神经网络,但是为了达到多尺度预测目标的目的。在基础的VGG结构后,由于低层的特征图感受野比较小,而高层的特征图感受野比较大,所以为了达到能够检测到不同尺度的物体的目的,我们抽取特定卷积层上大小为W×H×Channel 的特征图,用一个3×3 的卷积层对每一个特征图进行预测。输出的结果边界框对应的是其中类别的得分或者是相对于先验框的坐标偏移量。对应于特征图上的每一个位置(cell)都会有k 个先验框。每一个被选中预测的特征图,其每个位置(cell)都关联k 个先验框,对每个先验框都要输出c 个类别得分和4 个坐标偏移,因此每个先验框有( )c+4 个输出,每个位置有( c+4 )k 个输出,对于W×H 大小的特征图输出为(c+4)×k×W×H 个输出。分别对这些边界框进行检测和分类,生成更多的边界回归框。最后将不同特征图上的边界框结合起来,利用非极大值抑制(Non-Maximum Suppression,NMS)的方法[13]来抑制掉一部分重叠或者不正确的边界框,生成最后的检测框集合。具体网络结构图如图2 所示。
由图2 的结构可知,我们提取了Conv7,Conv8_2,Conv9_2,Conv10_2,Conv11_2 作为检测所用的特征图,加上Conv4_3 层,共6 个特征图,其大小分别是(38,38),(19,19),(10,10),(5,5),(3,3,),(1,1)。由于不同特征图需要设置的先验框数目不同,对于先验框的尺度,有一个线性递增规则:随着特征图大小降低,先验框尺度线性增加:
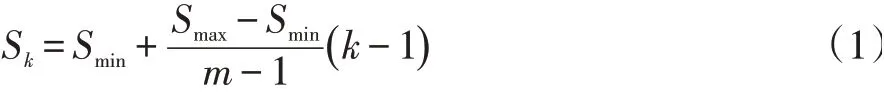
其中m 为特征图的个数,但是由于第一层(Conv4_3 层)是单独设置的,所以应该是5,sk表示的是先验框的大小相对于图片的比例,其中的Smin和Smax表示该比例的最小值和最大值。对于第一个特征图,我们将先验框的尺度比例设置为Smin/2,其中Smin我们设置为0.2,故可以得出第一个特征图的尺度为300×0.1=30 。而对于后面的几个特征图,参考SSD的Caffe 代码可以得出计算规律:先将尺度比例扩大100 倍,此时根据公式(1)可以得知线性增加的增长步长为17。这样可以得出各个特征图Sk分别为20,37,54,71,88,将这些比例除以100,然后再乘以图片大小,可以得到各个特征图的尺度分别为60,111,162,213,264。对于长宽比,按如下公式计算先验框的宽度与高度(其中sk指的是先验框实际尺度,而不是尺度比例):


其中 为特征图大小。
得到特征图后,我们需要通过对特征图进行卷积来得到检测结果。类别置信度和边界框位置各采用一次3×3 卷积来完成。令nk为该特征图所采用的先验框的数目,那么类别置信度所需要的卷积核数量为nk×c,边界框所需要的卷积核数量为nk×4。由于每个先验框都会预测一个边界框,所以SSD 可以预测的边界框是一个相当庞大的数字,这有利于我们研究的密集抽样以及多尺度目标检测。

图2 SSD目标检测网络结构图示
2 实验结果比较
在11072 张训练图片数据上,2,838 张测试图片,YOLO、Faster-RCNN、SSD 的测试结果如表1。
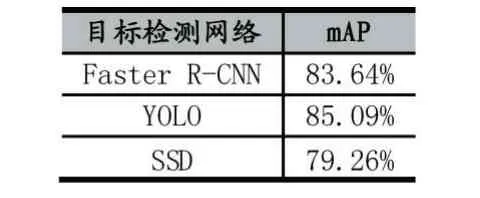
表1 YOLO、Faster-RCNN 和SSD 的性能比较
研究结果采用PASCAL VOC Challenge 比赛中被官方认可提出的平均精度均值(mAP)作为评判不同网络在本研究数据集上有效程度的指标。所以我们需要计算出交并比IoU,即产生的候选框与原标记框的交叠率:
其中area(C)表示产生的候选框的面积,area(G)表示原标记框的面积。
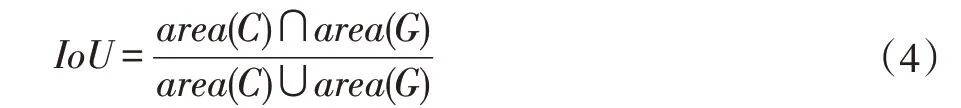
如果IoU 大于等于0.5 则被认为是一个正确框的预测,记为正样本;反之如果小于0.5,则被认为是一个错误的预测,记为负样本。
由以上实验可知SSD 在此任务上性能最佳,在此基础上进行数据增强工作,采用的数据增强方法为翻转、反转、高斯模糊、锐化,效果图如图3 所示。实验结果显示SSD 的性能提升了近3%。

图3 数据增强效果图
3 结语
综上所述,SSD 算法比较其他主流方法在超声图像病灶检测任务中的性能更高,有利于超声医师更加高效地判定乳腺癌;且翻转、反转、高斯模糊、锐化等数据增强方法能有效提高检测结果在此任务中的准确率。

