极光激酶A通过调控Wnt信号通路影响胃癌细胞增殖和侵袭
魏晓东,刘 茜,唐艳萍
胃癌是一种具有高度侵袭性的恶性肿瘤,其发病率和死亡率居我国恶性肿瘤发病率和死亡率第二[1]。胃癌早期诊断率低、治疗效果差、5年生存率低是目前胃癌治疗面临的严峻形势,其发病机制尚不明确,仍是目前重要的研究课题。极光激酶A(Aurora Kinase A,AURKA)是一种丝氨酸/苏氨酸激酶,是极光激酶家族成员之一[2]。在有丝分裂中,AURKA通过参与中心体的分离和成熟以及纺锤体两级的建立,确保有丝分裂中染色体的正确分离和胞质分裂的完成,在细胞周期中起重要作用[3]。AURKA的异常扩增和/或高表达常见于多种胃和食管腺癌[4]。近年来的研究提示,AURKA可参与Wnt等重要的细胞信号通路,作为激酶直接或间接地调节一些重要蛋白的表达,在肿瘤的发生发展中发挥着重要作用[5-6]。Wnt信号通路是生物体内重要的生存信号通路,主要通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,与人类多种肿瘤的发生、发展密切相关[7-8]。为研究胃癌分子病理学机制、寻找以AURKA和EMT(Epithelial Mesenchymal Transition)为对象的治疗靶点提供新的思路。因此本研究通过应用小干扰RNA技术探索AURKA对胃癌细胞SGC-7901增殖侵袭的调控,并分析该基因对胃癌细胞EMT的影响。
1 材料和方法
1.1 实验材料 AURKA小分子抑制剂MLN8237购自美国Selleckchem公司,Trizol试剂购自美国Invitrogen公司,逆转录试剂盒购自美国Promega公司,荧光定量PCR试剂盒购自美国Promega公司。
1.2 细胞培养 人胃癌细胞系SGC-7901购自中国科学院上海生命科学院研究院,培养于含10%胎牛血清的DMEM培养基,于5% CO2、37 ℃的恒温培养箱中培养。
1.3 分组及细胞处理 小分子抑制剂MLN8237使用DMSO溶解为浓度为20 mmol/L的储存液-20 ℃保存,实验分为对照组(DMSO对照处理)和实验组(MLN8237储存液处理),对照组和实验组内DMSO终浓度为0.1%;实验组加入药物MLN823溶液,使终浓度为20 μmol/L;继续处理细胞24 h进行后续实验。
1.4 MTT法检测细胞增殖速率 将处于生长对数期的SGC-7901细胞以4000个/孔细胞的密度接种于96孔板内,接种24 h后,加入浓度为20 mmol/L的MLN8237使得其作用浓度分别为2、4、10、20、40、80 μmol/L。作用24 h后,每孔加入 20 μL MTT 溶液(5 mg/mL),37 ℃培养 4 h。移除上清液,每孔加入200 μL的DMSO后震荡混匀15 min,至完全溶解,用酶标仪在492 nm波长下测定吸光值,记录OD值,确定的IC50为20 μmol/L。取对数生长期的SGC-7901细胞以4000个/孔细胞接种于96孔板内,接种24 h后,实验组加入20 mmol/L的MLN8237工作液使最后作用浓度为20 μmol/L,对照组加入等体积的DMSO溶液。作用24 h后,每孔加入20 μL MTT溶液(5 mg/mL),37 ℃培养4 h,同上处理,细胞破碎后用酶标仪在492 nm波长下测定吸光值,记录OD值,每隔24 h收集一次并检测,绘制细胞生长曲线。细胞增殖速率(%)=各检测时间点细胞数/接种细胞数×100%。上述实验重复3次。
1.5 实时定量PCR(qRT-PCR)检测基因表达取对照组和实验组细胞,加入Trizol,使细胞完全裂解,采用Trizol法提取RNA。依照试剂盒说明书进行逆转录,逆转录条件:42 ℃ 60 min,65℃ 10 min,反应产物cDNA作为模板,PCR检测AURKA基因表达。PCR条件:94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,40 个循环;72 ℃ 5 min。GAPDH的引物序列:上游引物:5’-TGTGGGC ATCAATGGATTTGG-3’,下游引物:5’-ACACCAT GTATTCCGGGTCAAT-3’;AURKA的引物序列:上游引物:5’-CAGACTGGATACCGGGACC- 3’,下游引物:5’-CTTCAGCACGTTTTTGCACTG-3’;β-catenin的引物序列:上游引物:5’-AAAGCGG CTGTT AGTCACTGG-3’,下游引物:5’-CGAGTC ATTGCATACTGTCCAT-3’;N-cadherin上游引物:5’-TTTGATGGA GGTCTCCTAACACC-3’,下游引物:5’-ACGTTTAACACGTTGGAAATGTG-3’;E-cadherin上 游 引 物:5’-CG AGAGCTACAC GTTCACGG-3’,下游引物:5’-GGGTGTCGAGGG AAAAATAGG-3’;Twist上 游 引 物:5’-GC CTAGAGTTGCCGACTTATG-3’,下游引物:5’-TGCGTTTCCTGTTAAGGTAGC-3’; 以 GAPDH作为内参,按照2-△△Ct法进行计算分析。
1.6 Western blotting检测蛋白表达 取步骤1.3中的细胞,加入含PMSF的RIPA试剂提取蛋白,运用BCA法进行蛋白定量。每孔上样量为30 μg,以SDS-PAGE分离蛋白后,电转移至PVDF膜上,用含5%的脱脂奶粉的Tris-HCl缓冲液(TBST)室温封闭1 h,加入1:1000稀释的兔抗人AURKA多克隆IgG抗体、兔抗人β-catenin多克隆IgG抗体、兔抗人N-cadherin多克隆IgG抗体、兔抗人Twist多克隆IgG抗体、兔抗人E-cadherin多克隆IgG抗体和兔抗人GAPDH多克隆IgG抗体,4 ℃孵育过夜;PBST洗膜3次后,加入HRP标记的羊抗兔二抗(1:1000),室温孵育60 min;PBST洗膜3次后,加入化学发光试剂发光液后用成像仪显影。上述实验重复3次。
1.7 细胞周期检测 收集MLN8237或DMSO处理后的细胞,加入预冷的500 μ L 75%乙醇溶液,置于4 ℃冰箱中固定过夜,离心后弃去乙醇溶液,用PBS洗涤两次后收集细胞,加入300 μ L的碘化丙啶(propidium iodide,PI)溶液,避光染色20 min,弃去染液,PBS洗涤2次,置于流式细胞仪(美国,BD FACSCalibur)中,在488 nm波长下检测细胞周期分布情况。上述实验重复3次。
1.8 Transwell细胞侵袭实验测定细胞侵袭能力 在Transwell小室上层加入60 μ L Matrigel基质胶(按Matrigel:DMEM=1:2配置),将小室置于24孔板内于37 ℃培养箱内30 min待基质胶凝固,小室上层加入SGC-7901细胞(10×105个/mL),小室下层加入600 μ L含10%胎牛血清的DMEM培养基,培养箱内培养48 h后取出,弃去小室内细胞,用棉签轻轻擦掉基质胶和未穿过膜的细胞,用PBS洗涤后用结晶紫溶液染色5 min。100×显微镜下观察并记录细胞数量,取3个随机视野平均数为每组穿过小室的细胞数。上述实验重复3次。
1.9 平板克隆实验 各组细胞消化后进行细胞计数,转移至6孔板内,500个/孔,常规培养14 d。显微镜下观察克隆形成情况,除去培养基后用PBS清洗,每孔加入多聚甲醛1 mL固定细胞10min,除去固定液,加入结晶紫染色10 min,用PBS反复浸洗除去染液颜色,空气干燥,显微镜下观察并计数,大于50个细胞的细胞团计为一个克隆,克隆形成率(%)=(克隆数/500)×100%。上述实验重复3次。
1.10 统计学方法 应用SPSS17.0对数据进行统计学分析,计量资料采用均数±标准差示,采用方差分析方法和t检验对实验结果进行分析。P<0.05时认为差异具有显著性。
2 结果
2.1 MNL8237作用后的细胞增殖情况 运用MTT法确定MLN8237作用于SGC-7901的IC50为20 μmol/L。见图1A。同时检测MNL8237对胃癌细胞SGC-7901细胞生长的影响,绘制生长曲线,运用方差分析结果显示,实验组细胞生长速度较对照组明显减慢,提示MNL8237对胃癌细胞增殖有明显抑制作用(P<0.05)。见图1B。
2.2 各组细胞内AURKA和EMT相关基因和蛋白表达情况 相比于对照组(1.00±0.13),实验组细胞中AURKA(0.36±0.09)的mRNA水平明显降低,β-catenin(0.41±0.07)、N-cadherin(0.26±0.08)、Twist(0.33±0.12) 的 mRNA 水平降低,而 E-cadherin(4.05±0.96)的 mRNA水平上调,且两组之间的差异具有统计学意义(P<0.05)( 图 2)。Western blotting结 果 显示,MLN8237降低了SGC-7901细胞中AURKA、β-catenin、N-cadherin、Twist蛋白水平,增加了E-cadherin蛋白水平。结果进一步说明,MLN8237可以通过调控β-catenin来抑制胃癌细胞EMT过程。见图2。
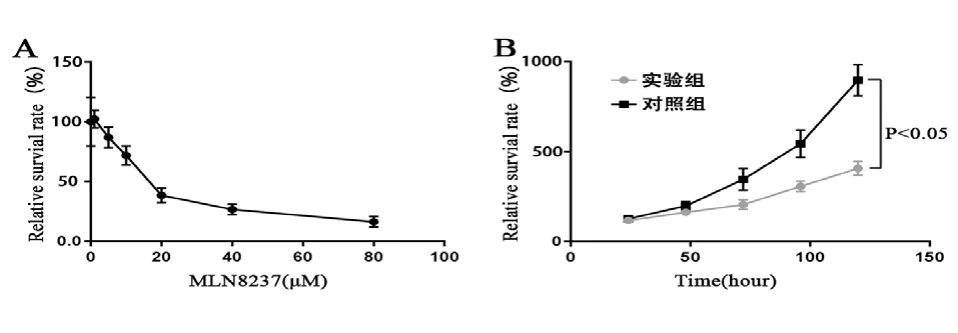
图1 MTT法检测的细胞增殖变化

图2 RT-PCR和Western blotting检测MLN8237对SGC-7901细胞内AURKA、β-catenin、N-cadherin、Twist、E-cadherin的mRNA和蛋白影响
2.3 MLN8237处理细胞后细胞周期分布情况 结果显示实验组与对照组相比出现了明显的细胞G2/M期阻滞(P<0.05)。见图3、表1。

图3 MLN8237处理后SGC-7901细胞出现G2/M期阻滞

表1 两组细胞周期分布比例情况
2.4 细胞侵袭转移能力 培养48 h后,对照组和实验组穿过基膜的细胞数量分别为(83.67±4.28)个和(28.33±3.82)个,表明MLN8237对胃癌细胞侵袭能力有较好的抑制作用(P<0.05)。见图4。细胞培养14 d后,对照组和实验组细胞克隆形成数分别为(417.00±7.25)个和(104.67±5.73)个,实验组细胞克隆形成数明显减少(P<0.05)。见图5。
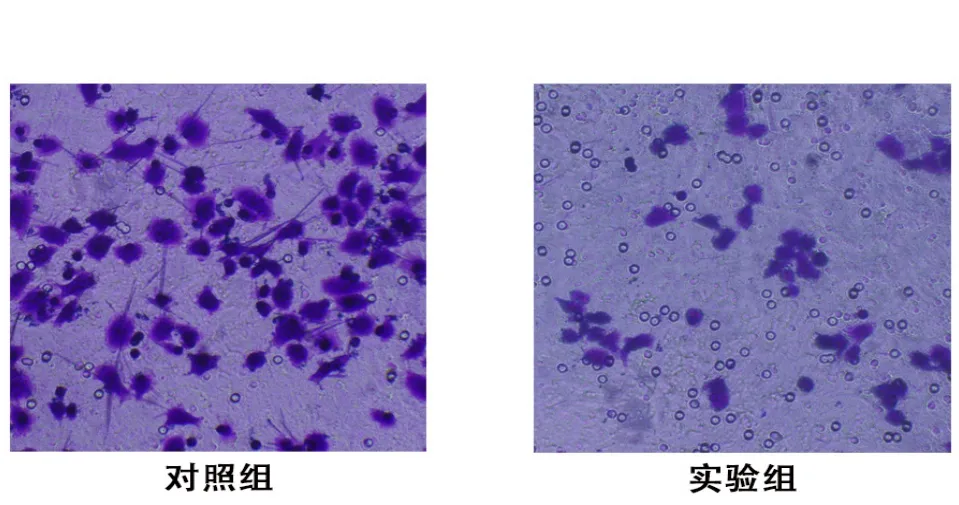
图4 MLN8237对胃癌细胞侵袭能力的影响

图5 MLN8237处理对胃癌细胞克隆形成的影响
3 讨论
AURKA的表达、活性水平及定位随着细胞周期的变化呈现一种周期性的动态过程,反映了AURKA参与有丝分裂过程中的一系列重要事件。在G1/S期,它的表达水平很低,但在G2期,AURKA的mRNA水平和蛋白活性水平迅速上调,并在有丝分裂早期达到峰值。随后AURKA水平一直维持在高水平,直到有丝分裂后期,APC/C开始启动AURKA的降解,在G1早期AURKA降解完成[9-10]。近年来研究发现,AURKA在细胞有丝分裂中具有调节中心体成熟和分离、调节细胞有丝分裂等生理功能,同时,这些功能也决定了其在维护正常细胞周期方面有着重要作用[3]。有研究表示,AURKA还可调节细胞从M期向G2期发展,通过干扰RNA的技术干扰AURKA的表达,从而促进细胞在G2/M期的阻滞并促进细胞的凋亡[11]。本研究结果表明,应用MLN8237能促进胃癌细胞出现G2/M期的阻滞,且增殖水平也明显受抑制,其机制可能与AURAK调节细胞有丝分裂有关。
AURKA的异常表达常见于各种肿瘤,目前已知在胃癌、结肠癌、食管癌、肝癌、乳腺癌、卵巢癌、胰腺癌[12]、肺癌[13]和神经胶质瘤[14]等多种人类肿瘤中发现AURKA的异常高表达,而且其扩增和高表达往往还与肿瘤的发生、发展以及预后密切相关。目前已经有将Aurora(极光)激酶作为治疗靶点开发特异性药物治疗肿瘤,第一代药物以VX-680为代表,与Aurora激酶的ATP结合位点结合,阻断其丝氨酸、苏氨酸激酶活性,使其固定在一种非活性构象状态。与pan-Aurora(泛极光)激酶抑制剂不同,MLN8237的第二代抑制剂是ATP竞争性的、可逆的AURKA特异性抑制剂,其对AURKA的敏感性是对AURKB敏感性的200倍。目前,将这些抑制剂用于晚期实体肿瘤和晚期血液肿瘤的治疗的多个I期临床试验已经开展[13]。ARUKA抑制剂在肿瘤治疗中的应用预示着AURKA将成为未来肿瘤治疗的关键靶点。
Wnt信号通路对控制胚胎发育起十分重要的作用,其异常可导致胚胎发育异常和细胞的恶性转化,近年来的研究表明,Wnt信号通路的异常与多种人类肿瘤的发生密切相关[15]。β-catenin是Wnt信号通路的核心成分,参与细胞粘连、生长、增殖等过程,细胞内β-catenin蛋白减少代表Wnt信号通路活性被抑制。本研究结果显示AURKA特异性抑制剂MLN8237的应用可以下调β-catenin的mRNA和蛋白水平,提示MLN8237的应用通过抑制β-catenin蛋白水平抑制胃癌细胞内Wnt信号通路活性,推测胃癌细胞中MLN8237通过影响Wnt信号通路调控胃癌细胞增殖和侵袭过程。
综上所述,MLN8237可以抑制胃癌细胞内AURKA的表达,并可以通过抑制Wnt信号通路从而抑制胃癌细胞内EMT和增殖侵袭。这为胃癌靶向治疗提供了新思路。

