N6-异戊烯基腺嘌呤与牛血清白蛋白的相互作用研究
叶桦珍,陈国南
(1. 福建卫生职业技术学院药学系,福建 福州 350101; 2. 福州大学化学学院,福建 福州 350108)
0 引言
N6-异戊烯基腺嘌呤 (N6-isopentenyl adenine,iP)用于调节农作物的生长, 是植物体内发挥主要功效的腺嘌呤型细胞分裂素之一[1]. 细胞分裂素结合蛋白已从多种植物中分离得到,它们可能在细胞分裂素的信号转导、 体内运输及代谢中起作用[2-3]. 近年来一些腺嘌呤型细胞分裂素及其衍生物被发现具有抗衰老及抗氧化等作用[3-4],在化妆品和分子医学领域具有一定的开发应用前景. 因而研究腺嘌呤型细胞分裂素与蛋白质的相互作用,有助于相关药物的药代动力学研究,对于细胞分裂素分子作用机理的研究也具有一定的参考意义.
荧光光谱法是研究小分子与蛋白质相互作用最有利的手段之一. 本研究发现,N6-异戊烯基腺嘌呤本身无荧光,但在pH=7.4的缓冲溶液中可明显猝灭牛血清白蛋白(bovine serum albumin,BSA)的内源性荧光. 基于这一猝灭现象,研究不同浓度的iP对BSA荧光光谱的影响,可获得iP对BSA荧光的猝灭类型、iP对BSA构象的影响、 二者间作用力类型、 表观结合常数和结合位点数等诸多相互作用信息.
1 实验部分
1.1 实验仪器与试剂
Lambda 750型紫外可见分光光度计 (美国Perkin Elmer公司); CARY Eclipse型荧光分光光度计 (美国Varian公司); N6-异戊烯基腺嘌呤(iP)(AR,美国Sigma公司); 牛血清白蛋白(BSA)(BR,国药集团化学试剂有限公司); 三羟甲基氨基甲烷(Tris)(GR, 国药集团化学试剂有限公司); 其他试剂均为分析纯,实验用水为新制超纯化水.
1.2 实验方法
荧光分光光度计扫描时激发光单色器与发射光单色器的狭缝均设为5 nm, 光电倍增管电压设为medium,扫描速率为600 nm·min-1; 紫外可见分光光度计狭缝宽度设为2 nm.
iP标准溶液与BSA标准溶液制备时分别以0.1 mol·L-1NaOH和二次蒸馏水为溶剂; 0.05 mol·L-1Tris-HCl-NaCl缓冲溶液中含有0.05 mol·L-1NaCl, 以浓HCl调节pH值为7.4.
按所需浓度移取一定量的iP标准溶液及BSA标准溶液于10 mL容量瓶中,以Tris-HCl-NaCl缓冲溶液定容得到测试用的混合溶液,于室温或置电热恒温水槽中放置30 min后,测定混合溶液的荧光激发光谱、 荧光发射光谱、 荧光同步扫描图谱及紫外可见吸收光谱. 以281 nm作为荧光激发波长,测得BSA在最大发射波长347 nm处的荧光强度记为F0,BSA与iP混合溶液在347 nm处的荧光强度记为F,根据实验数据及图谱的变化情况进行相互作用分析[5].
2 结果与讨论
2.1 iP对BSA荧光光谱的影响

图1 iP与BSA混合溶液体系的发射光谱Fig.1 Emission spectra of the mixed solution system of iP and BSA
iP本身无荧光,而BSA有明显的内源荧光. 以BSA的最大激发波长281 nm作为荧光体系的激发波长,在室温下测定不同浓度的iP与10 μmol·L-1BSA混合溶液体系的荧光发射光谱,测定结果如图1所示. 结果表明,混合溶液体系的荧光强度随着iP浓度的升高明显降低,但光谱的峰形及最大发射波长未发生显著改变,说明iP对BSA的荧光产生猝灭,两者之间发生了相互作用现象.
2.2 荧光猝灭类型的确定
荧光物质与猝灭剂之间可发生动态猝灭、 静态猝灭或动态与静态联合猝灭的作用. 若荧光猝灭基于猝灭剂和激发态荧光分子间发生了有效碰撞和电荷转移而发生,猝灭常数KSV随温度升高而增大,称为动态猝灭; 若荧光猝灭基于猝灭剂和处于基态的荧光物质发生反应生成不发光的复合物而使KSV随温度的升高而降低,则称为静态猝灭[6]. 研究猝灭类型有助于揭示猝灭剂和荧光物质间的作用机制. 本研究采用Stern-Volmer方程法和紫外可见吸收光谱法研究iP对BSA荧光的猝灭类型.
假设iP与BSA之间形成1∶1型的复合物,BSA的荧光强度F0与加入iP后BSA体系的荧光强度F的比值符合Stern-Volmer方程式[6]:F0/F=1+KSV·ciP,其中KSV为Stern-Volmer猝灭常数. 将BSA浓度固定为10 μmol·L-1,分别加入浓度为0、 5、 10、 20、 40、 60 μmol·L-1的iP,测定在不同反应温度下,混合溶液体系在347 nm处的荧光强度. 以F0/F为纵坐标、 iP浓度为横坐标绘制Stern-Volmer曲线,如图2所示,其相关方程如表1所示.
由表1和图2的结果可知,iP与BSA相互作用的Stern-Volmer曲线线性关系较好,随着温度的升高,曲线的斜率即猝灭常数KSV呈降低趋势. 据此可推断iP对BSA荧光的猝灭类型主要为静态猝灭,iP与BSA两者间形成了基态复合物.
静态猝灭常常引起荧光物质紫外可见吸收光谱的改变. 为验证对iP与BSA荧光猝灭类型的推断,在290 K的温度下,分别测定10 μmol·L-1BSA溶液 、 25 μmol·L-1iP溶液及两者混合溶液的紫外可见吸收光谱,并将BSA与iP叠加后的光谱与混合溶液的紫外可见吸收光谱进行比较,结果如图3所示. 由图3可见,混合溶液的紫外可见吸收光谱(曲线3)与叠加所得的光谱(曲线4)不重合,且最大吸收波长产生了一定程度的红移. 由此可推断混合溶液中产生了新的化合物,该结论与Stern-Volmer方程法得出的iP对BSA荧光猝灭的类型为静态猝灭的推断一致.

表1 iP与BSA荧光体系在不同温度下的Stern-Volmer 方程

图2 iP与BSA荧光体系在不同温度下的Stern-Volmer曲线Fig.2 Stern-Volmer plots of iP-BSA fluorescence system at different temperatures

图3 BSA、 iP及二者混合溶液的紫外可见吸收光谱Fig.3 UV-Vis spectra of BSA, iP and mixed solution of them
2.3 表观结合常数及结合位点数的计算
基于BSA与iP形成了基态复合物,可由公式lg[(F0-F)/F]= lgKa+nlgciP近似计算二者的表观结合常数和结合位点数,其中Ka为表观结合常数,n为结合位点数[7]. 以节2.2中所得的实验数据计算lg[(F0-F)/F],并以lgciP为自变量进行线性回归分析, 所得方程及不同温度下Ka及n的计算结果列于表2.

表2 不同温度下iP与BSA的结合常数及结合位点数
由表2结果可知,不同温度下测得的iP与BSA的结合位点数均约为1,说明二者的结合位点只有一个;Ka在290~302 K区间随着温度的升高而降低,原因是iP与BSA反应生成的基态复合物的稳定性会随着温度升高而降低,这一结果与以上iP对BSA的猝灭属于静态猝灭的推断相符合. 但从表2也可看出,温度为310 K时,Ka较302 K时明显增加,且由图2可看出310 K相应曲线上iP浓度高时Stern-Volmer曲线向Y轴偏离,这些现象说明在高温度与高浓度的条件下,由于分子运动的加剧及有效碰撞的分子数目增大,动态猝灭概率增加,体系的猝灭类型表现为动态与静态联合猝灭而使猝灭效果增强. 故测定蛋白质与小分子形成复合物的表观结合常数与结合位点数时,应考虑温度与浓度的影响.
2.4 分子间作用力类型的确定
生物大分子和小分子间存在氢键、 静电引力、 范德华力和疏水力等作用力,分子间作用力类型可通过一些热力学参数的求算来判别. 假设在290~302 K的温度范围内,iP与BSA反应的焓变ΔH无明显变化可视为常数,利用Van’t Hoff方程的推导公式lnKa=-ΔH/RT+ ΔS/R,即可求取反应体系的焓变ΔH和熵变ΔS,再利用公式ΔG=-RTlnKa可求取反应体系的自由能变化ΔG[8]. 其中T为开尔文温度,气体常数R值为8.314,计算结果列于表3. 对于小分子和蛋白质结合体系,如果求得的热力学参数ΔH<0且ΔS<0,则两者之间的作用力主要为氢键或范德华力; 若ΔH<0且ΔS>0,则两者之间的作用力主要为静电引力; 若ΔS>0且ΔH>0,则两者之间作用力主要为疏水力; 若ΔG<0,说明反应是自发进行的[9]. 由表3数据结合以上判据可知,iP与BSA之间的作用力主要为氢键或范德华力,两者的反应是自发进行的.
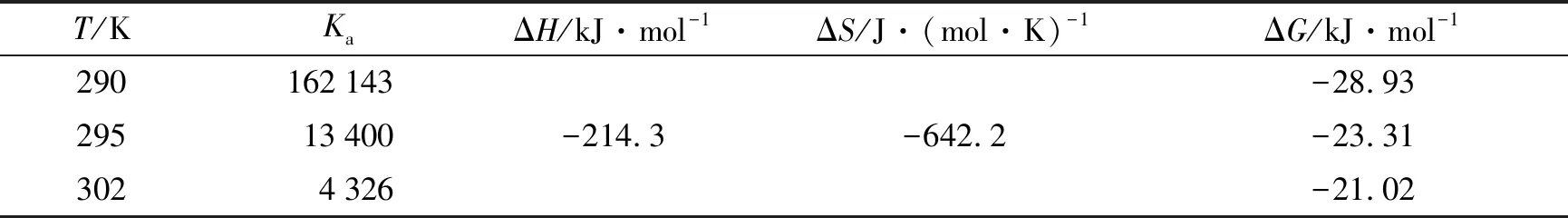
表3 iP与BSA相互作用体系的热力学常数
2.5 iP对BSA构象的影响
荧光同步扫描技术常用于研究小分子与蛋白质的相互作用. 对于BSA的同步扫描荧光光谱,波长差Δλ为60 nm和15 nm时扫描获得的荧光同步扫描光谱分别显示色氨酸残基和酪氨酸残基的光谱特征,荧光同步扫描光谱蓝移表明氨基酸所处环境的疏水性增加,红移则表明极性增加[7].
室温下, 分别测定在10 μmol·L-1BSA中加入不同浓度iP后,Δλ为60 nm和15 nm时的同步扫描荧光谱图,结果如图4所示. 图4(a)、 (b)的同步扫描荧光图谱均显示,随着iP浓度升高,荧光强度下降且峰位红移. 由此可以推断iP与BSA的结合改变了BSA的构象以及色氨酸与酪氨酸残基所处的环境,使这两个可发荧光的基团所处环境的极性增大.

图4 iP与BSA混合溶液体系的同步扫描荧光光谱Fig.4 Synchronous scanning fluorescence spectra of mixed solution system of iP and BSA
有研究表明,芳香族小分子与血清白蛋白的结合位置一般在亚结构域IIA和IIIA处[7],而BSA分子中的两个色氨酸残基分别位于IIA的212位和亚结构域IB的134位[10-11]. 由节2.3结果可知,iP与BSA的结合部位仅有一个,故可进一步推断该结合部位靠近IIA亚结构域212位上的色氨酸, iP与BSA的结合微扰了IIA亚结构域疏水腔结构,致色氨酸残基所处环境的极性增加, 相应的荧光减弱.
3 结语
本研究应用荧光光谱法和紫外可见吸收光谱法考察了N6-异戊烯基腺嘌呤与牛血清白蛋白的相互作用. 确定了在低温时二者通过氢键或范德华力结合生成1∶1的基态复合物,荧光猝灭类型为静态猝灭,结合部位靠近BSA的IIA亚结构域上的112位色氨酸. 该研究对于揭示腺嘌呤型细胞分裂素分子作用机理和进行相关药物的研发具有一定的参考意义.

