藏红花素抑制过氧化氢诱导的视网膜色素上皮细胞凋亡
李姚,王健
年龄相关性黄斑变性 (age-related macular degeneration,AMD)属于视网膜退行性疾病,该病病理学发生基础为视网膜色素上皮 (retina pigment epithelium,RPE)细胞[1]。RPE 细胞为单层柱状细胞,容易受到周围环境影响,RPE细胞损伤后可引起光感受器变性、视网膜变薄[2]。藏红花素(Crocin)是从藏红花植物茎中提取的单体化合物,具有抗氧化、抑制炎症反应、保护神经细胞等作用[3]。已有学者将其应用于眼部,发现藏红花素能提高视网膜抗氧化能力、抑制视网膜神经节细胞凋亡、改善视网膜微循环的作用[4]。本文拟通过采用体外高氧条件下培养RPE细胞,初步探讨藏红花素对H2O2诱导的RPE细胞凋亡的影响及可能机制。
1 材料与方法
1.1 材料
RPE细胞 (美国ATCC公司),藏红花素(美国Sigma 公司,纯度>99%),二甲基亚砜、H2O2(北京索莱宝科技有限公司),胎牛血清(fetal bovine serum,FBS,杭州四季青公司)、MTT试剂盒(江苏凯基生物技术股份有限公司),Annexin-V/PI试剂盒及H2DCFDA荧光探针 (美国BD公司),Bcl-2及Bax抗体(上海碧云天公司)。
1.2 RPE细胞培养及分组
RPE细胞培养 将RPE细胞置于DMEM培养基中,内含10%胎牛血清,青霉素100 U/mL、链霉素100 μg/mL,培养箱内温度为37℃,CO2体积分数为5%,每3 d传代1次,取对数期生长的细胞进行实验。
RPE细胞分组 细胞接种于96孔板中,共分4组,每组5个复孔。(1)对照组:以正常培养液培养。(2)氧化损伤组:培养液内 H2O2浓度为 300 μmol·L-1。(3)藏红花素组:加入藏红花素作用 24 h之后,加入300 μmol·L-1H2O2溶液作用 12 h,依藏红花素浓度不同分为 2 个亚组 (10 μmol·L-1及 100 μmol·L-1)。
1.3 MTT法测定细胞增殖
RPE细胞接种于96孔板中,每孔200 μL,细胞密度为1×104个/L,向各孔细胞中加入10 μLMTT(5 g·L-1),4 h 后吸出上清液, 加入 100 μL DMSO溶液,轻微振荡10 min后测定各孔570 nm的光密度值(OD)。细胞增殖率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
1.4 流式细胞技术检测RPE细胞内活性氧(ROS)表达
RPE细胞接种于6孔培养板,0.1%胰酶 (不含EDTA)消化各组细胞后制备细胞悬液。1000 r/min离心后收集细胞,加入5 μL H2DCFDA染料后置于暗室内避光反应15 min,流式细胞仪检测细胞内ROS表达量变化。
1.5 Annexin V/PI流式检测细胞凋亡
0.1%胰酶(不含EDTA)消化各组细胞后制备细胞悬液。1000 r/min离心后收集细胞,分别加入5 μL Annexin-V 和10 μL PI染料后充分混匀避光反应15 min,于1 h内用流式细胞仪检测细胞凋亡。
1.6 Western blot法检测RPE细胞内Caspase-3及Caspase-9的蛋白表达
提取蛋白质后上样,电泳,聚偏氟乙烯膜转膜后,质量分数为5%的脱脂奶粉封闭12 h,加入相应抗体,ECL化学发光法自显影,用Bio-Rad Quantity One软件分析电泳结果。
1.7 统计学方法
采用SPSS17.0进行统计学处理,计量资料结果采用均数±标准差)表示,两两组间比较采用LSD-t检验,各处理组组间比较采用两因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度藏红花素对RPE细胞活力的影响
MTT法检测结果显示(表1),对照组RPE细胞存活率为98.33%±4.90%,氧化损伤组RPE细胞存活率为43.12%±3.39%,与对照组比较差异有统计学意义(F=48.08,P<0.05),不同浓度藏红花素干预后,RPE细胞存活率分别提高到61.76%±4.76%和77.67%±4.43%,与氧化损伤组比较差异均有统计学意义(F低=40.89,F高=90.33,均 P<0.05)。
表1 MTT法检测藏红花素对H2O2诱导的RPE细胞存活率的影响(

表1 MTT法检测藏红花素对H2O2诱导的RPE细胞存活率的影响(
注:*与对照组比较,P<0.05;#与氧化损伤组比较,P<0.05
?
2.2 RPE细胞内ROS改变
流式细胞技术结果显示,氧化损伤组RPE细胞内DCF荧光信号明显增强,表明细胞氧化损伤严重,不同浓度藏红花素干预后,DCF荧光信号强度逐渐减弱,表明藏红花素抑制了细胞内ROS生成,改变了RPE细胞内的氧化应激状态(图1)。
2.3 藏红花素抑制H2O2诱导的RPE细胞凋亡
流式细胞仪的检测结果表明,与对照组(4.33%±2.50%)比较,氧化损伤组RPE细胞凋亡率明显升高(F=89.02,P<0.05),随着藏红花素作用浓度的递增,H2O2诱导的 RPE 细胞凋亡率呈剂量(10 μmol·L-1及 100 μmol·L-1)依赖性递减(39.00%±3.77%、18.00%±3.80%),与氧化损伤组比较差异均有统计学意义(F低=192.40,F高=95.76,均 P<0.05)。 (表 2、图 2)
2.4 藏红花素抑制H2O2诱导的线粒体凋亡信号通路的影响
与对照组相比,H2O2抑制RPE细胞中抗信号分子Bcl-2的表达,促进RPE细胞中促凋亡信号分子Bax的表达。经过藏红花素处理后,Bcl-2的表达升高,Bax 的表达下降(图 3、图 4)。
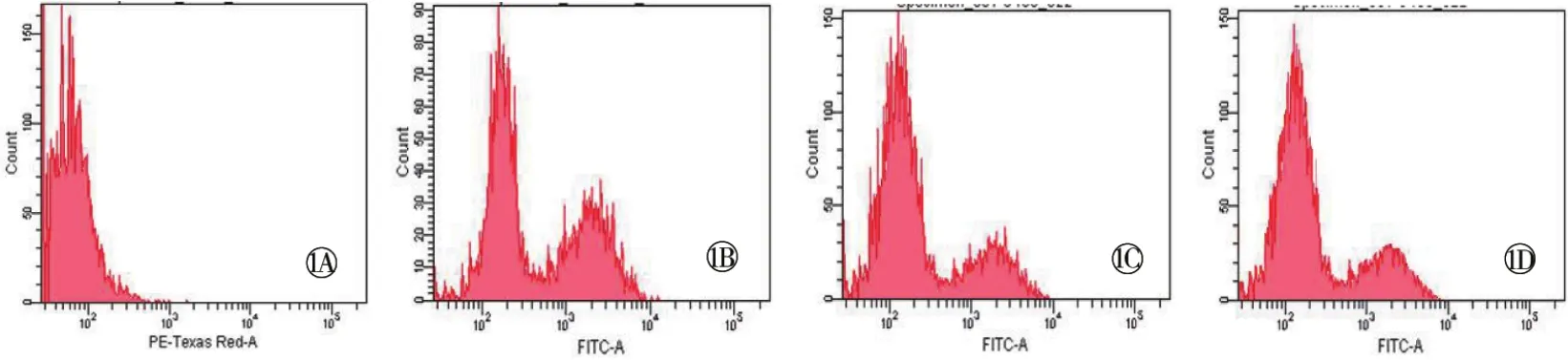
图1 流式细胞技术检测RPE细胞内ROS改变。1A 对照组;1B 氧化损伤组;1C 藏红花素低浓度组;1D 藏红花素高浓度组

图2 藏红花素对H2O2诱导RPE细胞凋亡影响。2A 对照组;2B 氧化损伤组;2C 藏红花素低浓度组;2D 藏红花素高浓度组
3 讨论
视网膜特别容易受到氧化损伤影响,高浓度的多不饱和脂肪酸、持续的光照及密集的氧代谢产物促进了视网膜内细胞内活性氧(ROS)的生成[5]。体外补充抗氧化剂来维持视网膜的功能不失为一种防治视网膜氧化应激损伤的有效方法。藏红花素分子式为C44H64O24,分子量为977.21 kD,抗氧化作用明显。现代药理学研究表明,藏红花素具有保护神经细胞功能、降低胰岛素抵抗、抑制肿瘤细胞增殖、治疗慢性胃病、预防心血管疾病发生的功效[6-7]。近年来,一些学者将藏红花素应用于体外培养的视网膜血管内皮细胞和视网膜神经节细胞,均显示了藏红花素有效的清除羟自由基、超氧自由基及抗凋亡作用。郭斌[4]发现藏红花素通过抑制糖基化终产物诱导的视网膜微血管内皮细胞中ROS的表达,保护视网膜微血管内皮细胞。吕伯昌[8]认为藏红花素能有效抑制视网膜神经节细胞凋亡,其作用机制与影响Ca2+内流有关。
本实验中,我们使用 300 μmol·L-1H2O2建立了RPE细胞氧化应激模型,观查藏红花素对RPE细胞的保护作用。 结果显示,300 μmol·L-1H2O2引起RPE 细胞活力降低,10 μmol·L-1及 100 μmol·L-1藏红花素作用于RPE细胞后,RPE细胞增殖率随藏红花素浓度的升高而升高,证实了藏红花素对RPE的保护作用。
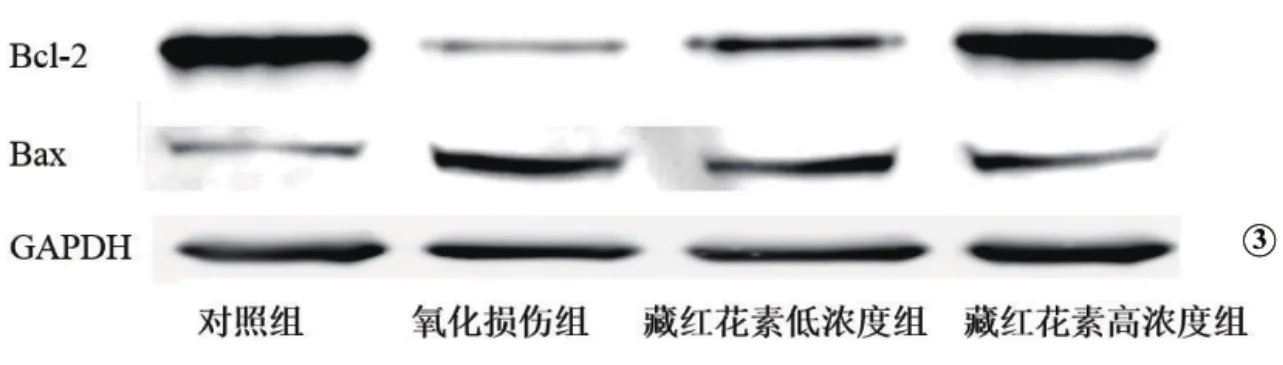
图3 藏红花素对RPE细胞内Bcl-2及Bax表达的影响(电泳图)
表2 流式细胞仪检测藏红花素对H2O2诱导的RPE细胞凋亡率的影响(
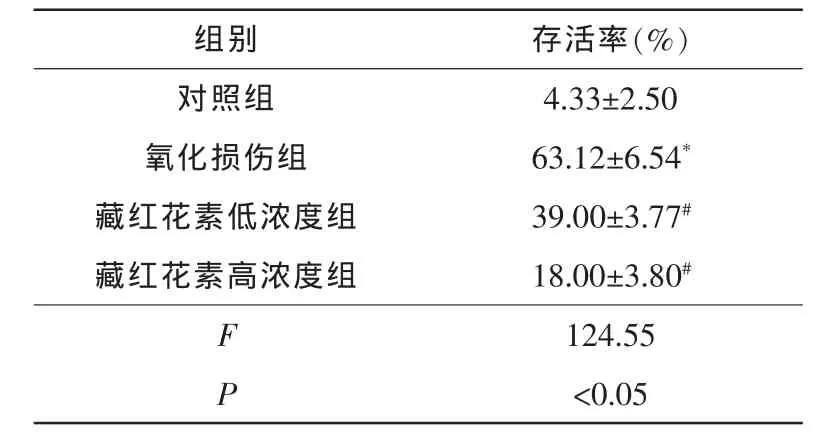
表2 流式细胞仪检测藏红花素对H2O2诱导的RPE细胞凋亡率的影响(
注:*与对照组比较,P<0.05;#与氧化损伤组比较,P<0.05
?
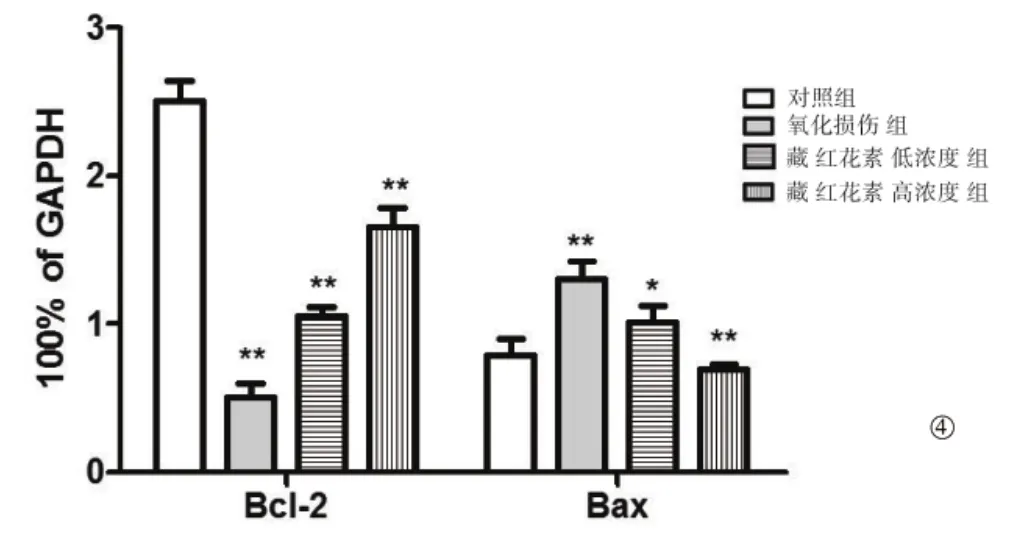
图4 藏红花素对RPE细胞内Bcl-2及Bax表达的影响
氧化应激在AMD发生发展中发挥重要作用,H2O2生成的ROS导致蛋白质降解和上皮细胞损伤,与AMD发生机制相似[9-10]。本实验中,我们使用流式细胞仪分别检测了细胞内ROS生成量及细胞凋亡率,结果表明,H2O2促进了RPE细胞内ROS的生成和细胞凋亡,藏红花素可以剂量依赖性的RPE细胞氧化应激损伤。
Bcl-2及Bax均属于细胞内线粒体凋亡信号通路中的信号分子。其中,Bcl-2为抗凋亡蛋白,通过阻止细胞色素C的释放抑制凋亡;Bax为促凋亡蛋白,通过诱导细胞色素C的释放促进凋亡[11]。Western blot结果显示,H2O2抑制RPE细胞中抗信号分子Bcl-2的表达,促进凋亡信号分子Bax的表达,经过藏红花素处理后,Bcl-2的表达升高,Bax的表达下降,进一步说明藏红花素能够有效抑制H2O2诱导的RPE细胞凋亡。
总之,本研究初步证实藏红花素对氧化应激环境下RPE细胞的保护作用,为今后预防和治疗视网膜退行性疾病提供了一定方向。

