羊源芽孢纤维素降解菌的筛选与H-7 菌株鉴定
高双喜 王 萱 任 菁 李 妍 周国玺 郝庆红 李 玘 郭云霞*
(1.河北农业大学生命科学学院,河北保定071001;2.张家口市动物卫生监督所,河北张家口075000)
由于草场退化、国家禁牧政策的实施,养羊方式由放牧转向舍饲养殖,使养羊成本大幅度提升,其中饲料成本占养殖成本的80%,而粗饲料占比为全混和日粮的40%,保证绵羊最佳的生长性能[1]。因此,如何降低粗饲料成本,提高养殖效益,是解决目前饲料成本高的关键。发展微贮饲料提高粗饲料品质,可在一定程度上缓解我国饲料供应短缺问题,同时解决冬季干草养分不足、适口性差等。我国秸秆储备丰富,每年产农作物秸秆近7亿吨,主要由多聚葡萄糖(纤维素、半纤维素)和木质素组成。由于纤维素是由β-1,4糖苷键连接多个β-D-吡喃葡萄糖环而形成的线性、不溶于水的高分子聚合物,在自然情况下很难降解[2]。酶解法具有操作简单、无污染、能耗少等优点[3],当饲喂饲用纤维素酶后可显著提高湖羊瘤胃菌群的多样性和丰度,影响瘤胃菌群结构[4],但目前酶法水解普遍成本高、酶解周期长的缺点。因此高效纤维素酶产生菌的筛选具有重要意义。
反刍动物拥有大容积的瘤胃,其内含有丰富的细菌、真菌和原虫等微生物,是粗饲料消化和营养物质吸收利用的主要场所,饲料会影响瘤胃的发酵模式,进而影响瘤胃微生物区系[5]。本着同源性原则,由羊瘤胃液中分离筛选可降解纤维素的芽孢菌株,以期为青贮菌剂的开发,提升粗饲料品质,降低饲料成本及其在畜牧生产上的应用提供工业化菌株。
1 材料和方法
1.1 样品制备
2017 年4 月,从河北农业大学实习基地,采集健康黑头杜泊羊的瘤胃液,四层纱布过滤,装入三角瓶中,冷藏备用。
1.2 培养基及主要溶液
种子培养基:氯化钠5 g/l,牛肉膏5 g/l,蛋白胨10 g/l。
发酵培养基:CMC-Na 10 g/l,(NH4)2SO42 g/l,氯化钠0.5 g/l,磷酸氢二钾1 g/l,7 水合硫酸镁0.5 g/l,刚果红0.4 g/l,琼脂12 g/l,pH值自然。
纤维素刚果红培养基:CMC-Na 2 g/l,(NH4)2SO42 g/l,氯化钠0.5 g/l,磷酸氢二钾1 g/l,7 水合硫酸镁0.5 g/l,刚果红0.4 g/l,琼脂12 g/l,pH值自然。
滤纸条崩解培养基:(NH4)2SO41.0 g/l,7水合硫酸镁0.5 g/l,磷酸二氢钾1.0 g/l,酵母膏0.1 g/l,滤纸条(1 cm×6 cm)3条/三角瓶,pH值自然。
西蒙氏枸橼酸盐、鸟氨酸脱羧酶、明胶、接触酶、淀粉水解等生理生化鉴定用培养基购自北京路桥技术有限公司。
2 试验方法
2.1 芽孢杆菌初筛
从健康羊瘤胃中取1 ml 瘤胃液于100 ml 容量瓶中,用无菌水定容制成菌悬液,80 ℃水浴10 min,室温取上清液1 ml于种子培养基中,37 ℃、180 r/min震荡培养12 h后,取1 ml发酵液于9 ml无菌水的试管中,进行梯度稀释,分别取10-4、10-5、10-6稀释液200 μl涂布到纤维素刚果红培养基平板,置于37 ℃恒温箱培养24 h。分别挑取不同形态的菌落在固体发酵培养基上划线接种,并做好标记,4 ℃保存。
将筛选出的不同形态的单菌落分别于纤维素刚果红培养基上进行打孔,打孔直径为0.65 cm,37 ℃恒温培养观察产生透明圈的大小,并用直尺进行测量。选出菌圈直径较大的菌株进行复筛。
2.2 芽孢杆菌复筛
2.2.1 葡萄糖标准曲线的制作
将葡萄糖烘干至恒重后配制成1 mg/ml的葡萄糖标准液。将4 ml 离心管分别标号为0~6,按表1 顺序加入相应试剂,并混匀,各管混合物沸水浴10 min,待冷却至室温,各吸取200 μl至96孔酶标板中,用酶标仪490 nm进行测定,并平行操作。以葡萄糖浓度为横坐标,吸光值为纵坐标,绘制葡萄糖标准曲线(见图1)。

表1 葡萄糖标准液
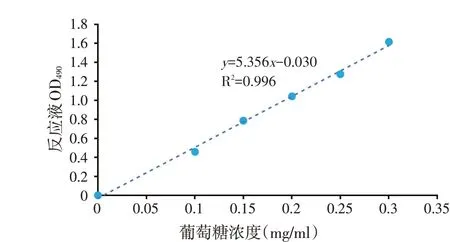
图1 标准曲线
2.2.2 纤维素酶(CMC)酶活测定
将纤维素酶酶活较高的菌株分别接种于纤维素种子培养液中,37 ℃摇床,180 r/min培养12 h,以2 %的接种量接种于发酵培养基中37 ℃、180 r/min 震荡培养18 h,得发酵液。
取3 支带有50 ml 刻度的试管,1 支管作空白对照,2 支管作平行样品管。取4 ml 发酵培养液于4 个1.5 ml EP管中,12 000 r/min,4 ℃离心15 min,分别取上清混匀后作为粗酶液,加热煮沸后的粗酶液为空白对照。以4 ml 0.5%(w/v)的CMC-Na 溶液(pH值5.0)作为反应底物。体系按照表2反应完后沸水浴5 min。

表2 纤维素酶反应体系
反应完的体系用蒸馏水定容至40 ml,取出200 μl加至96孔酶标板上,用酶标仪测定490 nm下的吸光度。
酶活单位定义为:在pH值5.0和50 ℃的反应条件下,1 min 1 ml粗酶液催化CMC-Na产成1 μmol葡萄糖所需的酶量为一个酶活单位(U/l)。
X=(A×v×1 000)/(M×V×T)
式中:X——钝顶螺旋藻对(U/ml);
A——根据标准曲线计算的葡萄糖含量(mg/ml);
v——反应液总体积(ml);
M——葡萄糖摩尔质量(180.2 g/mol);
V——反应中加入的粗酶液体积(ml);
T——反应时间(min)。
2.2.3 滤纸糖化酶(FPA)的测定
取3 支带有50 ml 刻度的试管,1 支作空白对照,2 支作平行样品管。取4 ml 发酵20 h 培养液平均分装于4 个1.5 ml EP 管中。然后12 000 r/min,4 ℃离心15 min。分别取上清混匀后的粗酶液,加热煮沸后的粗酶液为空白对照。将滤纸剪成规格为1.0 cm×6.0 cm的长条,放入试管中,置于50 ℃水浴锅中预热2 min。以4 ml 缓冲液为反应介质。体系按照表3 反应完后沸水浴5 min。其余同CMC酶活测定方法。

表3 滤纸酶反应体系
2.3 滤纸条崩解试验
将菌圈直径较大的菌株制成菌悬液,取1 ml置于装有50 ml 滤纸条崩解培养基中,37 ℃,180 r/min 震荡培养,每隔12 h定期观察滤纸条崩解情况。
2.4 菌株的生理生化鉴定
用平板划线获得H-7的单菌落,观察并记录菌落形态学特征。菌体染色,在显微镜下观察菌体形态。针对菌属参考《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》对目的菌株进行生理生化特征试验。
2.5 16S rDNA序列分析
取对数生长期菌株的发酵液(培养12 h)1 000 μl至EP管中,5 000 r/min离心5 min,弃上清,无菌水洗涤沉淀,重复两次。用400 μl TE重悬菌体,加入20 μl溶菌酶37 ℃过夜;加入400 μl CTAB 提取液,轻轻摇匀,65 ℃水浴40 min(每10 min 轻摇一次);冷却至室温,加400 μl 酚-氯仿(1∶1),轻轻摇匀,4 ℃,12 000 r/min离心10 min;吸取上清液,加入400 μl氯仿,轻轻摇匀,4 ℃12 000 r/min 离心10 min;吸取上清液,加入等体积冰冻异丙醇,轻轻摇匀,-20 ℃静置30 min,沉淀DNA,4 ℃12 000 r/min 离心20 min,弃水相,75%乙醇洗涤两次,风干;200 μl TE溶解沉淀,加入20 μl RNA 酶(20 mg/ml)37 ℃保温30 min 以等体积的酚-氯仿和氯仿各抽提一次;吸取上清液,加入10-1体积3 mol/l NaAc 和两倍体积的无水乙醇,轻轻摇匀至出现絮状沉淀试验,1 000 r/min 离心30 min;弃上清,用75 %乙醇洗涤DNA沉淀2次,风干。作为制作PCR 体系的模板。无菌条件下配置25 μl PCR体系,混匀。
PCR体系:mix 12.5 μl,27 F 0.5 μl,1492 0.5 μl,ddH2O 11 μl,模板0.5 μl。
PCR 程序:94 ℃3 min,94 ℃30 s,58 ℃30 s,72 ℃1.5 min,32个循环后,4 ℃保存。
产物于-20 ℃保藏。送华大基因测序,利用标准菌与得到的序列在EzTaxon server 2.1 的网站上进行比对,并用MEGA 5.0软件构建系统发育树,确定菌株种属。
3 试验结果
3.1 菌株的初筛
将分离纯化后得到的芽孢细菌,接种于打孔的纤维素刚果红培养基进行培养,筛选得到透明圈直径较大的9 株细菌,其中H-7 透明圈最大。结果见表4、图2。
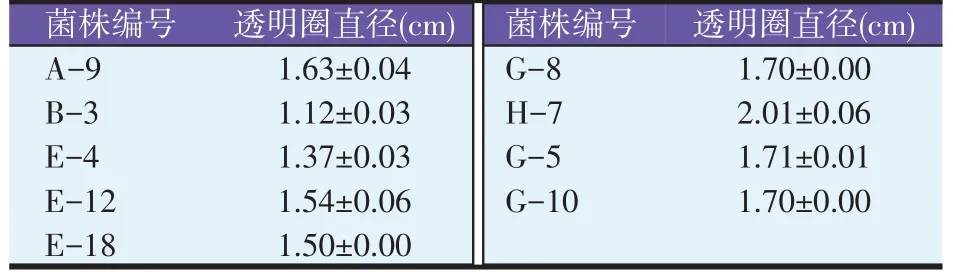
表4 初筛打孔透明圈直径结果

图2 H-7刚果红平板试验
3.2 菌株酶活测定
通过纤维素酶和滤纸酶酶活测定,其中E-12 与H-7 两株菌的纤维素酶酶活相对较高,分别为:0.17 U/ml与0.18 U/ml。滤纸酶酶活相对较高为E-12和H-7菌株。

表5 纤维素酶酶活与滤纸酶酶活
3.3 滤纸条崩解试验
将酶活较高的4 株菌株18 h 的发酵液,按2%接种量接种于含有滤纸条的液体培养基中,每隔12 h观察滤纸条崩解情况,结果见表6。崩解试验结果见图3 和图4。结果显示H-7 的崩解效果最好。综合考虑刚果红羧甲基纤维素钠培养基中菌落透明圈直径,酶活和滤纸条崩解结果,对菌株H-7 进行后续鉴定。

表6 滤纸条崩解试验结果

图3 滤纸条崩解初始
3.4 菌株鉴定
3.4.1 菌株的形态特征及生理生化特征
菌株H-7的菌落较大且呈现出不透明的乳白色,边缘不规则,且菌落表面粗糙,存在皱褶,如图5。芽孢形态为杆状芽孢。H-7 生理生化特征研究结果表明,该菌为革兰氏阳性菌,兼性厌氧,具体特征如表7所示。

图4 滤纸条完全崩解
3.4.2 系统发育树构建
将克隆得到的纤维素降解菌株H-7的16S r DNA序列经测序,在NCBI 数据库中进行BLAST 搜索和与标准芽孢杆菌属(Bacillus)的基因序列比对,结果显示,一致性均大于97%(见表8)。因此,判定该菌株为芽孢杆菌属。使用MEGA 5.0软件构建了系统发育树(见图6)。

图5 菌落形态

表7 H-7菌株生理生化试验
由系统发育树表明,在以上12 个菌株中,菌株H-7 与Bacillus siamensis(AJVF01000043)菌株同源性达99 %以上,因此初步断定H-7 为暹罗芽孢杆菌。

表8 H-7与标准菌相似度

图6 系统发育树
4 讨论
自然界中产纤维素酶微生物种类很广,包括真菌、细菌和放线菌。一般真菌产生的纤维素酶酶活比细菌高,但细菌具有发酵产酶时间短、产纤维素酶使用范围广等优点。芽孢杆菌具有促进肠道分泌消化酶,提高机体消化吸收能力及增强免疫力作用[6-7]。研究报道,在瘤胃中发现,苏云金芽孢杆菌、巨大芽孢杆菌和蜡样芽孢杆菌[8]及短小芽孢杆菌、枯草芽孢杆菌[9]均可产纤维素酶,但是酶活报道不一,且主要以纤维素酶(CMC)的活性为指标,如郭爱莲等[10]从牛瘤胃及其粪便中分离到了兼性厌氧芽孢杆菌,其中CMC 酶活达到了780 U/ml。牛明芬等[11]从牛粪中分离得到了地衣芽孢杆菌,CMC 酶活达到了1.031 U/ml。酶活力的不同与菌株的种属及纤维素酶的组成有关。纤维素酶是多组分酶,包括葡聚糖内切酶、葡聚糖外切酶、β-葡萄糖苷酶等。CMC 从纤维素的非还原多聚体末端,随机水解β-1,4糖苷键,每次切下1个纤维二糖分子,将天然纤维素分解为直链纤维素,产生大量的还原性末端。FPA则代表纤维素酶组分的总活力,反映了3类酶组分的协同作用[12]。本研究以羧甲基纤维素钠为唯一碳源的培养基上筛选出1株产纤维素酶酶活和滤纸酶酶活较高的芽孢细菌Bacillus siamensis H-7,在筛选培养基中CMC 酶活达到0.18 U/ml,FPA酶活达到0.44 U/ml。对于暹罗芽孢杆菌的研究报道较多,主要在抗菌活性[13]、产纤溶酶[14]、产蛋白酶[15]等起作用。本试验结果,证实暹罗芽孢杆菌(Bacillus siamensis)具有产纤维素酶的活性,为该菌的进一步应用提供了广泛的空间。
本研究从黑头杜泊羊瘤胃中首次筛选到暹罗芽孢杆菌(Bacillus siamensis)H-7,并证实其有较高的纤维素酶酶活,研究结果补充了暹罗芽孢杆菌的生物学功能。另外,试验所用菌株来源于羊瘤胃,对饲料的后续饲喂提供了安全保障,以期能够更好地利用秸秆产生高品质饲料。
纤维素是自然界中含量最为丰富的碳水化合物,是一类十分重要的可再生资源,但由于其不易被降解,利用率低,造成了极严重的资源浪费和环境污染问题。当前,人们利用自然界中能够分泌纤维素降解酶的微生物有效破坏纤维素的结构,以期有效开发与利用纤维素资源。目前已应用于多领域,例如将其作为能源、食品和化工产业的原料,生产乙醇、乳酸和单细胞蛋白等;用于地区农业生态系统土壤肥力的调节以及自然生态系统的修复与强化;堆肥过程中利用微生物提高纤维素和半纤维素的降解率、缩短发酵周期、提高腐熟和堆肥质量;养殖行业中,降解秸秆来提高秸秆等粗饲料的利用率。虽然利用微生物降解纤维素提高了资源的利用率,但目前市售菌株存在产酶活性不稳定,单一菌株降解率低,低温环境降解效果差等问题。因此,今后应多致力于产纤维素酶低温菌株、复合纤维素降解菌的开发与利用等,以期能在低温自然环境中降低生产成本、更加节约资源,提高秸秆等粗饲料的利用率,增加养殖效益。

