实例分析价键理论在配合物构型判断中的应用
张晓红 张海滨
(1.江苏省南通中学 226001;2.江苏省南通职业大学 226001)
张海滨,本科,硕士,从事化学教学研究.
配位化合物(简称配合物)近几十年来的发展十分迅速,它是化合物的一个重要子类别,也是近代无机化学的重要研究对象,广泛应用于工业、农业、科技等领域.作为科学前沿的热点研究对象,配合物的相关知识尤其是配离子的构型判断,在高中化学试题特别是竞赛试题中常常出现.鉴于高中化学教材关于配合物的教学要求较低,不能满足部分学生对配合物构型进一步认识的需求,而大学化学教材关于配合物的教学内容又超出高中生的认知水平,所以笔者整合了两部分教材相关内容,通过价键理论分析中学化学中常见配合物的构型,供大家参考.
一、价键理论
L.Pauling等人在20世纪30年代初提出了杂化轨道理论,首先用此理论来处理配合物的形成、配合物的几何构型等问题,建立了配合物的价键理论,价键理论的基本内容如下.
1.配合物的中心体M与配体L之间的结合,一般是靠配体单方面提供孤对电子对与M共用,形成配位键(M←∶L),这种键的本质是共价性质的,称为σ配键.形成配位键的必要条件是配体L至少含有一对孤对电子对,而中心体M必须有空的价轨道.
2.在形成配合物(或配离子)时,中心原子(或离子)提供的空轨道必须先由能量相近的轨道进行杂化,杂化前后轨道数目和总能量不变,杂化后轨道的能量和空间分布均一化,使成键能力增强.
3.中心原子(或离子)的价电子构型与配体的种类和数目共同决定杂化类型,而杂化类型决定配合物的空间构型、相对稳定性等.
二、实例分析
1.配位数为2的配合物
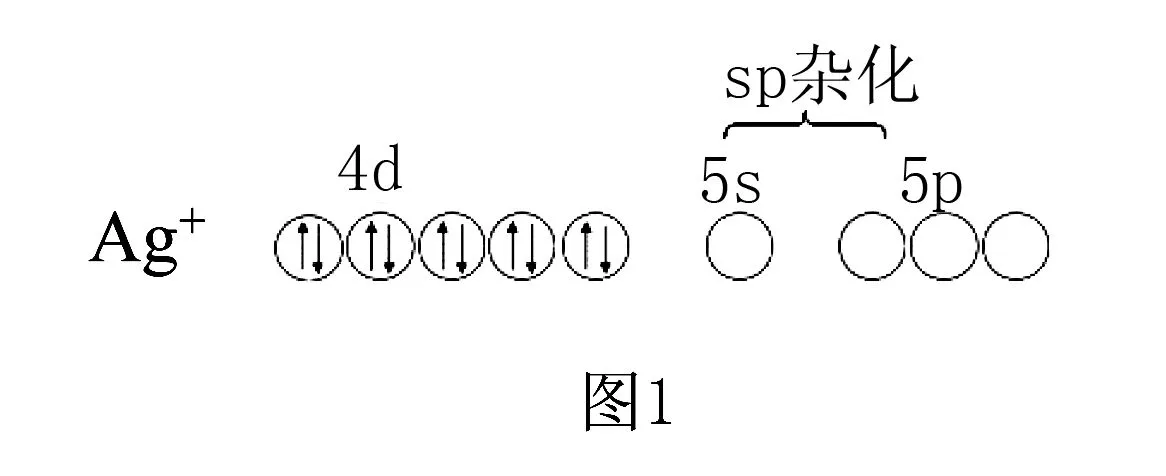
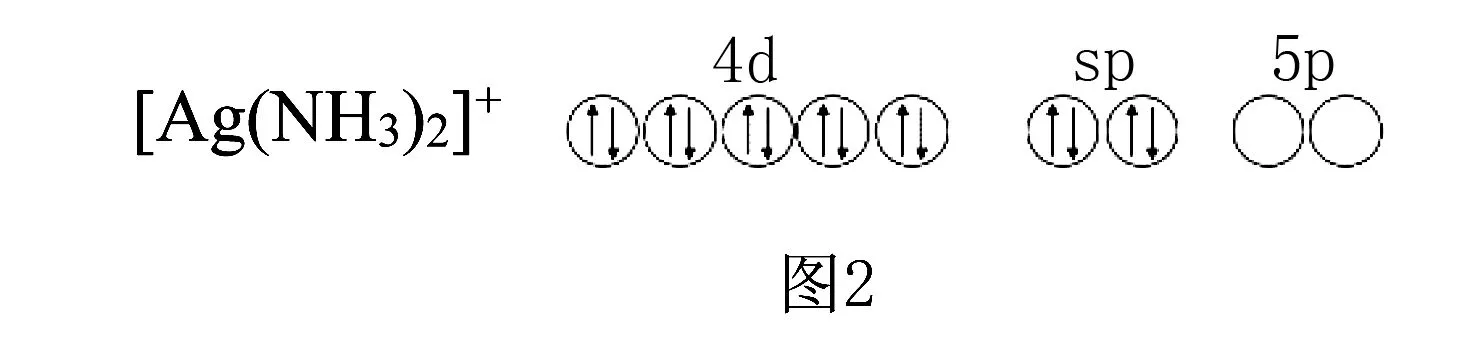
如二氨合银(Ⅰ)配离子([Ag(NH3)2]+),Ag+的价电子为4d10,提供5s和1个5p空轨道,发生sp杂化,接受2个NH3分子中的N提供的孤对电子对,配离子构型为直线形.
2.配位数为3的配合物
如三氯合铜(Ⅰ)配离子([CuCl3]2-),Cu+的价电子为3d10,提供4s和2个4p空轨道,发生sp2杂化,接受3个Cl-提供的孤对电子对,配离子构型为平面三角形.
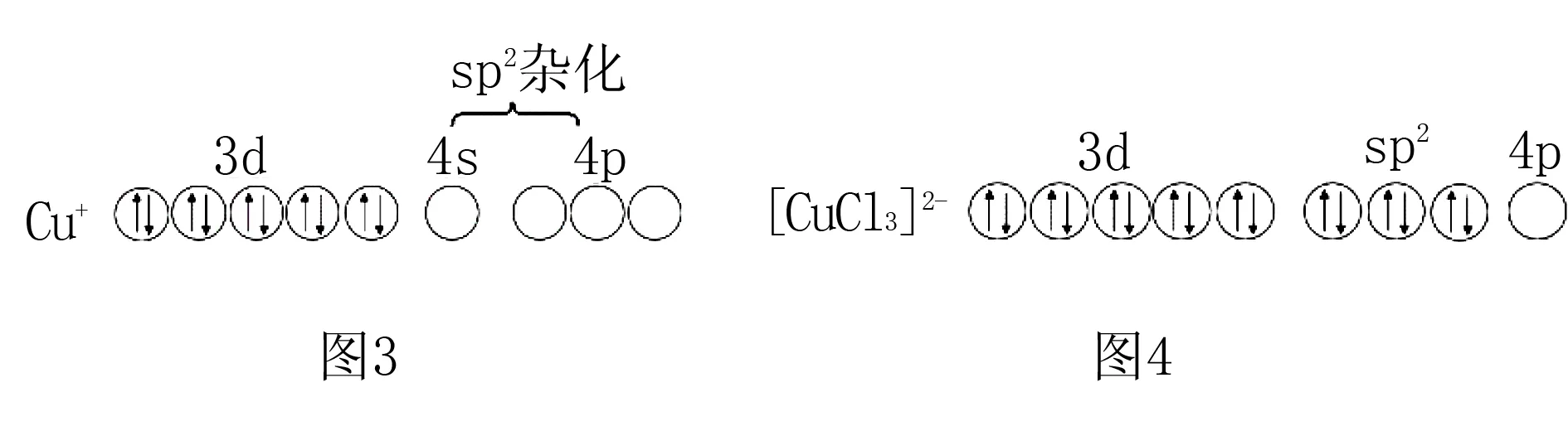
3.配位数为4的配合物
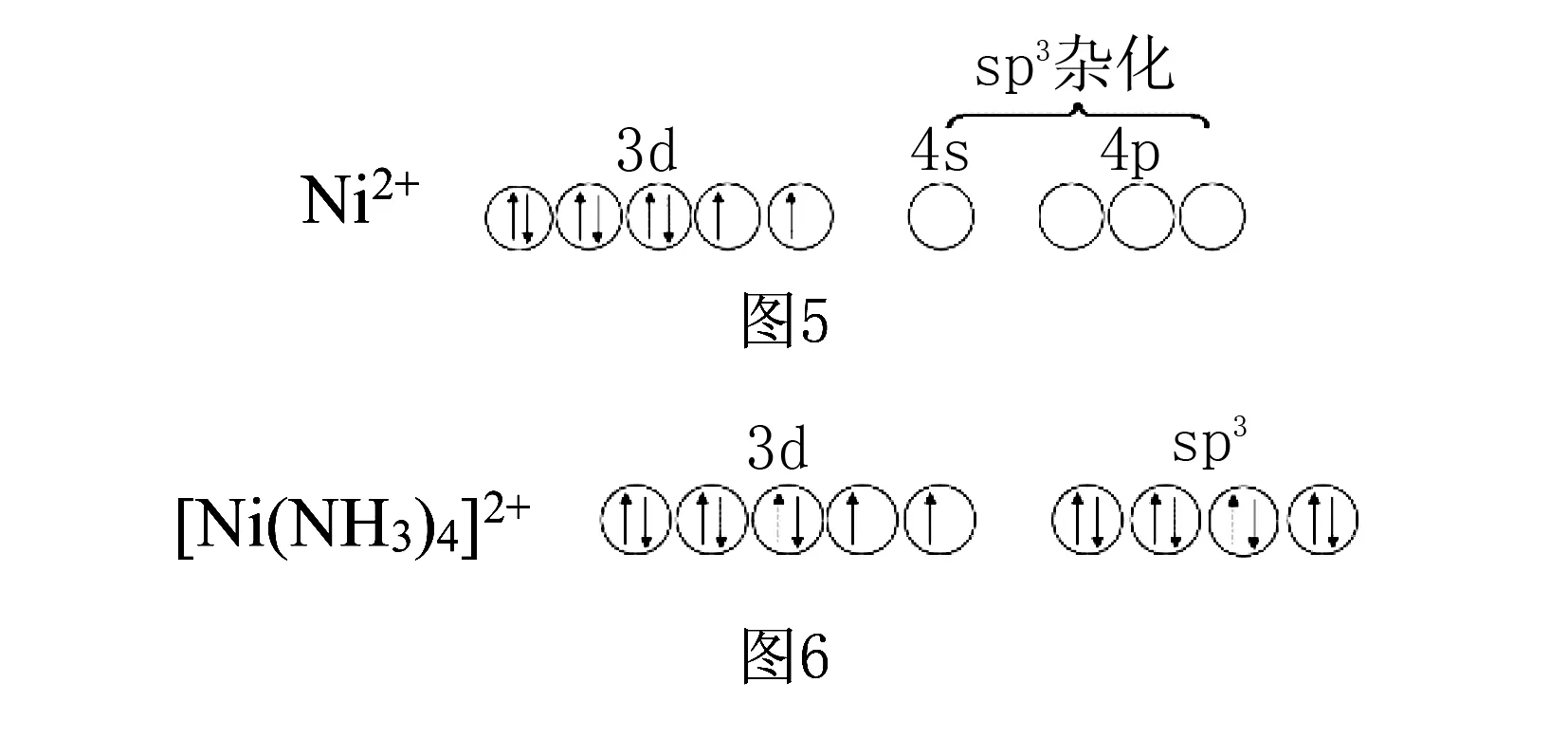
(1)如四氨合镍(Ⅱ)配离子([Ni(NH3)4]2+),Ni2+离子的价电子为3d8,提供4s和3个4p空轨道,发生sp3杂化,接受4个NH3分子中的N提供的孤对电子对,配离子构型为四面体形.
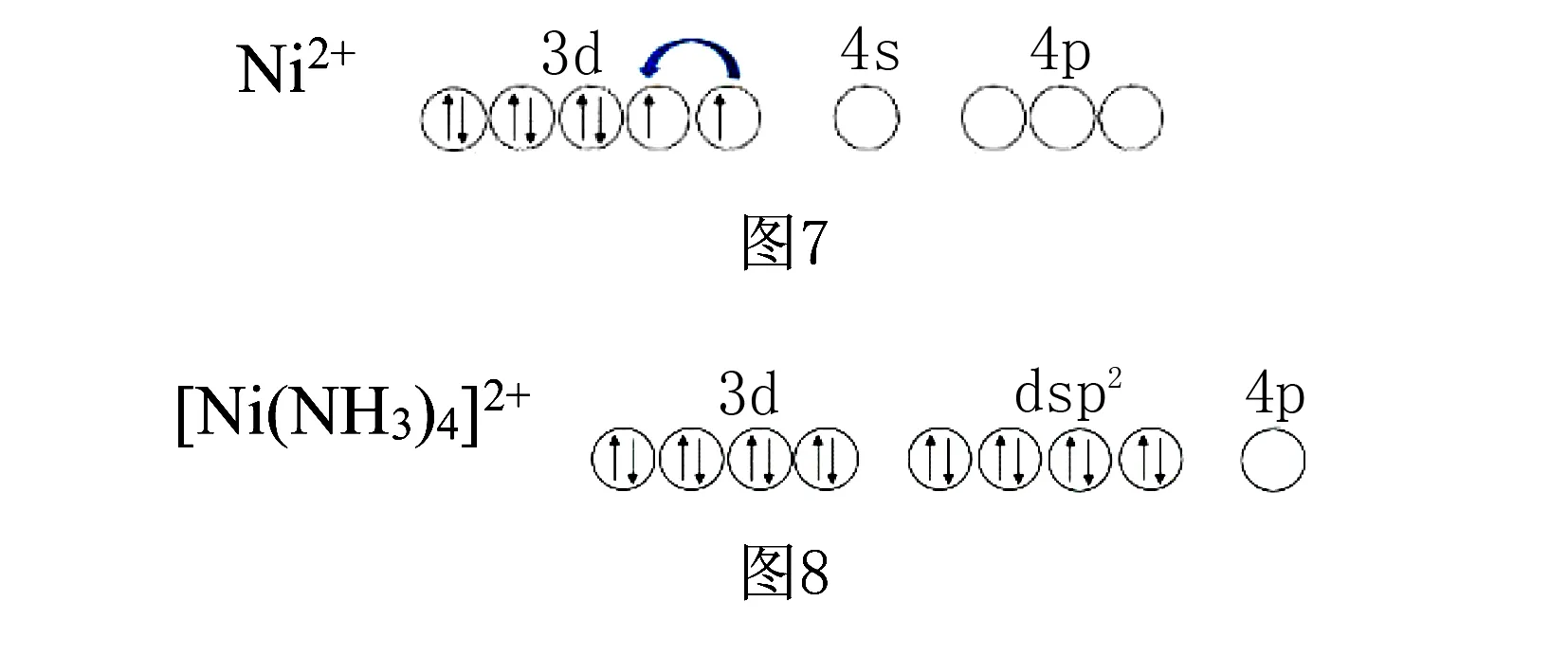
(2)如四氰合镍(Ⅱ)配离子[Ni(CN)4]2-,Ni2+的价电子为3d8,由于C的电负性较小,易给出孤对电子对,对中心原子3d电子排布影响较大,会强制3d电子配对,从而空出1个3d轨道,1个3d和4s、2个4p空轨道发生dsp2杂化,接受4个CN-中的C提供的孤对电子对,配离子构型为平面四方形.
4.配位数为5的配合物
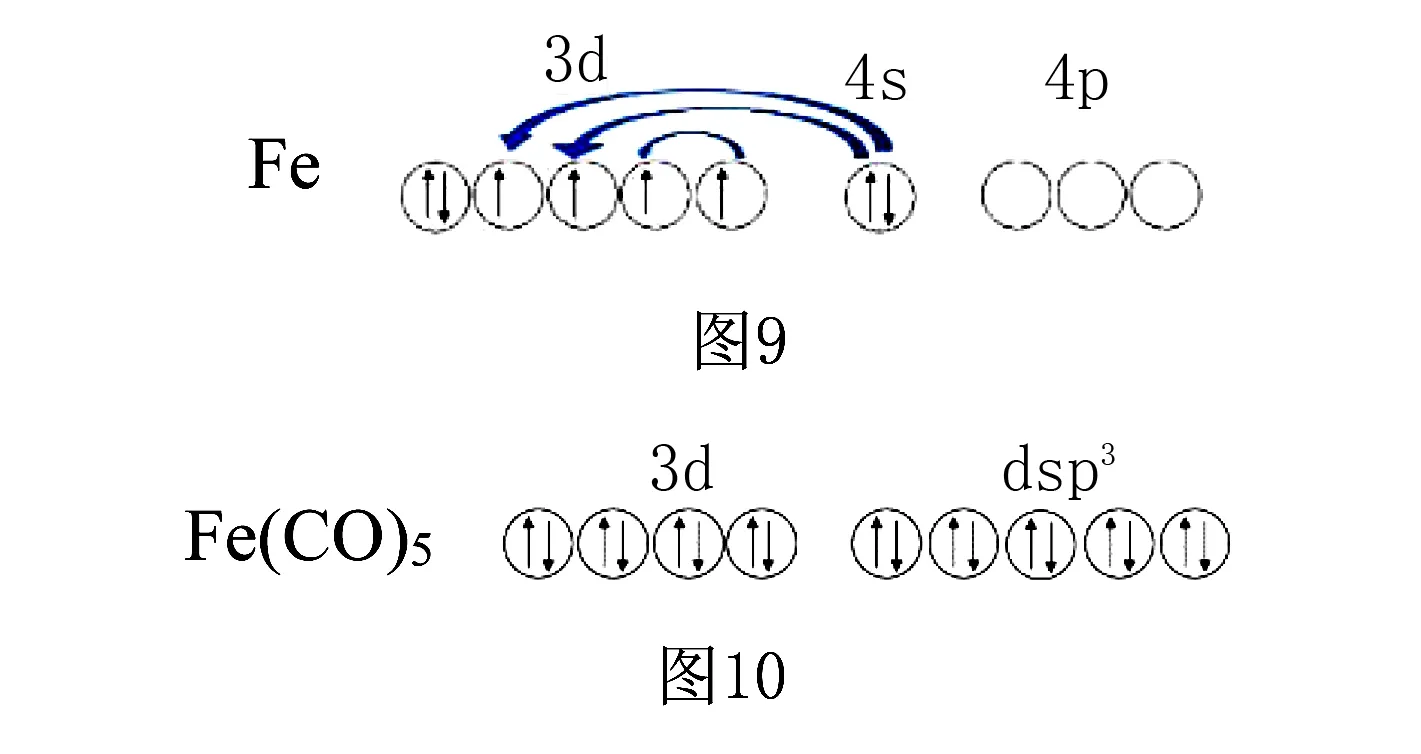
如五羰基合铁(0)(Fe(CO)5),Fe的价电子为3d64s2,在配位原子C的作用下,Fe的3d和4s电子发生重排配对,从而空出1个3d轨道,1个3d和4s、3个4p空轨道发生dsp3杂化,接受五个CO分子中的C提供的孤对电子对,配离子构型为三角双锥形.
5.配位数为6的配合物
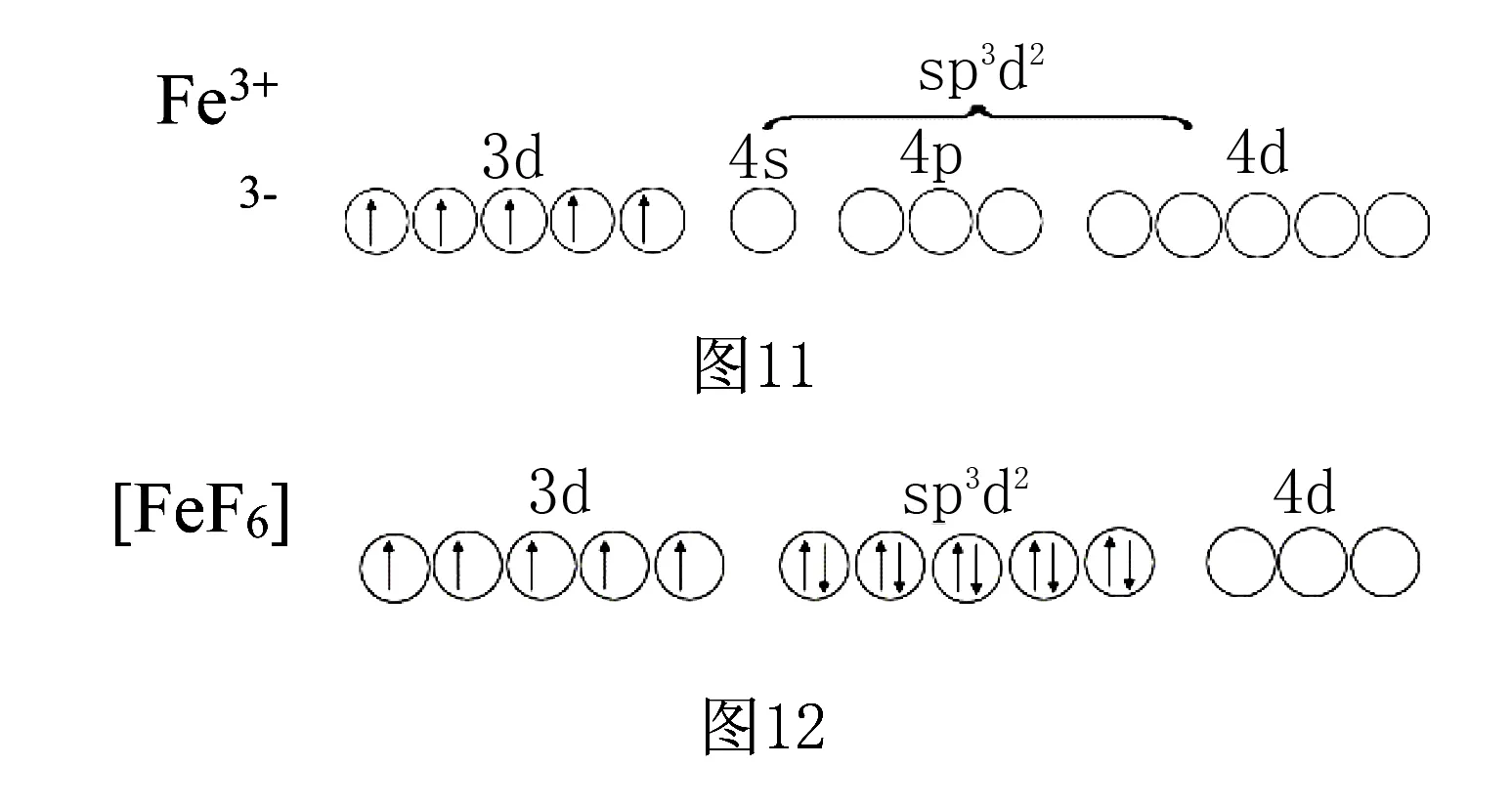
(1)如六氟合铁(Ⅲ)配离子([FeF6]3-),Fe3+的价电子为3d5,由于F的电负性大,不易给出孤对电子对,对Fe3+的3d轨道上的电子排布影响不大,仍保持5个单电子,所以Fe3+只能提供4s、3个4p和2个4d空轨道,发生sp3d2杂化,接受6个F-提供的孤对电子对,配离子构型为八面体形.
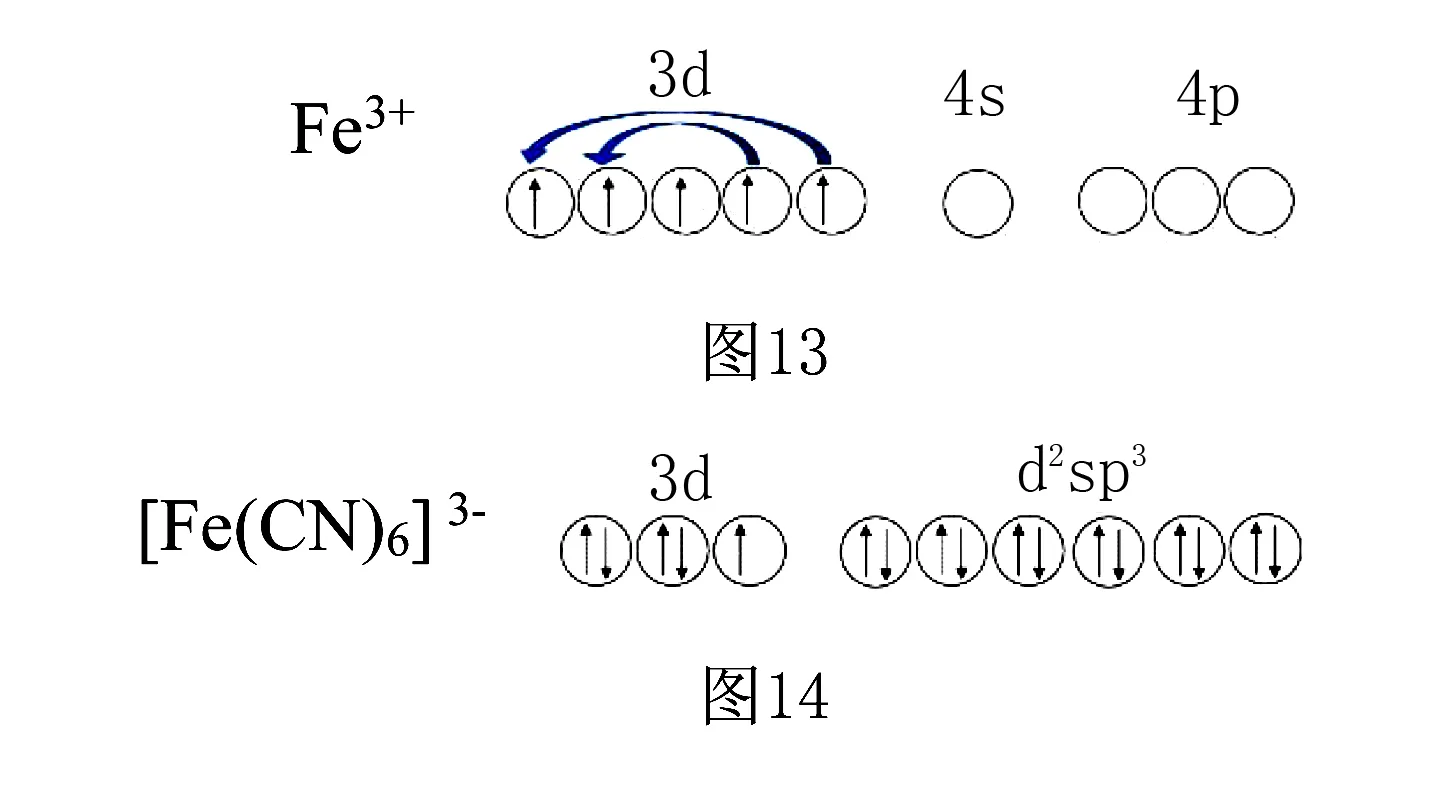
(2)如六氰合铁(Ⅲ)配离子([Fe(CN)6]3-),Fe3+的价电子为3d5,由于C的电负性较小,易给出孤对电子对,强制3d电子配对,所以Fe3+提供2个3d、4s和3个4p空轨道,发生d2sp3杂化,接受6个CN-提供的孤对电子对,配离子构型为八面体形.
配合物配位情况比较复杂,现将常见配合物中心原子配位数、杂化轨道类型与配离子的构型等归纳于表1.
表1
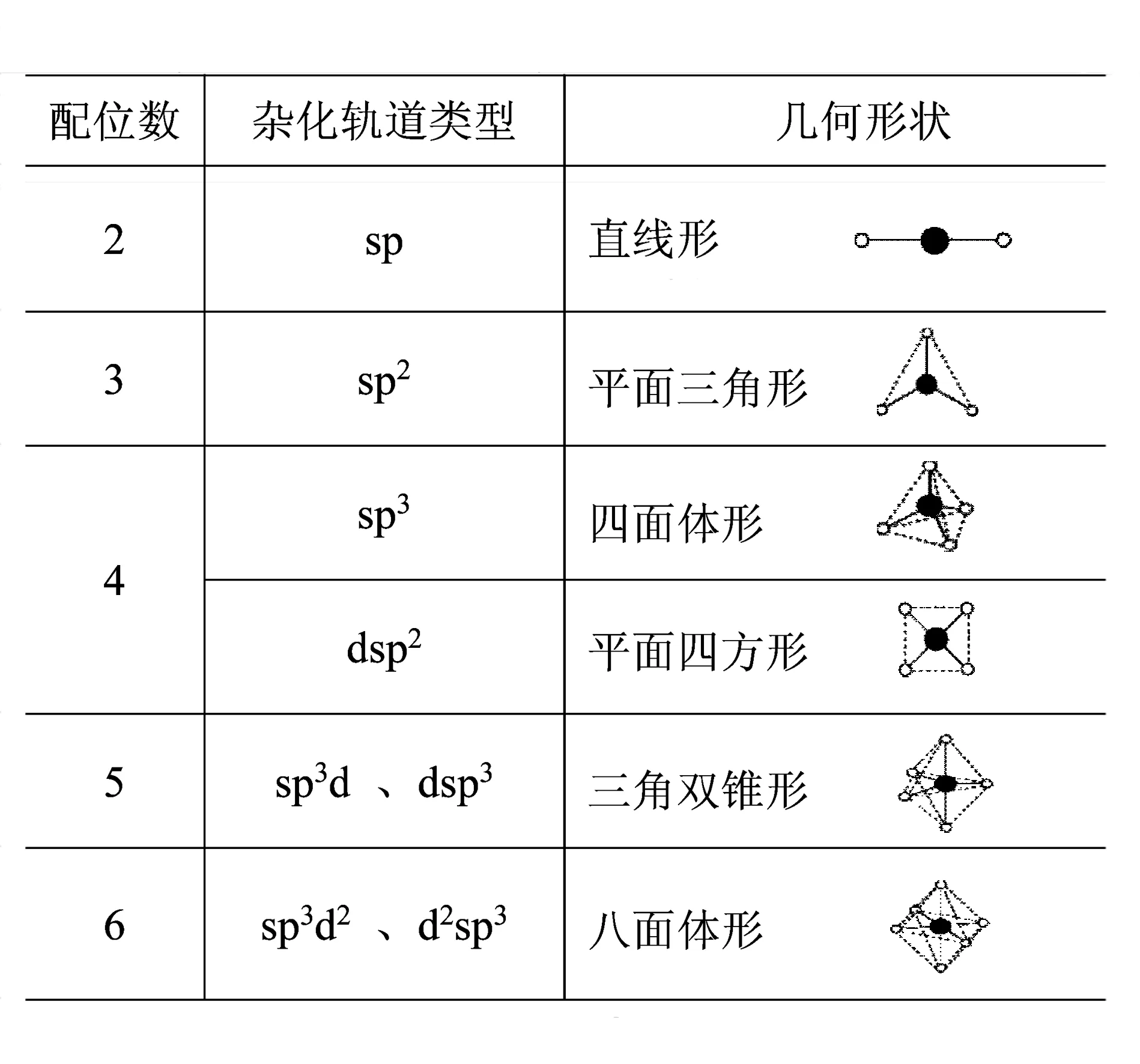
配合物中心原子一般采用两种杂化形式,一种杂化形式为(n-1)d、ns、np杂化,称为内轨型杂化,这种杂化方式形成的配合物称为内轨型配合物.一种杂化形式为ns、np、nd杂化,称为外轨型杂化,这种杂化方式形成的配合物称为外轨型配合物.由于(n-1)d轨道能量比nd轨道低,所以一般内轨型配合物比外轨型配合物稳定.中心原子选择哪种杂化方式,主要取决于中心原子的d轨道电子数以及配位元素的电负性,如d轨道电子数为9~10时,(n-1)d没有空轨道,一般只能发生外轨型杂化,而六氟合铁(Ⅲ)配离子和六氰合铁(Ⅲ)配离子虽然中心原子都是Fe3+,但是由于配位原子电负性的差异,导致两种配离子中Fe3+的杂化方式不一样.
三、价键理论的局限性
人教版“物质的性质与结构”专题中提到四氨合铜(Ⅱ)配离子,教材中给出这种配离子的构型是平面四方形,由构型推测铜离子发生dsp2杂化,然而铜离子的价电子为3d9,只有把3d的1个电子激发到4p轨道上,才能发生dsp2杂化,如果四氨合铜(Ⅱ)配离子能量较高的4p轨道上有1个单电子,则该配离子应该很不稳定,易失去1个电子,但是事实上四氨合铜(Ⅱ)配离子很稳定,所以铜离子采取dsp2杂化不成立.判断配合物构型时,除了价键理论还要考虑晶体场理论,通过晶体场理论分析,四氨合铜(Ⅱ)配离子中的铜离子实际发生了sp3d2杂化,感兴趣的学生可以自行进一步探讨学习.

