MicroRNA-30a-5p靶向Beclin1抑制自噬减轻牛胆酸钠诱导的胰腺泡细胞损伤
郑学松,胡善策,冯广才
0 引言
胰腺炎是一种多由胆结石和酒精滥用等致病因素诱发的无菌性胰腺炎症[1],以胰蛋白酶异常激活引起的急性炎症反应为病理特征[2]。研究表明,胰蛋白酶异常激活引起的炎症反应不仅可导致胰腺损伤,还可进一步发展成为全身炎症反应及多器官功能障碍综合征[3]。现阶段,初期胰腺炎患者多用胃肠减压的方法缓解腹胀腹痛,严重胰腺炎患者多用手术清除胰腺坏死组织,阻止临床症状恶化。而最近机制研究发现,胰腺泡细胞损伤是胰腺炎发生的起始状态,在胰腺炎形成过程中发挥重要作用,因此,减轻胰腺泡细胞损伤是治疗胰腺炎的理想方法[4]。有报道,炎症调节因子微小型RNA-30a-5p(MicroRNA-30a-5p,miR-30a-5p)可通过降低高温需要A1蛋白基因的转录抑制胰腺泡细胞中炎症因子的释放,减轻胰腺泡细胞损伤[5]。同时研究表明,自噬效应蛋白Beclin1在胰腺炎组织中高度表达,细胞自噬显著促进胰腺炎的发生发展[6]。而在小细胞肺癌中,miR-30a-5p可通过靶向下调Beclin1,显著抑制细胞自噬的发生[7]。本文通过建立胰腺泡细胞损伤模型,对miR-30a-5p与Beclin1的作用机制及影响进行深入探究,为胰腺炎临床治疗提供新的思路。
1 材料方法
1.1 实验材料 Ham′s F12K培养液、牛胆酸钠、脂肪酶及淀粉酶试剂盒购自美国Sigma;胎牛血清购自美国Gibco;青霉素-链霉素溶液(100×)、MMT试剂盒、Hoechst试剂盒、RIPA裂解液及BCA试剂盒购自上海碧云天;Trizol、总RNA抽提试剂盒、反转录试剂盒、实时定量PCR试剂盒及脂质体2000转染试剂盒购自美国Thermo Fisher;引物购自北京六合华大基因;肿瘤坏死因子(Tumor necrosis factor,TNF-α)、白介素-6(Interleukin-6,IL-6)及IL-1β ELISA试剂盒购自美国Invirtrogen;实验所用抗体均购自美国Cell Signaling Technology。
大鼠胰腺泡细胞株AR42J由美国典型培养物保藏中心(American Type Culture Collection,ATCC)提供。以含有1%青霉素-链霉素溶液和10%胎牛血清的Ham′s F12K培养液在37 ℃、5% CO2的培养箱中培养细胞。在融合率达到85%时进行传代,浓度约1×104个/ml。将细胞分为Control组、Model组、mimic mock组及miR-30a-5p mimic组。Control组为空白对照,Model组用500 μmol/L的牛胆酸钠进行处理;mimic mock组经牛胆酸钠处理后转染mimic mock,即miR-30a-5p mimic随机打乱后的无意义的基因序列;miR-30a-5p mimic组则转染等量的miR-30a-5p mimic。转染步骤参考试剂盒说明书。
1.2 实验方法
1.2.1 RT-PCR检测miR-30a-5p的mRNA水平 将“1.1”项中各组细胞加入Trizol,在通风橱内进行总RNA抽提,抽提步骤参考试剂盒说明书。定量分析后,进行反转录,每组取等量的RNA反转录为cDNA,反转录步骤参考试剂盒说明书。然后利用实时定量PCR试剂盒对各组样品进行定量分析。
1.2.2 MTT检测细胞存活 将细胞分为Control组、Model组、miR-30a-5p mimic组及pc-Beclin1+miR-30a-5p mimic组。Control组、Model组、miR-30a-5p mimic组处理方式与“1.1”项中相同,pc-Beclin1+miR-30a-5p mimic组细胞经牛胆酸钠处理后,利用pcDNA Beclin1(pc-Beclin1)与miR-30a-5p mimic共同转染。转染步骤参考试剂盒说明书。
将5 mg/ml的MTT溶液加入“1.1”项及“1.2.2”项中各组细胞,4 h后进行终止。弃去板孔中培养液,加入二甲基亚砜轻柔震荡,使结晶物充分溶解。然后利用酶联免疫检测仪在OD 490 nm处测量吸光值。
1.2.3 Hoechst检测细胞凋亡 将“1.1”项及“1.2.2”项中各组细胞进行固定,并利用Hoechst染色试剂盒染色,步骤参考试剂盒说明书。利用荧光显微镜进行检测,激发波长为350 nm,发射波长为460 nm。细胞核呈蓝色。
1.2.4 试剂盒检测脂肪酶及淀粉酶活性 试剂盒利用偶联酶促反应来检测“1.1”项及“1.2.2”项各组细胞脂肪酶及淀粉酶活性,脂肪酶在波长为570 nm处进行比色,淀粉酶在波长为405 nm处进行比色,步骤参考试剂盒说明书。
1.2.5 ELISA检测TNF-α、IL-6和IL-1β浓度 “1.1”项及“1.2.2”项中各组细胞培养上清中TNF-α、IL-6和IL-1β浓度测定步骤参考Invirtrogen ELISA试剂盒说明书。避光显色后,利用酶标仪检测各组样品OD值,并按说明书公式计算其浓度。
1.2.6 免疫印迹检测蛋白表达 RIPA裂解“1.1”项及“1.2.2”项中各组细胞,提取细胞总蛋白。BCA试剂盒定量并调平各组蛋白浓度。取各组蛋白30 mg,通过10% SDS-PAGE将蛋白分离,半干转膜法进行转移至PVDF膜。牛奶室温封闭2.5 h,一抗4 ℃过夜,二抗37 ℃孵育1 h,曝光显色,并以GAPDH为内参。
1.2.7 荧光素酶报告实验 将生物信息预测的miR-30a-5p和Beclin1相互结合片段,利用PCR扩增并插入到荧光素酶报告酶载体中,用于构建Beclin1野生型(wt)质粒。利用基因突变技术对两者相互结合片段上个别位点进行突变,用于构建Beclin1突变型(mut)质粒。将miR-30a-5p mimic与Beclin1wt或Beclin1mut共同转染AR42J细胞,24 h后检测荧光素酶活性。
1.2.8 免疫荧光检测LC3表达 细胞爬片培养12 h移至培养皿中,4%的多聚甲醛4 ℃固定后,利用PBS配制的0.1% Triton X-100室温通透20 min。加5% BSA室温封闭30 min后,一抗4 ℃孵育过夜,荧光二抗37 ℃孵育1 h。避光加入DAPI复染细胞核,封片液封片。荧光显微镜观察采集图像,对光斑进行计数。
1.3 统计学分析 采用SPSS 17.0统计软件对数据进行分析。首先进行正态分布和方差齐性分析,符合条件的选用单因素方差分析或t检验,不符合条件的选用秩和检验。
2 结果
2.1 牛胆酸钠处理胰腺泡细胞浓度的选取 结果表明,对于胰腺泡细胞,牛胆酸钠的半数抑制浓度为513.2 μmol/L,最终选取牛胆酸钠用药浓度为500 μmol/L用于后续实验。见图1。
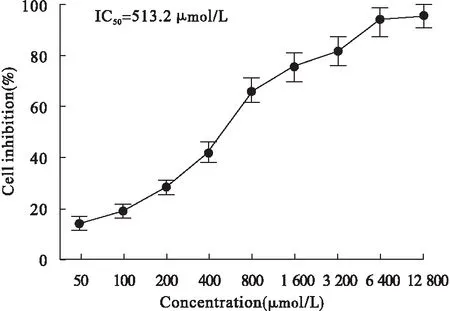
图1 不同浓度牛胆酸钠对胰腺泡细胞抑制率的影响
2.2 胰腺泡细胞损伤及miR-30a-5p mimic对miR-30a-5p的影响 与Control组比较,Model组胰腺泡细胞中miR-30a-5p的mRNA水平显著降低(P<0.01,图2A)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中miR-30a-5p的mRNA水平显著升高(P<0.01,图2B)。
2.3 胰腺泡细胞损伤及miR-30a-5p mimic对细胞存活、脂肪酶及淀粉酶的影响 与Control组比较,Model组胰腺泡细胞存活率显著降低(P<0.01,图3B),细胞大量凋亡(图3A),凋亡细胞百分比显著升高(P<0.01,图3C)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中胰腺泡细胞存活率显著升高(P<0.01,图3B),凋亡细胞显著减少(图3A),凋亡细胞百分比显著降低(P<0.01,图3C)。
与Control组比较,Model组胰腺泡细胞中脂肪酶及淀粉酶活性显著升高(P<0.01,图4)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中脂肪酶及淀粉酶活性显著降低(P<0.01,图4)。
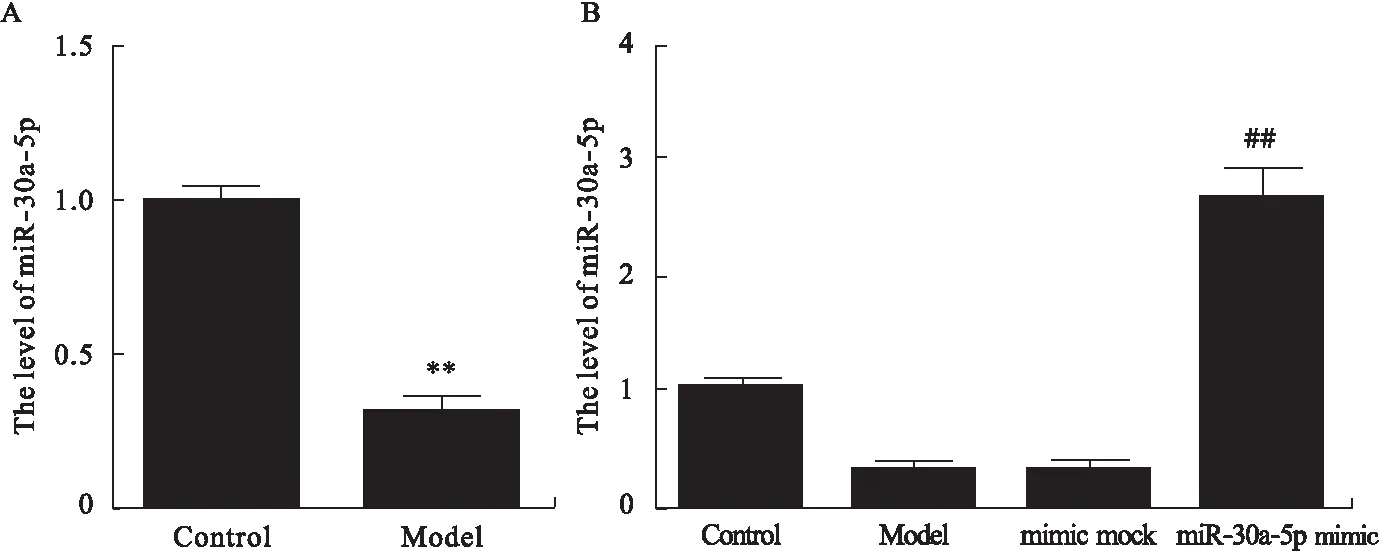
图2 各组中miR-30a-5p的mRNA水平
注:A.胰腺泡细胞损伤对miR-30a-5p的影响;B.miR-30a-5p mimic对miR-30a-5p的影响。与Control组比较,**P<0.01;与miR-30a-5p
mimic group组比较,##P<0.01
2.4 胰腺泡细胞损伤及miR-30a-5p mimic对炎症反应和细胞自噬的影响 与Control组比较,Model组胰腺泡细胞培养上清中TNF-α、IL-6和IL-1β的浓度显著升高(P<0.01)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中TNF-α、IL-6和IL-1β的浓度显著降低(P<0.01)。见图5。
与Control组比较,Model组胰腺泡细胞中LC3Ⅱ/LC3Ⅰ比值及Beclin1的表达显著上升,p62的表达显著下降(P<0.01)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中LC3Ⅱ/LC3Ⅰ比值及Beclin1的表达显著下降,p62的表达显著上升(P<0.01)。见图6。
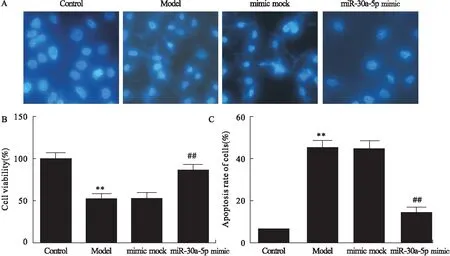
图3 各组细胞存活率及凋亡细胞百分比
注:A.Hoechst染色图;B.各组细胞存活率;C.各组凋亡细胞百分比。与Control组比较,**P<0.01;与miR-30a-5p mimic group组比较,##P<0.01
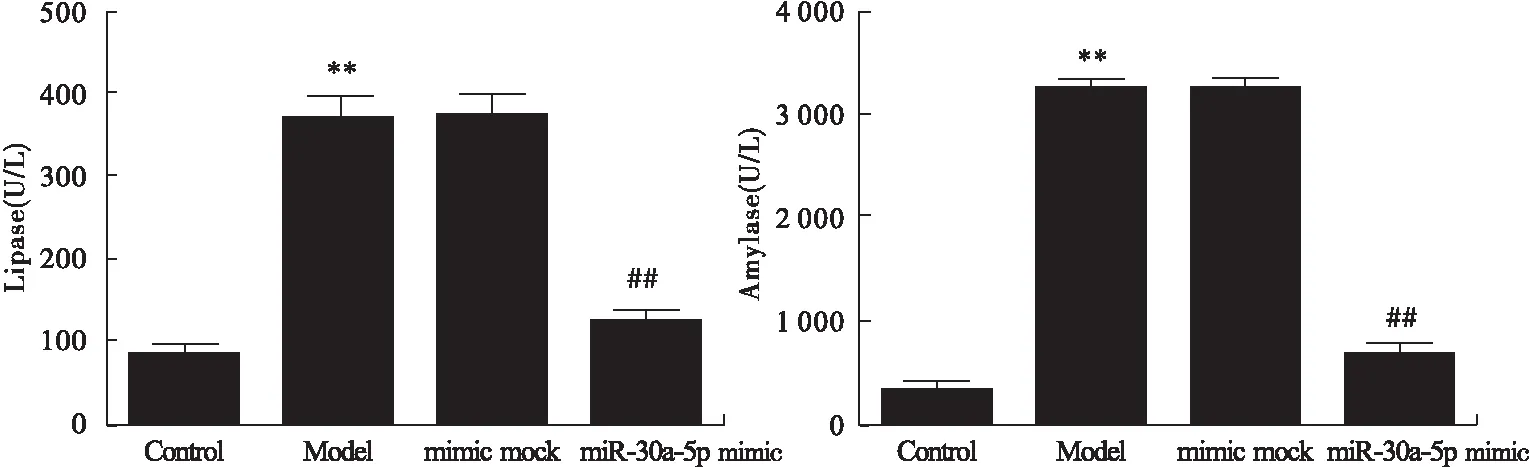
图4 各组细胞中的脂肪酶及淀粉酶活性
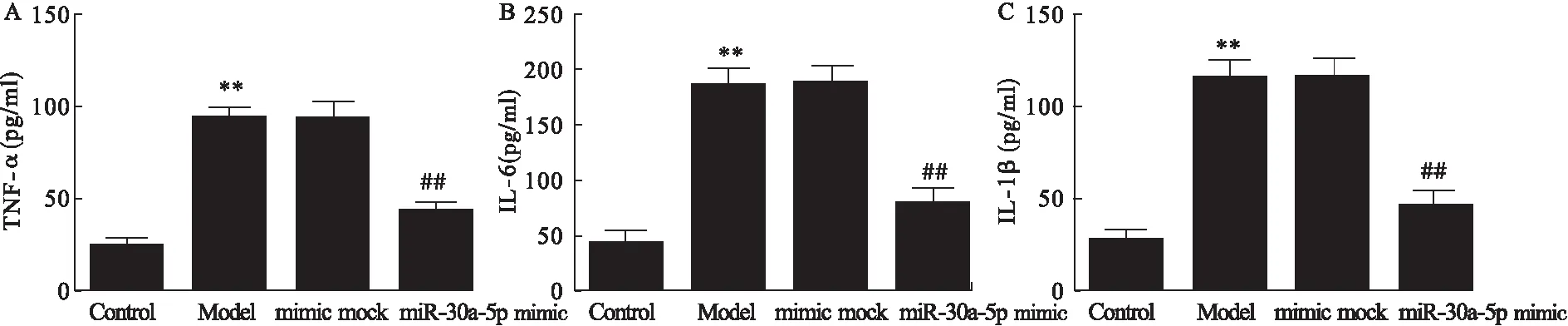
图5 各组细胞中TNF-α、IL-6和IL-1β的浓度
注:A.各组细胞中TNF-α的浓度;B.各组细胞中IL-6的浓度;C.各组细胞中IL-1β的浓度。与Control组比较,**P<0.01;与miR-30a-5p mimic group组比较,##P<0.01
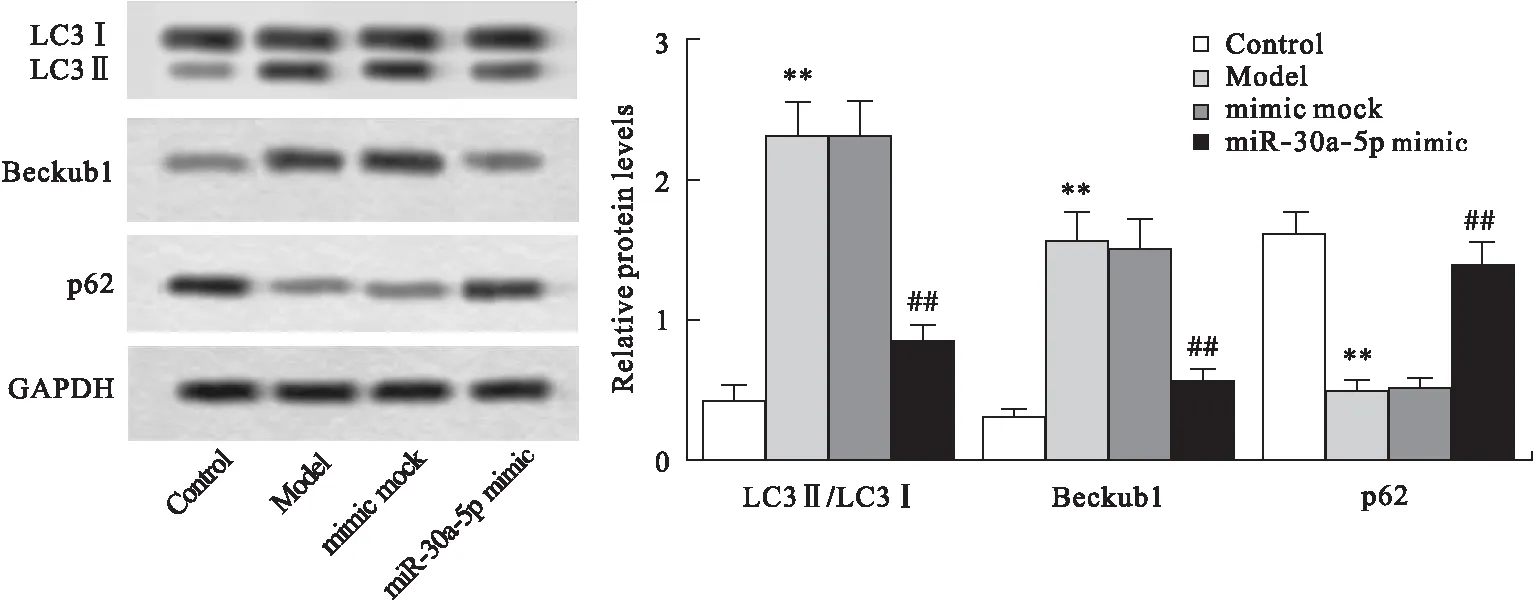
图6 各组细胞中LC3Ⅱ/LC3Ⅰ比值及Beclin1和p62的表达水平
2.5 胰腺泡细胞损伤及miR-30a-5p mimic对PI3K/AKT/mTOR的影响 与Control组比较,Model组胰腺泡细胞中p-P13K、p-Akt及p-mTOR的表达显著下降(P<0.01)。与Model组比较,mimic mock组差异无统计学意义;miR-30a-5p mimic组中p-P13K、p-Akt及p-mTOR的表达显著上升(P<0.01)。见图7。

图7 各组细胞中p-P13K、p-Akt及p-mTOR的表达水平
2.6 miR-30a-5p和Beclin1的靶向关系 生物信息预测结果显示,miR-30a-5p和Beclin1之间存在连续结合片段。提示两者之间存在靶向关系。miR-30a-5p mimic可显著降低Beclin1wt的荧光酶活性(P<0.01),而对结合片段突变后的Beclin1mut没有显著影响。见图8。
2.7 miR-30a-5p mimic及pc-Beclin1对细胞自噬、细胞存活及凋亡的影响 与Control组比较,Model组胰腺泡细胞中Beclin1的表达显著增加,LC3荧光值(绿色)显著升高(P<0.01)。与Model组比较,miR-30a-5p mimic组中Beclin1的表达显著减少,LC3荧光值显著降低(P<0.01)。pc-Beclin1可显著上调Beclin1表达(P<0.01)。与miR-30a-5p mimic组比较,pc-Beclin1+miR-30a-5p mimic(pc-Beclinl+mimic)组中Beclin1的表达显著增加,LC3荧光值显著升高(P<0.01)。见图9。

图8 miR-30a-5p和Beclin1的靶向关系
与Control组比较,Model组胰腺泡细胞存活率显著降低(P<0.01,图10B),凋亡细胞百分比显著升高(P<0.01,图10C)。与Model组比较,miR-30a-5p mimic组细胞存活率显著升高(P<0.01,图10B),凋亡细胞百分比显著降低(P<0.01,图10C)。与miR-30a-5p mimic组比较,pc-Beclin1+ mimic组细胞存活率显著降低(P<0.01,图10B),凋亡细胞百分比显著升高(P<0.01,图10C)。
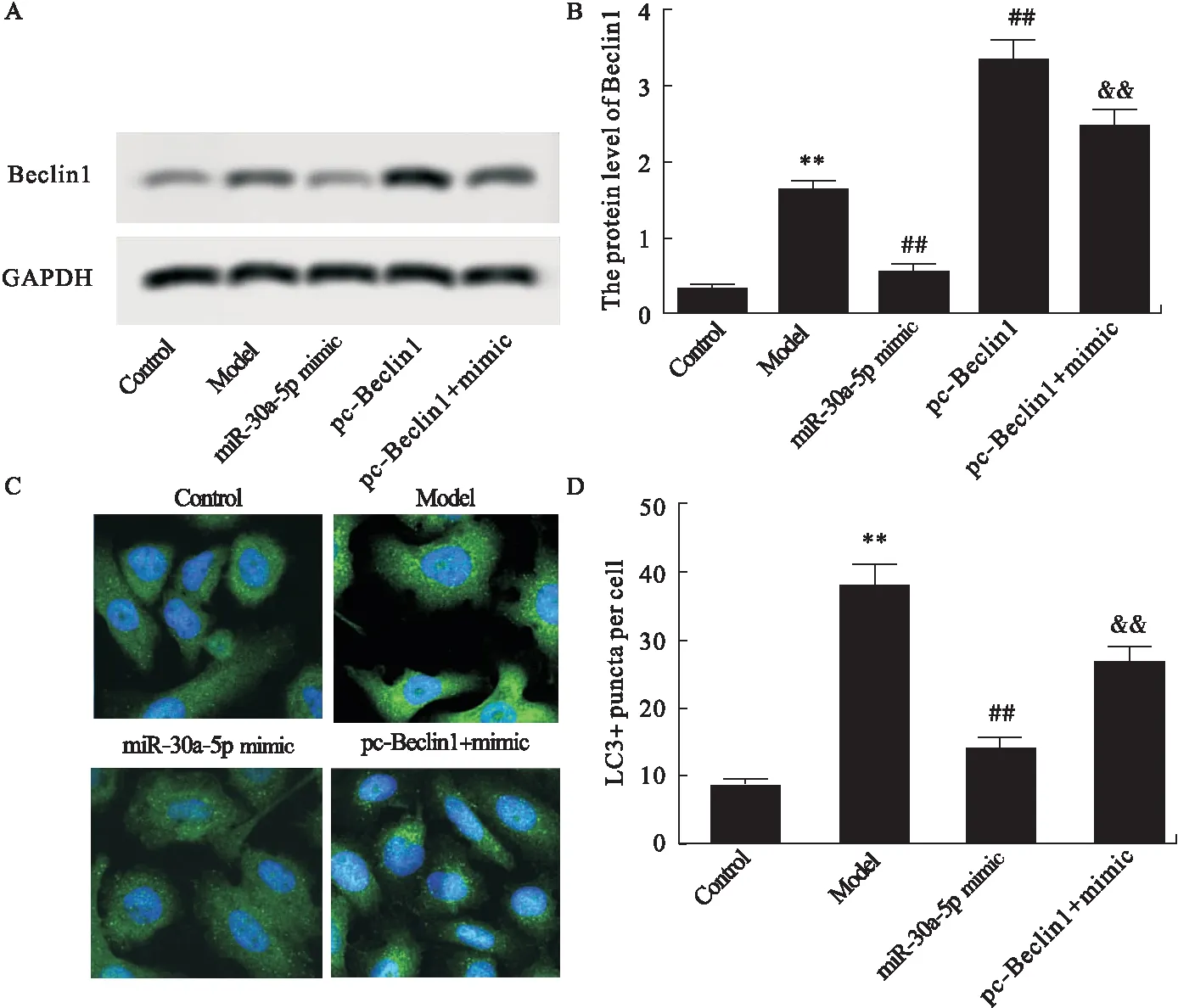
图9 各组细胞中Beclin1及LC3的表达
注:A.各组细胞中Beclin1的表达;B.Beclin1表达水平量化分析;C.各组细胞中LC3的表达;D.各组LC3阳性细胞百分比。与Control组比较,**P<0.01;与Model组比较,##P<0.01;与miR-30a-5p mimic group组比较,&&P<0.01
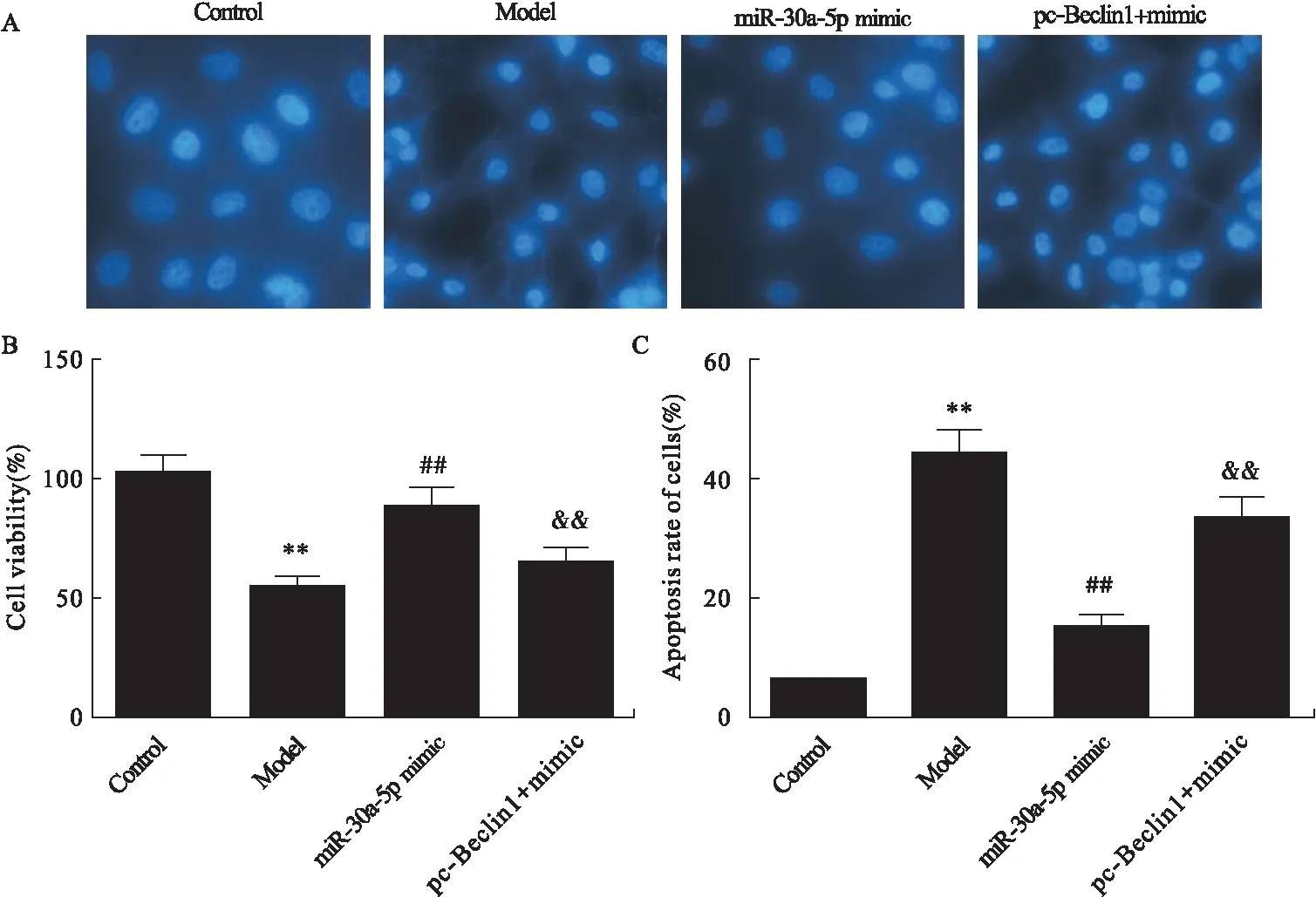
图10 各组细胞存活率及凋亡细胞百分比
注:A.Hoechst染色图;B.各组细胞存活率;C.各组凋亡细胞百分比。与Control组比较,**P<0.01;与Model组比较,##P<0.01;与miR-30a-5p mimic group组比较,&&P<0.01
2.8 miR-30a-5p mimic及pc-Beclin1对脂肪酶及淀粉酶的影响 与Control组比较,Model组胰腺泡细胞中脂肪酶及淀粉酶活性显著升高(P<0.01)。与Model组比较,miR-30a-5p mimic组脂肪酶及淀粉酶活性显著降低(P<0.01)。与miR-30a-5p mimic组比较,pc-Beclin1+ mimic组脂肪酶及淀粉酶活性显著升高(P<0.01)。见图11。
2.9 miR-30a-5p mimic及pc-Beclin1对胰腺泡细胞炎症反应的影响 与Control组比较,Model组胰腺泡细胞培养上清中TNF-α、IL-6和IL-1β的浓度显著升高(P<0.01)。与Model组比较,miR-30a-5p mimic组中TNF-α、IL-6和IL-1β的浓度显著降低(P<0.01)。与miR-30a-5p mimic组比较,pc-Beclin1+ mimic组中TNF-α、IL-6和IL-1β的浓度显著升高(P<0.01)。见图12。
3 讨论
miR-30a是一类抗细胞自噬基因,在多种细胞中显著抑制细胞自噬的发生[8-11]。miR-30a-5p是miR-30a的存在形式之一,可显著抑制小细胞肺癌细胞自噬的发生[7]。而在胰腺炎中,胰腺泡细胞损伤后自噬程序被过度激活,并显著推进胰腺炎的发生发展[6]。有报道,miR-30a-5p可通过靶向下调自噬效应蛋白Beclin1抑制细胞自噬的发生[7]。因此,本文通过上调miR-30a-5p,对miR-30a-5p与Beclin1在胰腺炎中的作用机制及其产生的影响进行了深入探究。本文首先利用不同浓度的牛胆酸钠对胰腺泡细胞AR42J进行预实验,确定牛胆酸钠的最佳处理浓度为500 μmol/L。随后利用500 μmol/L的牛胆酸钠建立胰腺泡细胞损伤模型,发现胰腺泡细胞损伤后,miR-30a-5p的mRNA水平显著降低。提示miR-30a-5p下调与胰腺泡细胞损伤有关。
在胰腺炎中,胰腺泡细胞存活率显著降低,凋亡水平显著升高,进一步推进胰腺炎病情的恶化[12]。因此,促存活抗凋亡可阻止胰腺炎的恶性发展。研究表明,在骨质溶解模型小鼠头骨中,上调miR-30a-5p可降低成骨细胞凋亡水平,抑制骨质溶解的发展[13]。而在卵巢癌中,高度表达的miR-30a-5p通过下调叉头转录因子1显著提高癌细胞的存活能力[14]。本文利用miR-30a-5p mimic上调miR-30a-5p后发现,miR-30a-5p可显著抑制胰腺泡细胞损伤引起的细胞凋亡,并提高胰腺泡细胞存活率。同时,本研究发现,上调miR-30a-5p可显著降低胰腺泡细胞损伤模型细胞中脂肪酶及淀粉酶活性。脂肪酶及淀粉酶是诊断急性胰腺炎的重要指标,发生急性胰腺炎时,其活性多超过正常值3倍以上[15]。降低脂肪酶及淀粉酶活性可改善胰腺炎大鼠的病情[16]。综合实验结果提示,miR-30a-5p可促进胰腺泡细胞存活,抑制细胞凋亡,降低脂肪酶及淀粉酶活性,阻止胰腺炎的恶化。
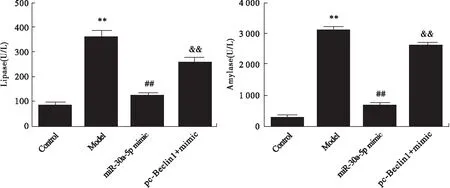
图11 各组细胞中的脂肪酶及淀粉酶活性
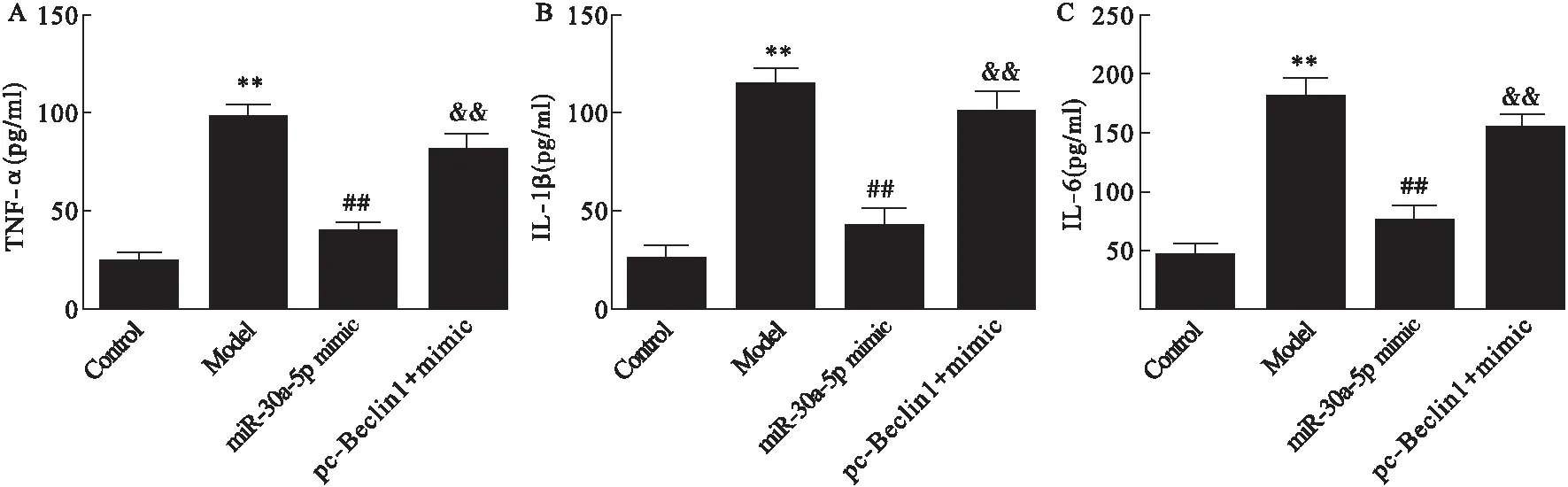
图12 各组细胞中TNF-α、IL-6和IL-1β的浓度
注:A.各组细胞中TNF-α的浓度;B.各组细胞中IL-6的浓度;C.各组细胞中IL-1β的浓度。与Control组比较,**P<0.01;与Model组
比较,##P<0.01;与miR-30a-5p mimic group组比较,&&P<0.01
作为炎症调节因子,miR-30a-5p可通过MAPK/ERK信号显著抑制脊髓损伤诱导的炎症反应,降低TNF-α及IL-1β的产生[17]。研究表明,miR-30a-5p可通过降低高温需要A1蛋白基因的转录抑制胰腺泡细胞中炎症因子的释放[5],通过降低IL-6受体表达干扰炎症Th17细胞的成熟[18]。本研究发现,上调miR-30a-5p可显著降低胰腺泡细胞损伤模型细胞培养上清中TNF-α、IL-6和IL-1β的浓度。TNF-α、IL-6和IL-1β均为促炎性细胞因子,参与炎症级联反应,并进一步促进胰腺炎的发展[19]。实验结果提示,miR-30a-5p减轻胰腺泡细胞损伤引起的炎症反应。
自噬程序在胰腺泡细胞损伤后被过度激活,自噬效应蛋白Beclin1在胰腺炎组织中高度表达并显著推进胰腺炎的发生发展[6]。研究发现,miR-30a可作为抗细胞自噬基因,在胶质母细胞瘤U251细胞、血管内皮细胞、胃癌SGC-7901细胞及晶状体上皮细胞中显著抑制细胞自噬发生[8-11]。作为miR-30a的存在形式之一,miR-30a-5p可通过靶向下调Beclin1,显著抑制小细胞肺癌的细胞自噬[7]。在本研究中,miR-30a-5p可显著降低胰腺泡细胞损伤模型细胞中LC3Ⅱ/LC3Ⅰ比值及Beclin1表达,提高p62的表达。LC3Ⅱ/LC3Ⅰ比值是估计细胞自噬水平的一个指标,当自噬形成时,LC3Ⅰ与磷脂酰乙醇胺结合转变为LC3Ⅱ,LC3Ⅱ/LC3Ⅰ比值的增加表明细胞自噬水平的提高[20]。Beclin1基因又称BECN1,可调节自噬前体的形成,诱导自噬相关蛋白定位于自噬体膜上,促进细胞自噬的发生[21]。p62是自噬特异性底物,可与LC3相互作用,通过自噬-溶酶体通路被不断降解,p62的聚集和增加表示细胞自噬能力的降低[22]。同时,本文通过生物信息预测及荧光素酶实验证实,在胰腺泡细胞中,miR-30a-5p与Beclin1存在靶向关系。进一步利用pcDNA Beclin1上调Beclin1后发现,miR-30a-5p mimic对胰腺泡细胞损伤模型细胞自噬的抑制作用显著减弱,LC3表达显著增加。此外,本研究发现,与miR-30a-5p mimic组比较,pc-Beclin1+ mimic组中胰腺泡细胞存活率显著降低,凋亡细胞百分比、脂肪酶及淀粉酶活性显著升高,胰腺泡细胞培养上清中TNF-α、IL-6和IL-1β的浓度显著增加。综合实验结果表明,上调Beclin1可显著促进胰腺泡细胞自噬的发生,并抑制细胞存活,促进细胞凋亡,提高胰腺泡细胞中脂肪酶及淀粉酶活性,推进胰腺炎炎症反应的发展。提示miR-30a-5p可通过靶向下调Beclin1抑制胰腺泡细胞自噬的发生,并促进细胞存活,抑制细胞凋亡,降低胰腺泡细胞中脂肪酶及淀粉酶活性,阻碍胰腺炎炎症反应的发展。
PI3K/AKT/mTOR信号通路是经典的促增殖抗凋亡通路,而近期研究表明,PI3K/AKT/mTOR信号通路与细胞自噬密切相关[23-24]。在慢性胰腺炎中,PI3K/AKT/mTOR信号通路激活后,可通过抑制细胞自噬,阻碍胰腺星形细胞活化,从而阻止胰腺组织纤维化的发生[23]。在猪肾上皮细胞中,赭曲霉毒素A可通过阻碍AKT/mTOR信号通路诱导细胞自噬[24]。有报道,在心肌细胞中,miR-30a-3p可通过激活PI3K/AKT信号通路,抑制败血症引起的细胞凋亡。本文中,miR-30a-5p可显著提高胰腺泡细胞损伤模型细胞中p-P13K、p-Akt及p-mTOR的表达,提示miR-30a-5p可能通过激活胰腺泡细胞中PI3K/AKT/mTOR信号通路,发挥促增殖抗凋亡及抑制细胞自噬的作用。
综上所述,miR-30a-5p可激活胰腺泡细胞中的PI3K/AKT/mTOR信号通路,提示miR-30a-5p可能通过此机制发挥促增殖抗凋亡及抑制细胞自噬的作用。同时,miR-30a-5p可通过靶向下调Beclin1抑制胰腺泡细胞自噬的发生,并提高细胞存活率,降低凋亡细胞百分比及胰腺泡细胞中的脂肪酶和淀粉酶活性,阻碍炎症因子TNF-α、IL-6和IL-1β的释放,从而减轻牛胆酸钠诱导的胰腺泡细胞损伤,为miR-30a-5p临床治疗胰腺炎的应用提供理论基础。

