低钾胁迫下外源生长素对烟草根系生长及钾吸收的影响
郭 泽,李子绅,代晓燕,王英锋
(河南农业大学烟草学院/烟草行业烟草栽培重点实验室,郑州 450002)
钾是植物细胞中含量最丰富的阳离子之一[1],约占植物干重的2%~10%[2]。钾元素参与了植物生长发育的许多过程[3]。虽然土壤中钾离子浓度一般在0.025~5 mmol/L范围内[4],但植物根际中的钾离子浓度常低于0.3 mmol/L[5],所以大田农作物经常处于缺钾状态。而植物根系是对缺钾信号最敏感的原初器官,植物对钾素的吸收主要取决于其根系。因此,研究低钾胁迫下植物根系的生长发育及吸钾状况,对提高植物体内钾素水平具有重要意义。对拟南芥低钾胁迫下钾离子信号传导途径研究表明:第一,低钾胁迫可引起H+-ATPase活性的提高,导致质膜的超极化和细胞外酸化,前者可激活内流型钾离子通道AKT1和可渗透性钙离子通道,后者可促进HAK5类钾离子转运体调控的钾吸收;第二,低钾可诱导根细胞中活性氧的累积,最终调控HAK5类钾离子转运体的转录变化[6-7]和激活AKT1等钾离子通道的活性,从而调控钾离子的吸收[8]。进一步的研究表明,低钾胁迫下,植物根系的生长会发生变化,这是由于低钾胁迫可诱导乙烯的产生,促进中柱生长素运输基因PIN3和PIN7的转录量增加,从而影响生长素在植株根系中的分布[9]。乙烯也可促进生长素从根尖到分生区的运输量,大量积累的生长素抑制了植物主根的生长,说明低钾胁迫可刺激植物激素生长素的合成进而影响植物根系形成,也说明生长素是低钾胁迫信号传导的主要因素和植物根系对钾素吸收运输的重要物质。对于生长素影响钾素吸收转运的研究集中在顶端调控的情况下,如郭丽琢等[10]研究发现,烟株打顶后用NAA处理茎断口,烟株及烟叶内K的最终积累量增加。洪丽芳等[11]利用86Rb标记示踪原子法研究发现,当烟草施用生长素以后,86Rb在木质部中的运输量增强,在韧皮部中下运的量降低,因此有利于钾素在烟叶中的积累。进一步对钾离子通道与植物激素类物质的关系研究发现,打顶抑制了钾离子通道基因在烟叶中的表达,诱导其在根中的表达,且打顶后在植物顶端涂抹生长素类物质,可抑制因打顶引起的钾离子通道基因在烟叶和根系中的表达[12]。这说明打顶后涂抹生长素可能通过引起植物体内相关钾离子转运蛋白的转录表达,进而影响植物对钾素的吸收。目前对于生长素与钾素吸收积累与转录分析的调控研究都是在顶端调控下进行的,而对于植物吸收钾离子的主要部位根系的调控研究较少,且对生长素参与调控烟株根系钾离子的吸收和运输机制并不清楚。本文以模式植物烟草为研究材料,采用室内水培的方法,通过对烟株根系进行不同浓度的钾素及外源生长素处理,探索生长素参与调控烟草根系的吸钾机理,以期为理解低钾胁迫下植物的吸钾机制提供理论依据。
1 试验材料与方法
1.1 供试材料与材料培养
供试材料为烟草品种‘豫烟6号’,试验在河南农业大学烟草行业烟草栽培重点实验室进行。烟草种子完成催芽后,均匀移栽在装有Hoagland全营养液和珍珠岩的黑色小盆容器中,然后放置在光照培养箱中生长,培养条件:昼温 (28 ± 2)℃,夜温(18 ± 2)℃,光周期14 h,光照强度4000 lx,相对湿度65%~70%。
1.2 试验处理
当烟苗长至3片真叶时,挑选长势一致的烟苗,用去离子水洗净根系后移至水培盒子进行水培处理。首先放入无钾的Hoagland全营养液进行钾饥饿48 h,再分别置于不同的钾水平营养液中进行培养。试验共设2个钾水平,分别为正常供钾 (5 mmol/L)和低钾 (0.15 mmol/L)[13],培养期间用通气泵间歇通气。为保持营养液中的养分浓度相对稳定,每隔4 天换一次营养液。营养液除钾水平不同外,其它成分含量均按照Hoagland全营养液方法进行。钾处理8天后同时添加不同浓度的外源生长素进行处理,外源生长素为3-吲哚乙酸,共设5个浓度:0、5、10、20、40 μmol/L (前期进行大量探索试验发现,生长素浓度过高时,根系生长会出现直接坏死,因此,本文生长素浓度的设置为前期试验筛选所得)。生长素使用时用无水乙醇按50 mg/mL的比例进行溶解。处理4 d后取样测定相应指标,每个处理6次重复。
1.3 测定指标和方法
1.3.1 根系及地上部干重 分别取植株根系及地上部,在105℃烘箱中杀青30 min后,65℃中烘干至恒重,分别测定根系及地上部干重。
1.3.2 根系扫描特征 待处理时间结束后,迅速剪取烟草完整根系,通过数字化扫描仪 (EPSON Expreeion 1000XL) 对根系进行扫描,之后用WinRHIZO根系分析系统软件对根系八项指标 (总根长、根体积、根总表面积、根投影面积、根平均直径、根尖数、根分叉数和根交叠数) 进行定量分析。
1.3.3 根系生理指标 根系活力测定采用TTC (氯化三苯基四氮唑) 法[14];根系H+-ATPase活性根据试剂盒使用步骤进行测定[15](试剂盒购自南京建成生物工程研究所);根系可溶性蛋白含量采用考马斯亮蓝G-250比色法[16]测定。
1.3.4 植株各部位生长素浓度 分别采集主根尖(0~2 cm)、侧根尖 (0~2 cm) 和顶部第一片功能叶片0.5 g新鲜烟草样品,用液氮速冻后,存放于-80℃冰箱中保存,采用间接酶联免疫吸附法 (ELISA)[17](酶免疫试剂盒由中国农业大学化控中心提供) 进行测定。
1.3.5 植株各部位钾素浓度 精确称取烘干磨碎过0.2 mm筛的样品0.1000 g左右,采用1 mmol/L盐酸-火焰光度计法[18],测定植株根系及地上部钾含量。
1.3.6 根系钾吸收动力学参数 参照Xu等[8]的溶液耗竭方法进行试验。取供试烟苗在无钾营养液中饥饿处理2天,期间每天换饥饿液1次。耗竭试验开始时,将烟苗装入含50 mL耗竭液的黑色三角瓶中(耗竭液由 0.4 mmol/L KNO3、0.2 mmol/L CaSO4组成),每隔12 h取样一次,直到耗竭液中钾浓度接近零时结束取样。每次取10 mL耗竭液,取样后用10 mL去离子水补充。用火焰光度计测定耗竭液钾浓度。以耗竭液的钾浓度为纵坐标,耗竭时间为横坐标作钾离子耗竭曲线,得出一元二次方程模型Y=a+bX+cX2,其中X代表吸收时间,Y代表该时刻耗竭液中钾浓度。
结合Li和Ma的方法[19],计算根系钾吸收动力学参数Vmax = [b× 耗竭液体积 (mL)]/[0.06 × 鲜根重(g)],Km =a- 3b2/16c,Cmin=a-b2/4c,其中a、b、c不考虑正负号。
1.3.7 钾离子相关通道基因表达量 钾离子通道相关基因的相对表达量采用实时荧光定量PCR法测定:采用trizol法提取总RNA,利用NanoDrop 2000分光光度计 (Thermo Scientific,USA) 测定浓度及OD260/OD280,琼脂糖凝胶电泳检测RNA完整性。利用HiScript II Q RT SuperMix for qPCR(+ gDNA wiper) (Vazyme,R223-01) 将待测RNA逆转录成cDNA。引物采用Roche LCPDS2软件设计并由北京擎科新业生物技术有限公司合成,引物序列如表1。内参基因为烟草ACTIN基因。利用QuantiFast®SYBR®Green PCR Kit试剂盒 (Qiagen,Germany)在LightCycler®480 Ⅱ型荧光定量 PCR 仪 (Roche,Swiss)上进行反应。体系:2 × QuantiFast®SYBR®Green PCR Master Mix,5 μL;10 μmol/L Forward primer,0.2 μL;10μmol/L Reverse primer,0.2 μL;cDNA,1 μL;Nuclease-free H2O,3.6 μL。PCR 程序:95℃ 5 min;95℃ 10 s,60℃ 30 s,40 个循环。循环结束后利用熔解曲线检测产物特异性:从60℃缓慢升温至97℃,每℃采集5次荧光信号,引物序列见表1。

表1 烟草钾离子通道相关基因引物序列Table 1 Tobacco potassium channel related gene primer sequence
1.4 数据处理
采用Excel 2016进行数据整理和作图,SPSS21.0对数据进行统计分析。
2 结果与分析
2.1 生长素参与不同钾水平下对植株根系生长的影响
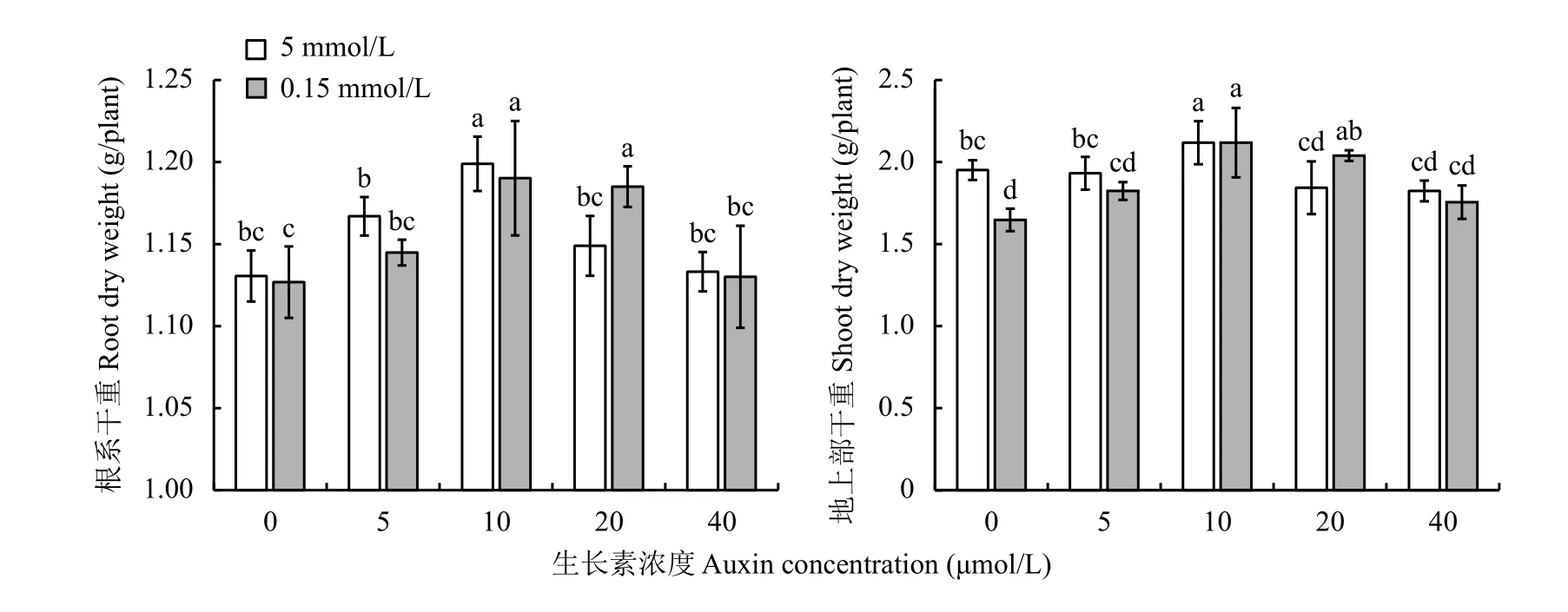
图1 供钾5 mmol/L和0.15 mmol/L水平下外源生长素处理烟草根系及地上部干物质重Fig. 1 Root and aboveground dry matter weight of tobacco plant as affected by different exogenous auxin concentrations under treatments of K 5 and 0.15 mmol/L
2.1.1 植株根系及地上部干物质重 如图1所示,正常供钾水平下植株根系和地上部干物质累积量整体高于低钾水平,其中在生长素浓度为0 μmol/L时,地上部干重差异显著。添加生长素以后,无论正常供钾或是低钾条件下,随着外源生长素浓度的增加,根系和地上部干重均呈现先升高后降低的趋势,且均在生长素浓度为10 μmol/L时达到最大值,其中地上部干重在生长素浓度为10 μmol/L时与其余处理差异达到显著水平 (P〈 0.05)。
2.1.2 植株根系扫描特征 由表2可知,正常供钾水平下各项指标 (总根长、根总体积、根总表面积、根投影面积、根平均直径、根尖数、根分叉数、根交叠数) 数值均明显高于低钾水平相应处理,且大部分差异达到显著水平 (P〈 0.05),其中在生长素浓度为0 μmol/L的条件下,正常供钾植株根尖数高达低钾植株的4.38倍;在生长素浓度为5 μmol/L的条件下,正常供钾植株根系总长度高达低钾植株的2.38倍,根系总体积可达低钾植株的2.91倍,说明低钾胁迫显著影响植株根系的生长发育。在正常供钾条件下,各项根系指标随着外源生长素浓度的增加变化规律表现不一致,且趋势不明显。但在低钾条件下,根系的总长度和根尖数均表现出随着外源生长素浓度的增加先增加后降低的趋势,且均在外源添加生长素浓度为10 μmol/L时达到最高且与其余处理相比差异达到显著水平 (P〈 0.05),根平均直径的变化规律与其正好相反,其他几项指标变化规律呈波浪线趋势。
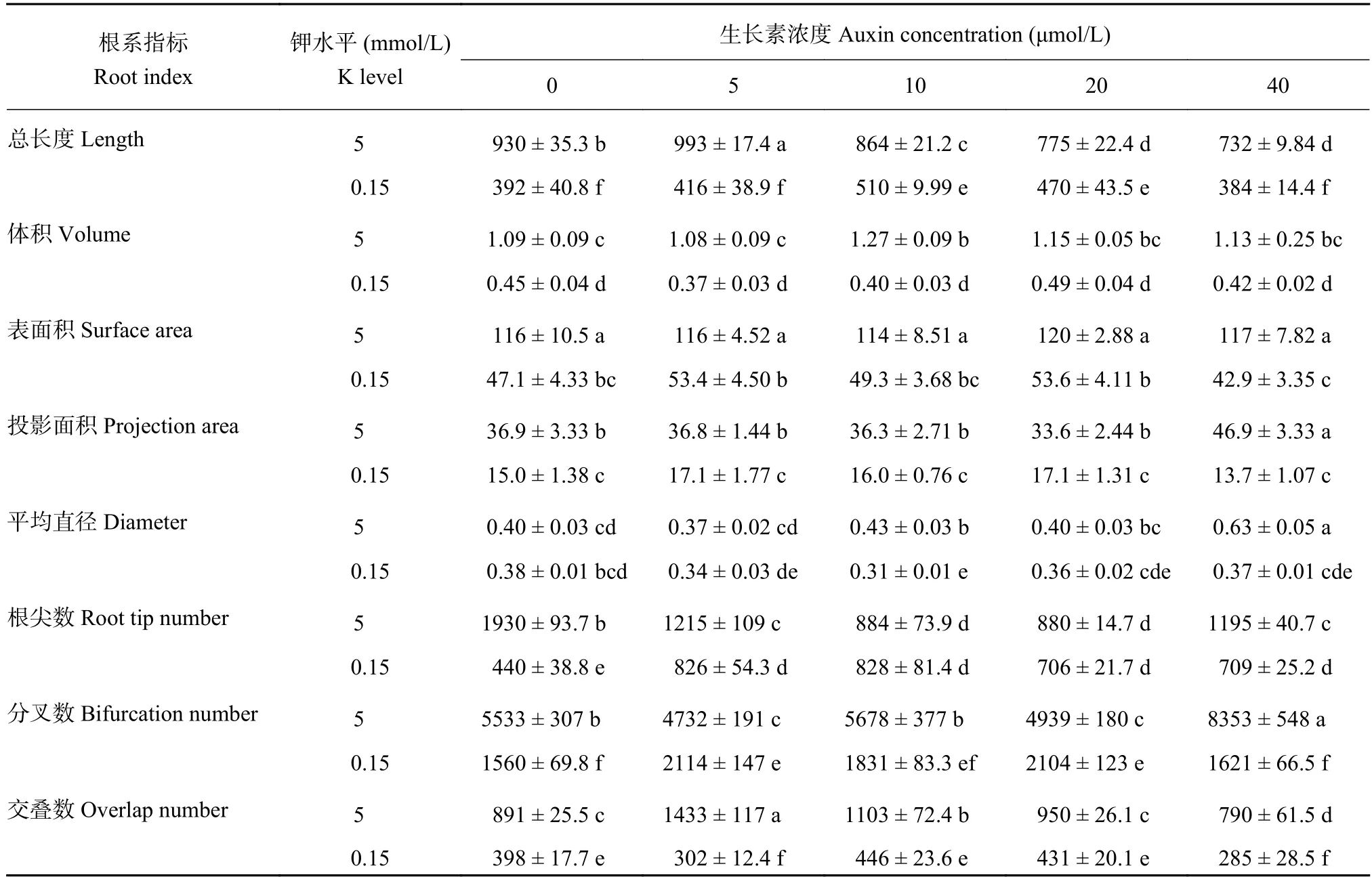
表2 供钾5 mmol/L和0.15 mmol/L水平下外源生长素处理的烟草植株根系扫描特征Table 2 Root scanning characteristics of exogenous auxin treated tobacco plants under treatments of K 5 and 0.15 mmol/L
2.1.3 植株根系生理特征 如图2-a所示,未添加生长素时,正常供钾与低钾植株根系活力差异不显著。添加生长素以后,在常钾条件下,随着外源生长素浓度的增加,根系活力呈先减少后增加又减少再增加的波浪型趋势。低钾情况下,根系活力随着所添加生长素浓度的增加呈先增加后降低的单峰变化趋势,其中在生长素浓度为10 μmol/L时达到最大,且为不添加生长素处理的3.3倍,与低钾其他处理差异达到显著水平 (P〈 0.05)。
如图2-b所示,在未添加外源生长素的情况下,常钾植株ATPase活性显著高于低钾处理,说明低钾胁迫可降低植株根系质膜ATPase的活性。添加外源生长素以后,低钾水平植株ATPase活性整体高于正常供钾水平,且随着生长素浓度升高,正常供钾条件烟株根系ATPase活性表现为先降低后增加后又降低的波浪型趋势;低钾条件下根系ATPase活性表现为先增加后降低的单峰型趋势,在生长素浓度为10 μmol/L时达到峰值,为不添加生长素处理的1.89倍,且与低钾其余处理间差异达到显著水平 (P〈 0.05)。
由图2-c可知,除了外源生长素浓度为40 μmol/L时,其他生长素浓度条件下,低钾水平可溶性蛋白含量均高于常规钾水平处理,说明低钾胁迫仍可刺激根系的代谢活动。无论正常供钾或是低钾条件下,随着外源生长素浓度的增加,植株根系中可溶性蛋白含量都呈现为先增加后降低的趋势,其中常钾植株在生长素浓度为10 μmol/L时可溶性蛋白含量达到最大值,低钾植株在生长素浓度为5 μmol/L可溶性蛋白含量达到最大值,且与低钾其他处理相比差异达到显著水平 (P〈 0.05)。
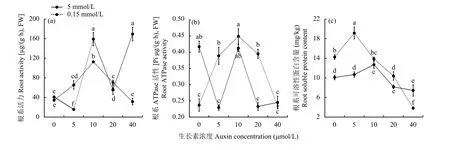
图2 供钾5 mmol/L和0.15 mmol/L水平下外源生长素处理烟草根系生理特征Fig. 2 Physiological characteristics of roots of exogenous auxin treated tobacco plants under treatments of K 5 and 0.15 mmol/L
2.1.4 植株各部位内源生长素浓度分布特征 如图3-a所示,在主根尖内源生长素中,除了外源生长素浓度为20 μmol/L外,其他4个外源生长素浓度条件下,低钾水平根尖内源生长素浓度均高于正常供钾水平。无论正常供钾或是低钾条件下,随着外源生长素浓度的增加,主根尖内源生长素浓度整体呈现增加的趋势,且均在外源生长素浓度为40 μmol/L时达到最大值28.39和20.57 ng/g, FW。
由图3-b可知,在侧根尖内源生长素中,添加不同浓度的外源生长素后,低钾水平侧根尖内源生长素浓度均高于正常供钾水平。无论正常供钾或是低钾水平,添加生长素以后,侧根尖内源生长素均表现出增加趋势,其中在生长素浓度为0~20 μmol/L时变化不大,在生长素浓度为20~40 μmol/L时内源生长素浓度迅速增加达到最大值且与其余处理间差异达到显著水平 (P〈 0.05)。
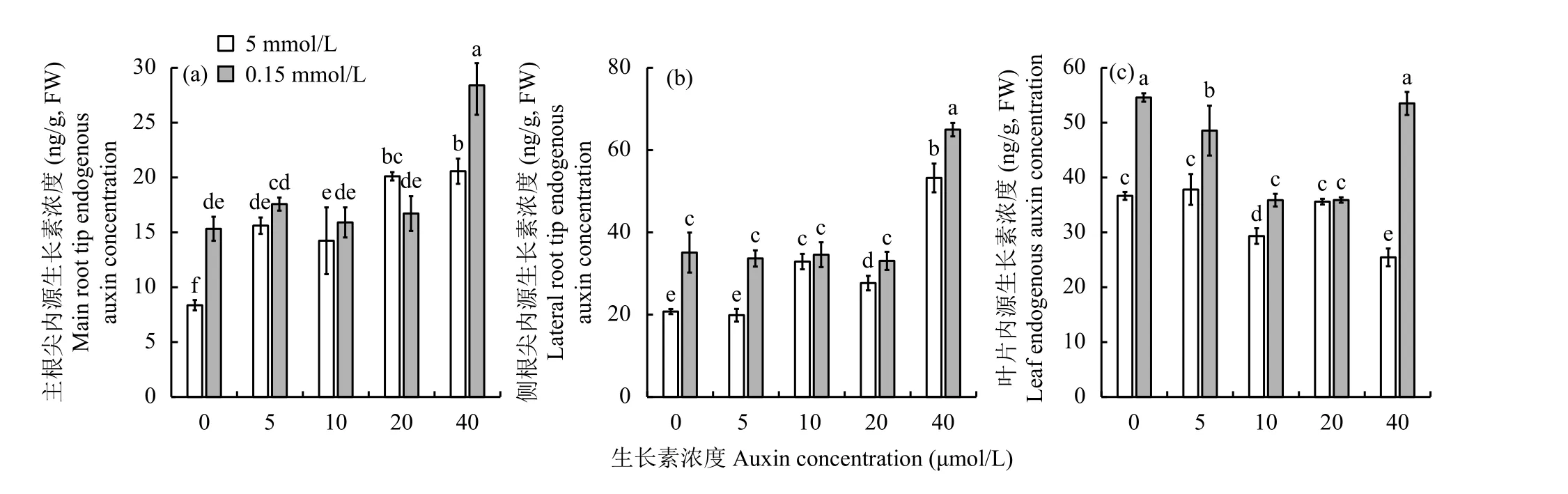
图3 供钾5 mmol/L和0.15 mmol/L水平下外源生长素处理植株各部位内源生长素浓度Fig. 3 Endogenous auxin concentration in various parts of exogenous auxin-treated tobacco plants under treatments of K 5 and 0.15 mmol/L
由图3-c可知,在叶片内源生长素中,低钾水平下叶片内源生长素浓度整体均高于正常供钾水平。正常供钾水平下,随着外源生长素浓度的增加,叶内源生长素浓度表现为先降低后增加又降低的规律;低钾水平下,在外源生长素浓度为0~10 μmol/L时,叶内源生长素浓度呈现降低趋势,在生长素浓度为10 μmol/L时最低,为35.88 ng/g, FW,之后随着外源生长素浓度的升高,叶片内源生长素浓度开始升高。
2.2 不同钾水平下生长素对植株体内钾素吸收的影响
2.2.1 植株各部位钾素浓度 由表3可知,钾水平、生长素浓度以及两者互作3个因素均对植株各部位钾素浓度有显著影响,对钾素的贡献率分别达到了83.9%、3.50%、12.5%,说明钾水平对植株各部位钾素浓度起着关键作用,其次是两者互作,最后是生长素浓度。
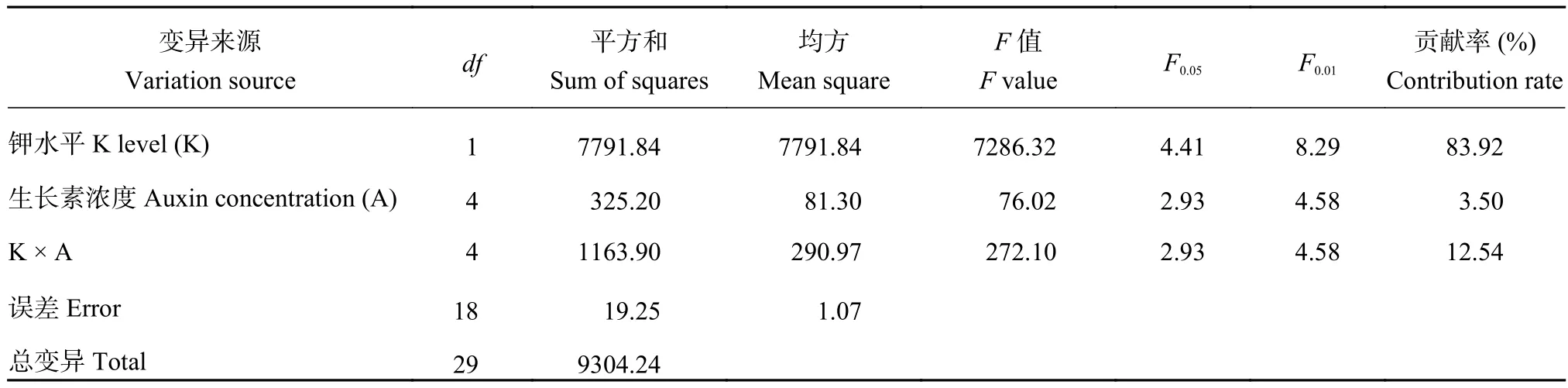
表3 钾水平和生长素浓度对植株各部位钾素浓度影响的方差分析Table 3 Variance analysis of potassium level and auxin concentration on potassium concentration in various parts of plants
如图4所示,无论是在根系还是叶片中,正常供钾条件下其钾素浓度均显著高于低钾水平 (P〈 0.05)。在根系中,随着生长素浓度的增加,正常供钾植株根系钾素浓度表现为持续降低趋势;低钾植株根系钾素浓度表现为先增加后降低的趋势,其中在生长素浓度为10 μmol/L时达到最大值14.21 mg/g且与其他处理差异达到显著水平。在叶片中,正常供钾条件下,当生长素浓度为0~10 μmol/L时,其钾素浓度变化不大,在生长素浓度为10~20 μmol/L时,其钾素浓度迅速降低,之后随着生长素浓度的增加,其钾素浓度又缓慢升高;而低钾植株叶片钾素浓度表现为先缓慢升高又缓慢降低的趋势,其中在生长素浓度为10 μmol/L时达到峰值38.7 mg/g。
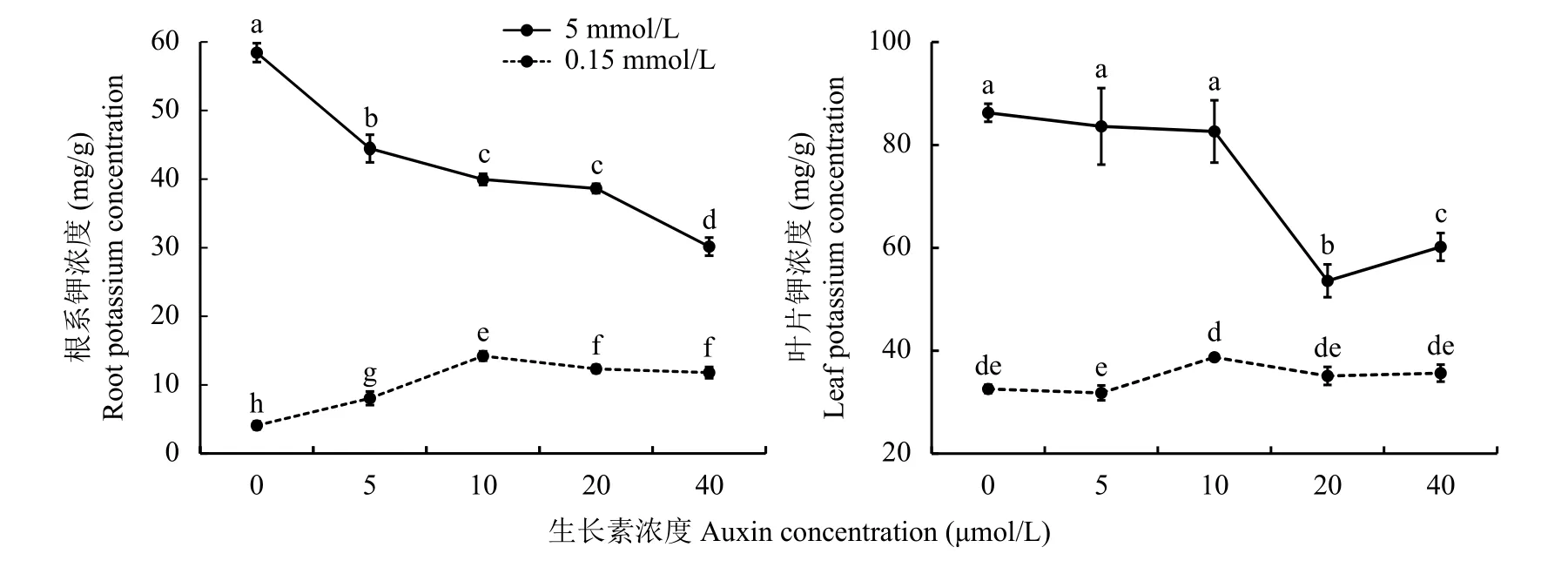
图4 供钾5 mmol/L和0.15 mmol/L水平下外源生长素处理植株根系和叶片钾浓度Fig. 4 Potassium concentration in various parts of plants treated with exogenous auxin under treatments of K 5 and 0.15 mmol/L
2.2.2 植株根系钾吸收动力学特征差异 根系钾吸收动力学参数Vmax和Km用来定量表征根系吸钾特征,Vmax表示植物对钾离子的最大吸收速率,其值越大,表示植株对钾离子的吸收能力越强[20];Km表示植株对钾离子的亲和力,其值越大,亲和力越低[21]。在测定各部位钾素浓度的基础上,进一步研究了烟株根系对钾素吸收的动力学参数。结果表明 (表4),正常供钾水平下根系动力学参数值均明显高于低钾水平。随着生长素浓度的升高,正常供钾和低钾条件下根系Vmax均表现为先升高后降低的趋势,其中正常供钾在生长素浓度为5 μmol/L时达到峰值,为不添加生长素处理的2.26倍,低钾在生长素浓度为10 μmol/L时达到峰值,为不添加生长素处理的1.94倍,且差异达到显著水平 (P〈 0.05);Km在正常供钾时表现为持续降低趋势,在低钾时表现为先降低后升高的趋势,在生长素浓度为10 μmol/L时达到最小值。
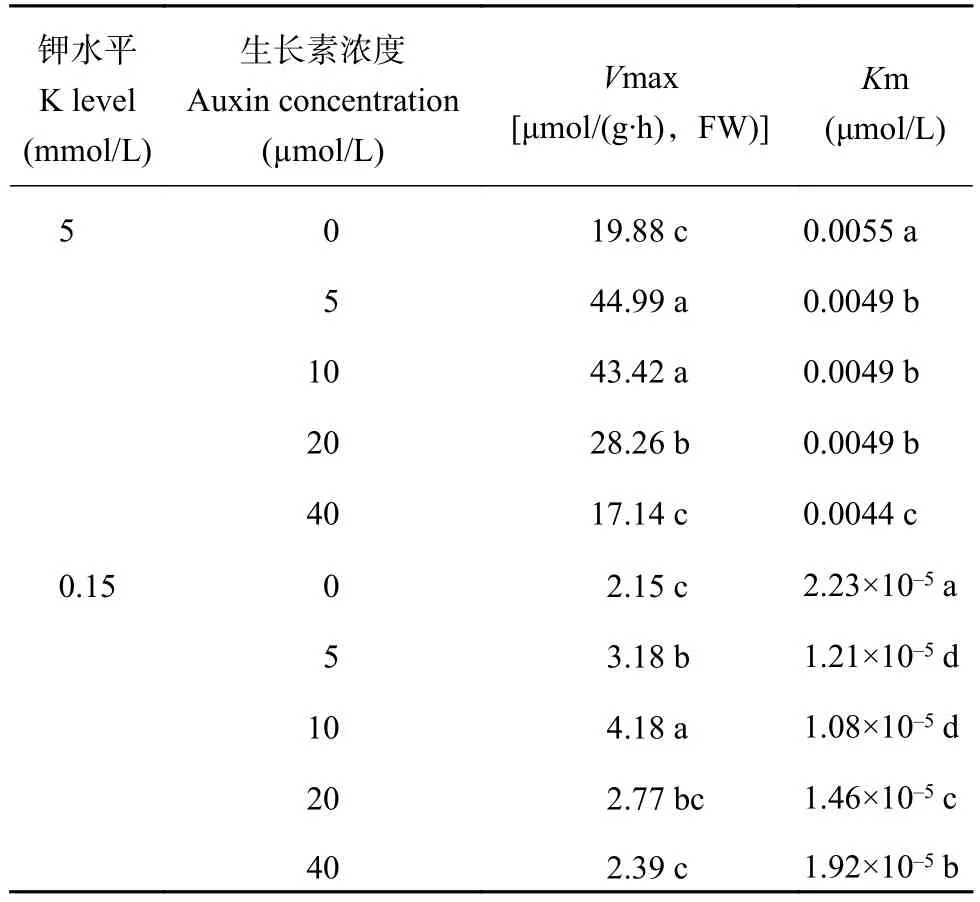
表4 植株根系钾吸收动力学特征差异Table 4 Difference of kinetics of potassium absorption in plant root
2.2.3 植株体内相关钾离子通道基因表达量检测从图5-a, b可知,NKT2基因在植株根系中的表达量整体高于叶片,且低钾水平下NKT2基因的表达量普遍高于正常供钾水平,随着生长素浓度的提高,根系和叶片中基因NKT2的表达量整体呈现先增加后降低的趋势。在根系中,正常供钾和低钾条件下,NKT2基因的表达量均在外源生长素浓度为10 μmol/L时达到峰值,其中此时低钾条件下NKT2基因的表达量相对于低钾无添加生长素增加了6.83倍,显著高于其他各处理。叶片中,正常供钾条件下NKT2基因的表达量在生长素浓度为10 μmol/L时达到最大值;低钾条件下在生长素浓度为5 μmol/L时达到最大值,且显著高于其余各处理 (P〈 0.05)。
从图5-c, d可知,随着生长素浓度的增加,根系和叶片中NtKC1基因的表达量整体表现为先增加后降低的趋势。在根系中,正常供钾水平下各处理NtKC1基因的表达量均高于相应低钾水平;相对于正常供钾无添加生长素处理,低钾水平下各处理该基因的表达量均降低。正常供钾条件下,NtKC1基因的表达量在生长素浓度为20 μmol/L时达到最大值;低钾条件下在生长素浓度为10 μmol/L时其值最高。在叶片中,正常供钾条件下,在生长素浓度为10 μmol/L时NtKC1基因的表达量与无添加生长素时水平相当,生长素浓度为20 μmol/L时NtKC1基因表达量最高;低钾条件下,NtKC1表达量在生长素浓度为10 μmol/L时达到最大值。
Ntork1属于外流型钾离子通道基因。从图5-e,f可知,无论是根系还是叶片,正常供钾水平下各处理Ntork1基因的表达量均高于低钾水平各相应处理,且相对于正常供钾无添加生长素处理,低钾水平下植株Ntork1基因的表达量均降低;随着生长素浓度的升高,根系和叶片中Ntork1基因的表达量整体呈现先降低后增加的趋势,且无论正常供钾或是低钾,该基因的表达量均在生长素浓度为10 μmol/L时达到最低值同时差异达到显著性 (P〈 0.05)。
3 讨论
3.1 外源生长素对不同钾水平下植株根系生长及各部位内源生长素浓度的影响
根系是植物吸收矿质营养元素的主要部位,研究表明,外界供钾水平的高低显著影响烟株根系及地上部生长发育和干物质累积。在正常供钾水平下各组织干物质累积量高于低钾水平,说明低钾胁迫影响干物质在植株中的累积,不利于根系的发育,这与代晓燕等[22-23]的研究结果一致。洪丽芳等[11]、代晓燕等[24]、刘世亮等[25]研究表明,打顶后叶面外施植物生长调节剂或生长素类物质可增加烟叶干物质累积量,这与本试验中不同供钾水平下添加外源生长素改善烟株生长状况的结果相一致。此外,本试验还发现,在正常供钾和低钾条件下,当添加外源生长素浓度为10 μmol/L时,可明显提高烟株根系及地上部干物质重,改善烟株生长发育状况。这说明通过根系添加生长素类物质也可调控植株根系生长,与以前研究发现打顶时叶面外施生长素的作用一致。
植物根系结构的可塑性 (尤其是侧根) 是植物进化过程中对根际环境胁迫的一种适应机制。植物在面临各种根际环境时会持续地改变其根系构型,主要是侧根的数量和长度。Dubrovsky等[26]发现当拟南芥根系维管柱细胞生长素浓度降低时,拟南芥侧根的萌发和伸长都受到抑制。研究表明,拟南芥在低钾胁迫下,根系的生长会发生变化,而这与低钾胁迫下植物激素的变化有关,根系中大量累积的生长素抑制植物主根生长[9],这与本试验中低钾胁迫条件下根系的发育状况一致,WinRHIZO软件分析也表明正常供钾水平各项指标数值均显著高于低钾水平处理,说明低钾胁迫在一定程度上抑制了根系的伸长,不利于根系的生长发育。但是其中在外源生长素浓度为20 μmol/L时,正常供钾与低钾条件下植株根系各项扫描指标与根系干重表现出相矛盾的关系,研究认为这种情况可能是由于低钾条件下,添加特定浓度的生长素可能会影响植株内部某种机制,从而对低钾植株的干物质累积量及含水率有影响,虽然根系扫描各指标值较低,但其干物质积累量却不少。对于这种特殊情况也是以后工作中我们需要继续探讨和有待于证实的问题。在低钾条件下,施加生长素浓度为10 μmol/L时根系的长度、根尖数和根交叠数达到峰值,说明外施一定浓度的生长素浓度能够缓解低钾胁迫,有利于根系伸长,并增加侧根数量,增大根系体积和吸收面积。
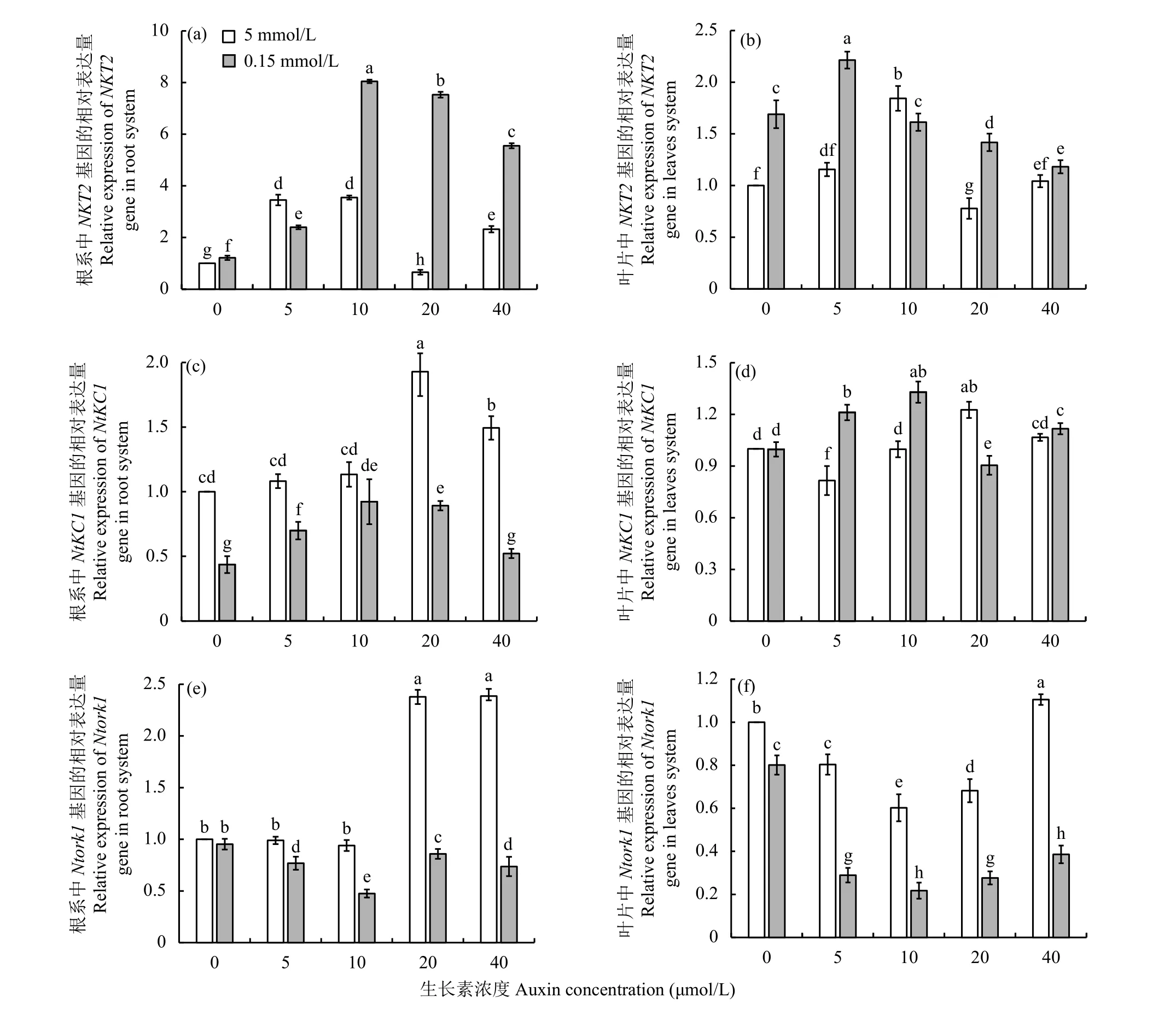
图5 供钾5和0.15 mmol/L水平下外源生长素处理的烟草植株钾离子通道基因相对表达量Fig. 5 Relative expression levels of potassium channel genes in exogenous auxin-treated tobacco plants under treatments of K 5 and 0.15 mmol/L
根系活力表征根系的代谢状况,是反映根系吸收营养元素和水分的重要指标,根系活力愈强,代表根系吸收能力越强,提供给植株地上部的养分和水分也越多[27]。本试验研究证明,在不添加生长素时,正常供钾植株根系活力值高于低钾植株。低钾水平下,通过添加适当浓度的生长素可提高根系活力,提高根系的钾素吸收能力。根系ATP酶的活性影响质子跨膜运输,进而影响植株根系对矿质养分的吸收,是表示根系代谢强度的重要指标[28]。杨铁钊等[15]研究表明,低钾胁迫条件下可降低植株根系ATP酶的活性,不利于质子跨膜运输,对养分的吸收产生阻碍作用,本试验结果与其一致,在低钾条件下,根系ATP酶的活性显著低于正常供钾水平 (P〈0.05)。但是,在添加不同浓度的外源生长素以后,低钾根系ATP酶的活性反而高于相应正常供钾水平,且在生长素浓度为10 μmol/L时酶活性最高,说明在低钾条件下可通过适当添加外源生长素来改善根系ATP酶的活性,进而调控植物根系对矿质养分的吸收。根系可溶性蛋白主要由根系中的酶组成,可溶性蛋白含量增加是根系活性增强的基础。从根系可溶性蛋白含量上来看,低钾条件下可溶性蛋白含量整体高于常规供钾处理,说明低钾胁迫仍可刺激根系的代谢活动。其中正常供钾植株在生长素浓度为10 μmol/L时可溶性蛋白含量达到最大值,低钾植株在生长素浓度为5 μmol/L时达到最大值,且差异达到显著水平。综合而言,低钾胁迫可刺激植株根系中可溶性蛋白含量的增加,且无论正常供钾还是低钾情况下,外源添加生长素对植株根系可溶性蛋白含量均有一定的改善作用。
Ma等[29]在进行低钾胁迫下水稻转录组分析中发现,在33个植物激素中有22个与生长素相关的基因发生了显著变化,以上这些研究都说明在植物中生长素和钾素营养有着关联。钾素水平影响植物体内生长素的分布,在不同钾素水平下烟株体内生长素的分布也表现出一定的规律性。本试验中,无论是主根尖、侧根尖还是叶片中,添加不同浓度外源生长素后,低钾植株内源生长素浓度整体高于相应正常供钾条件,说明低钾胁迫可刺激植物激素生长素的合成,促进各部位对生长素的累积。添加外源生长素以后,低钾植株主根尖及侧根尖内源生长素浓度在外源生长素浓度为0~20 μmol/L范围内变化不大;叶片内源生长素浓度在外源生长素浓度为10 μmol/L时达到最小值,同时与正常供钾无添加生长素达到相同水平,说明低钾条件下过高的内源生长素浓度可能抑制了叶片及植株的生长,添加一定浓度的外源生长素以后,在一定程度上缓解了高浓度的抑制作用,促进烟株生长发育,这与上面研究一系列结果基本一致。正常供钾水平下添加外源生长素以后,除了叶片内源生长素有略微降低趋势以外,其余部位内源生长素浓度均增加。所以在正常供钾和低钾水平下,适当添加外源生长素可增加相应部位内源生长素浓度,促进植株生长发育。
3.2 外源生长素对不同钾水平下植株体内钾素吸收的影响
代晓燕等[24]和洪丽芳等[11]研究表明,打顶后在烟株顶端涂抹生长素也能够提高烟草叶内的钾素含量,其是在顶端调控条件下进行,本试验采用根系调控的方法与其得出相同的结论。研究发现,低钾条件下施加生长素浓度为10 μmol/L时,根系和叶片钾素浓度均达到最大值,说明低钾条件下通过适当添加外源生长素可以提高烟株整株的钾含量,而生长素同样也影响着烟株钾素的累积分布。而在正常供钾条件下,施加外源生长素以后,根系和叶片中的钾素浓度均表现为不同程度的降低,这可能与其内源生长素浓度的变化有关,其机理还需进一步研究探讨。
用根系钾吸收动力学参数更能进一步定量描述植株根系对养分的吸收情况。Vmax值越大,表示植株对钾离子的吸收速率越大,对钾离子的吸收能力越强,Km越小,表示对钾离子的亲和力越高。结果表明 (表4),正常供钾情况下,在生长素浓度为5 μmol/L时,烟株的Vmax表现最大,高达生长素浓度为0 μmol/L时的2.26倍;Km则表现为持续降低趋势,这可能是由于苗龄的影响。低钾情况下,当生长素浓度为10 μmol/L时烟株Vmax值最大而Km值最小,表示对钾离子的吸收和亲和力最强。由上可知,无论正常供钾还是低钾条件下,施加适当浓度的生长素可以提高植株对钾离子的吸收能力,进而提高植株钾含量。
同时,本研究进一步分析了烟草相关的钾离子吸收转运关键基因NKT2、NtKC1、Ntork1的表达情况。NKT2主要负责参与转运K+的作用,它能调控韧皮部细胞膜电压,和NKT1基因一起分担叶内细胞K+的渗透。本试验中,无论根系还是叶片,低钾水平下NKT2的相对表达量整体高于正常供钾水平下。正常供钾水平下,在外源生长素浓度为10 μmol/L时,根系和叶片中NKT2的相对表达量最高,说明适当添加了生长素后对提高钾素的运输来说还是有利的,低钾条件下也几乎符合此规律。拟南芥中的AtKC1基因主要在根毛区和根的内皮层中表达,是根毛钾离子吸收通道的重要组成单位,本试验中,正常供钾情况下在外源生长素浓度为20 μmol/L时各部位NtKC1的相对表达量最高,而低钾情况下在外源生长素浓度为10 μmol/L最高,说明在不同的钾水平下,可添加不同的生长素来提高根系钾素运输。Ntork1基因主要在叶片保卫细胞和根表皮木质部薄壁细胞中表达,属于外流型钾离子通道,本试验中无论正常供钾还是低钾,其表达量均在外源生长素浓度为10 μmol/L的最低,因为其属于外流型钾离子通道,所以说明在正常和低钾条件下添加10 μmol/L的外源生长素可有效抑制钾离子的外流,从而提供烟株体内钾离子浓度。
植物对K+的吸收通过高亲和系统[低外部K+浓度(1~200 μmol/L),通过钾转运蛋白主动运输]和低亲和系统[高外部K+浓度 (1~10 mmol/L),通过钾离子通道被动运输]进行。本试验主要研究低钾胁迫即高亲和系统,钾离子通道是钾离子吸收的其中一个途径。孙小茗[30]研究表明,在外源K+浓度为5 mmol/L时,将通道抑制后,K+的跨细胞膜转移过程有很大一部分是通过载体蛋白组成的高亲和转运系统来完成的。其研究发现,当同时添加通道抑制剂TEA和载体抑制剂NEM后,植物仍然可以吸收部分钾,而且这种情况随介质中钾离子浓度的增加而更趋明显,这种途径很可能就是非选择性离子通道 (NSCCs)[31-32]。说明植株对钾离子的吸收不只是局限于已知的两种机制,且目前对于烟草钾转运蛋白的研究较少,尚不成熟,而对钾离子通道的研究日趋完善,所以本试验对钾离子通道的测定研究具有一定的参考价值和研究意义。
4 结论
1) 在未添加外源生长素条件下,与正常供钾处理相比,低钾胁迫可明显抑制植株根系生长发育及对钾素的吸收累积。
2) 当施用外源生长素以后,随着生长素浓度的升高,正常供钾和低钾植株的根系干重、根系活力、主根尖及侧根尖内源生长素浓度均有增加的趋势,且钾吸收动力学参数Vmax值和NKT2和NtKC1的表达量明显增加。其中低钾植株根系生长状况明显改善,地上地下部钾素浓度提高,Ntork1的表达量降低。
3) 无论正常供钾或是低钾,当添加外源生长素浓度为10 μmol/L时,可明显改善植株根系的生长发育,提高内流型通道基因NKT2和NtKC1的表达量,降低外流型通道基因Ntork1的表达量,提高烟株对钾离子的吸收能力与亲和力,从而增加植株钾含量。

