噻虫胺在马铃薯上的残留及消解动态研究
朱 峰,曾 雪,陈明贵,陈才俊,魏 进,廖国会,龙家寰,段婷婷
(贵州省农业科学院 植物保护研究所,贵阳 550009)
噻虫胺(clothianidin)是新烟碱类广谱杀虫剂,广泛用于甘蔗、韭菜、水稻、小麦及梨树等作物,采用喷雾或土壤处理施药后能快速被植物吸收并传导到各部位,具有良好的内吸作用。
目前,已有文献报道了采用超高效液相色谱-串联质谱法分析噻虫胺在甘蔗[1]、玉米[2]、小麦[3]及水稻[4]中的残留和消解动态;采用高效液相色谱法分析噻虫胺在梨[5]、菠菜[6]、番茄[7]及小白菜[8]中噻虫胺的残留。马铃薯是世界上仅次于小麦、水稻、玉米的第四大作物,我国目前尚无噻虫胺在马铃薯中的最大残留限量值。本研究旨在为噻虫胺在马铃薯上的使用及其在马铃薯中的最大残留限量值的制定提供参考。
1 材料与方法
1.1 试剂与药剂
噻虫胺标准品(98.2%);乙腈(色谱纯、分析纯);无水硫酸镁和氯化钠(分析纯);分散净化剂:N-丙基乙二胺(PSA)、石墨化炭黑(GCB),Agela Technologies公司;无水氯化钙。
1.2 溶液配制
准确称取0.010 1 g(精确到0.000 1 g)噻虫胺标准品,用色谱纯乙腈溶解并定容至100 mL,得质量浓度为100 mg/L的噻虫胺标准品母液,试验时再用色谱纯乙腈按梯度稀释,得到质量浓度分别为0.01、0.05、0.10、0.50、1.00 mg/L的系列标准工作溶液。分别移取1.0 mL系列质量浓度的标准工作溶液,经过氮气吹干后加入1.0 mL空白基质提取液,配制成相应系列浓度的基质匹配标准溶液。配制好的标准工作溶液以及基质匹配标准溶液均在避光条件下存于4℃冰箱中备用。
1.3 主要仪器设备
超高效液相色谱-串联质谱联用仪(UPLCMS/MS,TSQ-Vantage,赛默飞世尔科技公司);Syncronis C18色谱柱(2.1 mm×100 mm,1.7 m,Thermos公司);Milli-Q超纯水;HR飞利浦粉碎机(珠海飞利浦家庭电器有限公司);SK-1漩涡混合器(江苏金坛市中大仪器厂);TG16台式离心机(长沙迈森仪器设备有限公司);Filter Unit滤膜(0.22 m);十万分之一电子天平等。
1.4 样品前处理方法
称取10 g样品于50 mL离心管中,每个添加水平设置5个重复;在样品中分别添加1 mL 0.1 mg/kg、0.3 mg/kg、3.0 mg/kg的噻虫胺标准品溶液,即添加水平为0.01 mg/kg、0.03 mg/kg、0.30 mg/kg;室温条件下静置30 min;加入5 mL水、10 mL 0.1%乙酸乙腈溶液进行提取,振荡10 min;加入1 g NaCl和4 g无水MgSO4,振荡10 min,离心5 min;取上清液1.5 mL加入到装有50 mg PSA+150 mg MgSO4的离心管中,涡旋1 min,4 000 r/min下离心10 min,取上清液过膜,待测。
1.5 色谱检测条件
质谱检测条件:电喷雾ES(+)模式;毛细管电压4.0 kV;离子源温度150℃;去溶剂温度350℃;去溶剂气流量600 L/h;锥孔气流量50 L/h;其他质谱参数见表1。

表1 质谱参数
进样体积:5.0 μL;流速:0.30 mL/min;采用0.10%甲酸水溶液(A)和甲醇(B)组成的流动相进行梯度洗脱。洗脱程序:0~1.5 min,80%(A);1.5~2.0 min,80%→20%(A);2.0~4.5 min,20%(A);4.5~5.0 min,20%→80%(A);5.0~6.0 min,80%(A)。
1.6 田间残留试验
试验时间为2017—2018年,试验地点在贵州省和黑龙江省。供试药剂为0.2%噻虫胺颗粒剂。供试作物为马铃薯,威芋5号。小区面积为30 m2。药剂在马铃薯栽种前施用1次,设置2个药剂浓度:低有效成分施用量为600 g/hm2、高有效成分施用量为900 g/hm2。马铃薯植株1/2大小时开始取样,取样时间为2 h、1 d、3 d、7 d、14 d、21 d、30 d。采用撒施或沟施,将药剂均匀施于种植沟内,施药后覆土。
采样方式和采样数量按照《农作物中农药残留试验准则》操作进行。样品保存于-20℃,待测。马铃薯茎秆用于残留动态试验,马铃薯用于药剂最终残留试验。
1.7 方法的线性关系、灵敏度和基质效应测定
分别取0.005、0.05、0.1、0.5、1.0和5.0 mg/L 6个质量浓度的标准工作溶液和基质匹配标准溶液,按1.5中条件进样检测。以进样样品质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得到线性回归方程及相关系数(r)。以方法的最低检测浓度为定量限(LOQ)。

当ME>1.1时,表现为基质增强效应;当ME<0.9时,表现为基质减弱效应;当0.9<ME<1.1时,则基质效应可以忽略[9]。
2 结果与分析
2.1 前处理条件的优化
考察了不同比例的净化剂,结果表明30 mg PSA+50 mg无水MgSO4净化马铃薯块茎效果较好,30 mg C18+20 mg GCB+50 mg无水MgSO4净化马铃薯茎秆较佳。分析方法典型色谱图见图1、图2。此外,采用0.2%冰乙酸+乙腈为提取剂,如表2所示。方法添加回收率为71%~98%。

图1 马铃薯基质色谱图

图2 马铃薯茎杆基质色谱图
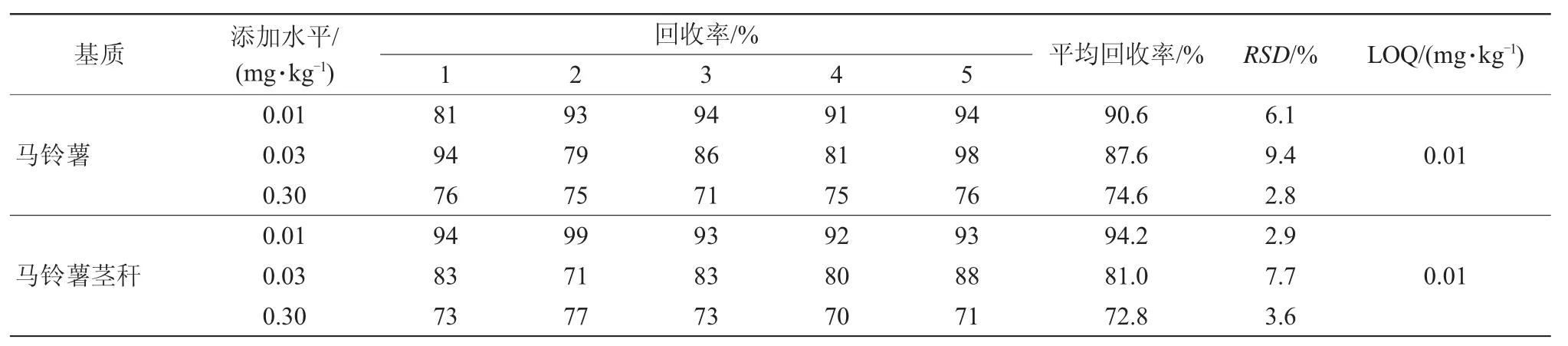
表2 添加回收率试验结果
2.2 方法的准确度、精确度及基质效应
采用乙腈为提取剂,噻虫胺的添加回收率偏低,采用0.2%冰乙酸+乙腈为提取剂,噻虫胺添加回收率较高,RSD为2.8%~9.4%,定量限为0.01 mg/kg。马铃薯基质线性方程为y=78 375x-125 979,R2=0.843 3,ME为0.92。马铃薯茎秆线性方程为y=101 948x-164 487,R2=0.853 8,ME值为1.14。测定噻虫胺在马铃薯茎秆中的残留量时,存在一定的基质增强效应。因此,本研究中采用基质标匹配外标法来消除基质效应的影响。
2.3 残留动态试验结果
本研究中,采用沟施法施药,噻虫胺在马铃薯茎杆中残留试验结果见表3。噻虫胺在贵州马铃薯茎秆中的残留量较高,达到1.41 mg/kg,半衰期为69.3 d;药后30 d,噻虫胺在黑龙江马铃薯茎秆中的残留量最高仅有0.01 mg/kg,半衰期为7.7 d。
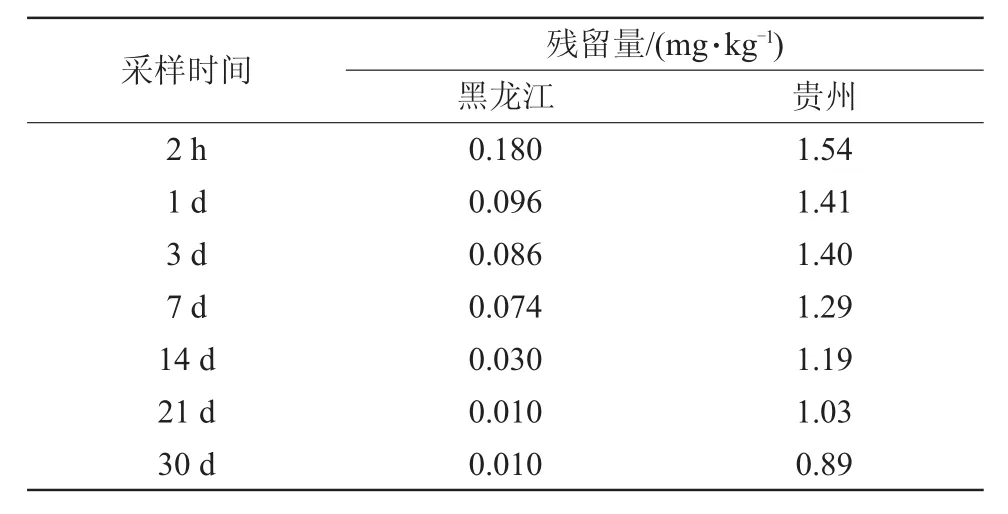
表3 噻虫胺在马铃薯上残留动态试验结果
2.4 最终残留试验结果
在马铃薯收获期时,贵州和黑龙江噻虫胺在马铃薯中的最终残留量分别为0.017 mg/kg和0.025 mg/kg。噻虫胺在马铃薯上的最大残留限量欧盟标准为0.03 mg/kg,其日本标准为0.25 mg/kg,其美国标准为0.05 mg/kg,我国尚无相应的国家标准,因此,采用土壤施药法,噻虫胺在马铃薯上的使用的安全风险较低。
3 结论与讨论
建立了同时测定噻虫胺的UPLC-MS/MS分析方法。结果表明,噻虫胺在马铃薯中的平均回收率为70%~98%,RSD为2.8%~9.4%,LOD和LOQ均为0.01 mg/kg,测定方法能够满足噻虫胺在马铃薯中残留研究的分析要求。
采用高效液相色谱法,研究了噻虫胺在贵州和黑龙江不同海拔地区玉米及土壤中的残留动态,结果表明,噻虫胺在贵州和黑龙江马铃薯中的半衰期分别为69.3 d和7.7 d;噻虫胺颗粒剂施用方法和传统的喷雾方法不同,土壤沟施后在整个生长期中都能在马铃薯茎秆中检测到噻虫胺,噻虫胺在黑龙江马铃薯茎秆中的含量高于0.89 mg/kg,能够满足生长期对害虫的防治。最终残留试验结果显示,马铃薯中的噻虫胺含量为0.027~0.076 mg/kg。因此,采用土壤施药后,噻虫胺能够被快速吸收至马铃薯植株的其他部分,而累积在马铃薯中的噻虫胺较少。此外,国外噻虫胺最大残留限量值均高于0.25 mg/kg,且欧盟拟将噻虫胺在马铃薯上的最大残留限量从0.03 mg/kg修订为0.3 mg/kg,因此在马铃薯上使用噻虫胺防治害虫较为安全,风险性较小。

