连续流动法快速测定基因编辑素材中淀粉含量
黄海涛,许 永,王 晋,刘 欣,孔维松,杨叶昆,李雪梅,杨光宇,张承明,李 晶
云南中烟工业有限责任公司技术中心,昆明市高新区科医路41 号 650106
淀粉是高等植物中碳水化合物贮藏的主要形式,成熟的新鲜烟叶中淀粉含量高达40%。与其他植物相比,新鲜烟叶中的淀粉只是碳水化合物的暂时贮存形态。烟叶经调制、发酵后,淀粉大部分转化为小分子碳水化合物,而小分子碳水化合物在卷烟燃吸过程中会裂解产生酸性物质,这些酸性物质在中和含氮化合物燃烧过程中产生的碱性物质方面发挥重要作用,因此,要提高烤烟的感官品质必须平衡好烤烟烟叶中淀粉含量与烟碱、含氮化合物含量之间的关系。鉴于适宜的淀粉含量对卷烟香气和吸味品质的重要性[1-4],准确测定烤烟烟叶中的淀粉含量对于烟叶和卷烟产品的品质评价具有重要意义。
目前烟草样品中淀粉含量的测定方法主要有分光光度法[5-6]、连续流动分析法[7-11]、高效液相色谱法[12]、离子色谱法[13]、近红外光谱法[14]等。采用高效液相色谱法和离子色谱法测定烟草中的淀粉时,需要先脱除烟草样品中的水溶性糖,然后用酸或酶将淀粉水解为单糖进行测定,并将单糖含量换算为淀粉含量;这两种方法的水解过程操作繁琐、耗时长,不适合于大批量烟草样品中淀粉含量的测定。连续流动分析法操作简便、快速,目前已成为烟草行业广泛应用的标准方法YC/T 216—2013[9](简称标准方法)。然而,连续流动分析法的样品前处理操作步骤仍然较繁琐,不利于批量样品的分析。
随着烟草行业基因编辑工厂化育种工作的启动,在育种过程中通过基因编辑技术会产生数万个素材,现有的分析方法难以满足这些海量素材的化学分析和评价需求。因此,对烟草淀粉测定的样品前处理方法进行了改进,通过设计一种无需样品转移即可实现去除干扰成分、萃取和过滤的样品萃取瓶并将其作为前处理装置,建立基于连续流动法快速测定基因编辑素材中淀粉含量的方法,旨在为大量基因编辑素材淀粉含量的测定提供技术支撑。
1 材料与方法
1.1 材料、试剂和仪器
烤烟(云南玉溪,C3F 等级)、白肋烟(湖北恩施、C2F 等级)、香料烟(云南保山、AB 等级);基因编辑素材(分苗期、团棵期、旺长期、成熟期4 个阶段采样)。
本实验中所用试剂均参照标准方法中所述方案进行配制,除特殊说明外,所用试剂均为分析纯或以上级别。
AL204 型电子天平(感量0.000 1 g,瑞士Mettler Toledo 公司);KR-934CFS 型超声波发生器(东莞市铠瑞超声自动化科技有限公司);样品萃取瓶(本项目组设计);AA3 型连续流动分析仪(德国Bran+Luebbe 公司),由取样器、比例泵、渗析器、螺旋管、比色计(配570 nm 滤光片)等部件组成,管路组成见图1。
1.2 方法
1.2.1 样品萃取瓶设计
本项目组设计了适合于连续流动分析仪的样品萃取瓶,改进的样品萃取瓶见图2。该样品萃取瓶由外套管(图2a)和带20 µm 过滤筛板及密封圈的内套管(图2b)组成。萃取瓶外套管的内径为3.0 cm,高度为8.0 cm;内套管外径为2.9 cm,长度为10.0 cm;密封圈厚度为0.6 mm,其与外套管形成密封。使用前先检验萃取瓶密封性,以0.13~0.15 MPa(约1.3~1.5 倍大气压)下密封圈处不漏液为合格。该样品萃取瓶可重复使用,每次使用完毕后清洗干净并晾干,即可再次使用。
1.2.2 标准溶液配制
烟草中的淀粉由直链淀粉和支链淀粉构成,一般认为二者的比例为2∶8,在实际样品测定中,标准溶液中直链和支链淀粉的比例直接影响测定结果,因此本研究中采用直链淀粉与支链淀粉的比例为2∶8 配制标准溶液。标准储备液和工作溶液的具体配制参照标准方法[9]。
1.2.3 样品处理与分析

图1 淀粉检测的流动分析仪管路系统Fig.1 Pipelines of continuous flow analyzer for starch detection

图2 改进的连续流动分析仪样品萃取瓶及操作过程Fig.2 Sample extraction vial and operation process of modified continuous flow analyzer
将成品烟叶样品于40 ℃下干燥2 h,粉碎并过425 μm(40 目)筛;将新鲜烟叶样品采样冷冻干燥24 h,粉碎并过筛。称取0.25 g 样品,加入萃取瓶外套管中(图2a);将外套管放置于试管架上,加入25 mL 80%乙醇-氯化钠饱和溶液;依次插入带有20 µm 过滤筛板的内套管(图2c),将装有样品的试管架放置于超声波发生器中,于室温下超声萃取30 min;萃取结束后,向下推动内套管(图2d),使萃取液通过过滤筛板进入内套管(含淀粉的样品残渣留在外套管中),弃去滤液(以去除样品中的干扰物质);向弃去萃取液的内套管中加入10 mL 80%乙醇-氯化钠饱和溶液,向上拉动内套管,使80%乙醇-氯化钠饱和溶液通过筛板进入外套管(图2e);充分振荡以洗涤样品,洗涤完毕后将内套管下压(图2d),弃去洗涤液。
向弃去洗涤液的内套管中加入25 mL 40%(体积分数)高氯酸溶液,将内套管向上拉,使高氯酸溶液通过筛板全部进入外套管(图2e),于室温下超声萃取10 min;萃取结束后将内套管下压(图2d),使淀粉萃取液通过过滤筛板进入内套管;向内套管中加入25 mL 水,混合均匀;将内套管中的淀粉萃取液转移至250 mL 容量瓶中,用水定容至刻度;将定容后的样品溶液转移至连续流动分析仪的进样杯中,根据淀粉在酸性条件下与碘发生显色反应的原理,于570 nm 下进行比色测定。
2 结果与讨论
2.1 新型样品前处理装置的设计
标准方法中采用砂芯漏斗进行样品过滤前处理操作:将待测样品置于砂芯漏斗中,加入80%乙醇-氯化钠饱和溶液;超声萃取除去杂质后再用40%高氯酸萃取样品;将萃取液按照1∶10 稀释后进行测定。在整个前处理过程中,需将砂芯漏斗置于装有400 mL 水的烧杯中,除杂、洗涤、萃取淀粉过程中均需取出漏斗逐个用加压球加压过滤,前处理操作繁琐、耗时;即使是使用大型的超声波发生器一次也只能摆放10 个装有400 mL 水的烧杯,即每个批次最多只能处理10 个样品;整个前处理过程中样品均在漏斗中,过滤、除杂时滤孔易被堵塞,导致过滤速度较慢。
为进一步简化样品前处理操作,本研究中设计了图2 所示的样品萃取瓶。该样品萃取瓶的外套管可以实现样品装载和萃取的功能,内套管可以实现样品免转移过滤的功能。采用本装置,在整个样品前处理操作过程中不需要转移样品,因而样品前处理过程得到了明显简化;另外,超声萃取前用内套管卡住样品外套管的口部,避免了超声萃取过程中可能出现的萃取液溅出或被污染的风险。采用该样品萃取瓶不仅可以集样品超声萃取、萃取液过滤、废液转移于一体,而且可以进行大批量样品前处理操作。此外,使用该样品萃取瓶进行样品前处理时,可以有效地避免过滤过程中的筛板堵塞,因而过滤速度较快。
2.2 样品前处理条件的优化
由于烟草中有多酚、色素、醌类等成分,会干扰淀粉的测定,因此标准方法中采用80%乙醇-氯化钠饱和溶液超声萃取30 min[9]以除去样品中的干扰杂质,而雷诺公司采用75%甲醇-氯化钠饱和溶液72 ℃萃取30 min[15]的方法。由于标准方法无需加热,操作更简便,因此本研究中参考标准方法,选择在室温下对样品进行超声萃取以脱除杂质。称取7 份烤烟试样,各加入25 mL 80%乙醇-氯化钠饱和溶液,依次超声5、l0、20、30、40、50 和60 min,以不超声萃取脱除杂质(0 min)为对照,样品中的淀粉含量检测结果见图3。可以看出,超声20 min 后,样品中淀粉含量基本保持不变,表明样品中的干扰物质已基本去除。为确保杂质完全被去除,本研究中选择超声萃取时间为30 min。

图3 超声萃取去除杂质时间对淀粉含量的影响Fig.3 Influences of impurity removing time in ultrasonic extraction on starch content
除去样品中干扰淀粉测定的杂质后,需用高氯酸萃取样品中的淀粉。雷诺公司采用40%高氯酸在室温下静置萃取样品中的淀粉[7],而标准方法中采用40%高氯酸超声萃取烟草中的淀粉[15],两种方法的萃取时间均为10 min。本研究中比较了静置萃取、振荡萃取和超声萃取等方法对淀粉的萃取效率,以典型的烤烟样品为例,分别在室温下静置萃取、振荡萃取和超声萃取10 min,淀粉含量检测结果见表1。可以看出,超声萃取法的效果略好于静置萃取和振荡萃取法,这可能是因为超声萃取更易使淀粉与小分子化合物通过氢键作用相结合,并发生溶胀,从而使淀粉更容易转移到萃取液中。因此,选择使用40%高氯酸超声萃取10 min 的方法。

表1 不同萃取方式对淀粉测定结果的影响Tab.1 Influences of different extraction methods on starch content
2.3 工作曲线
对配制的不同质量浓度的淀粉系列标准工作溶液进行检测分析,并以淀粉的峰高对其浓度进行线性回归,得到淀粉的工作曲线。实验中得到的线性回归方程为Y = 867.4X + 69.58,相关系数r = 0.999 6。该工作曲线能覆盖本研究中所有类型烟草样品的淀粉含量范围。
2.4 回收率
分别称取0.250 6 g 直链淀粉标准品(99.8%)和1.002 5 g 支链淀粉标准品(99.8%)于烧杯中;向直链淀粉的烧杯中加入2.0 g 氢氧化钠,用水煮沸溶解,而支链淀粉直接用水煮沸溶解;冷却后分别转入50 mL 容量瓶中,用水定容至刻度,得到回收率实验用淀粉标准储备液,其中,直链淀粉标准储备液的质量浓度为5.002 mg/mL,支链淀粉标准储备液的质量浓度为20.010 mg/mL;分别移取直链淀粉储备液和支链淀粉储备液各10 mL 于50 mL容量瓶中,用水定容至刻度,摇匀,得到回收率实验用淀粉混合标准储备液(淀粉混合标准储备液的质量浓度为5.002 4 mg/mL)。
选择典型的烤烟、白肋烟和香料烟样品进行3个不同浓度的加标回收率实验。在3 组(每组3 个样品)已加入相同烟草样品的外套管中分别加入不同量的淀粉标准储备液,见表2。实验中,加标量均覆盖样品可能的含量范围。用冷冻干燥机除去加标后的样品中的水分,然后进行前处理和检测。由表2 可以看出,方法回收率为96.40%~101.30%,表明本方法较准确。

表2 方法回收率实验结果Tab.2 Recovery of the method
2.5 精密度
选择白肋烟、香料烟和烤烟样品,在同一天内平行测定7 次,计算日内相对标准偏差(RSD);相同样品每天测定1 次,连续测定7 d,计算日间相对标准偏差。结果表明:烤烟样品(淀粉含量3.86%),日内RSD 为0.96%,日间RSD 为1.24%;白肋烟样品(淀粉含量0.84%),日内RSD 为2.48%,日间RSD 为3.22%;香料烟样品(淀粉含量2.28%),日内RSD 为1.87%,日间RSD 为2.32%。可见,本方法的再现性较好。
2.6 实际样品分析结果
采用本方法和标准方法分析云南中烟T0 代基因编辑素材苗期、团棵期、旺长期、成熟期4 个阶段的淀粉含量,结果见表3。对两种方法的检测结果进行配对t 检验,结果P 值为0.712(>0.05),说明两种方法的测定值无显著差异。
表3 显示,不同成长阶段的烟株中淀粉含量不同:苗期淀粉含量较低;团棵期淀粉含量较苗期明显增加;旺长期与团棵期相比淀粉含量没有明显变化;成熟期淀粉含量显著高于前3 个生长阶段。淀粉含量的变化与烟株不同生长阶段的特性有关。在苗期,烟株叶面积较小,光合能力较弱,淀粉类光合产物主要满足烟株生长发育的需要。在团棵期,叶面积增大,光合作用增强,合成的淀粉类产物较多,这些物质除了可以满足烟株生长发育的需求外,还开始在烟叶中累积。总体上,在烟株生长前期,烟叶光合作用产物主要满足新器官、新组织的形成和生长需要,淀粉等碳水化合物的含量呈缓慢增加的趋势。在旺长期,营养物质主要供给烟株的生殖生长,淀粉累积速度减缓。在成熟期,烟叶中可溶性总糖和还原糖急剧升高,为淀粉的合成提供了更多碳源,导致淀粉大量累积[16-18]。
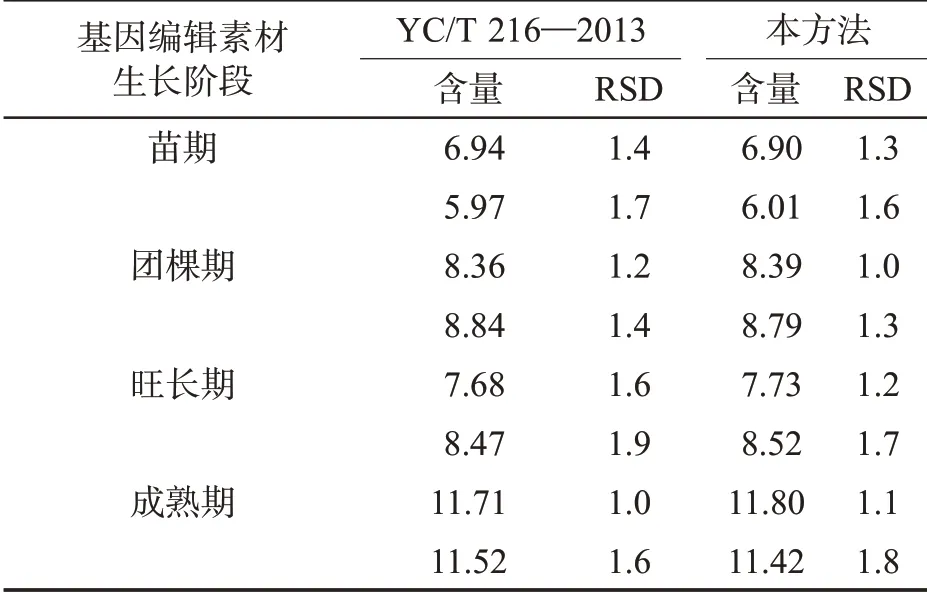
表3 本方法与YC/T 216—2013 方法检测结果的对比Tab.3 Comparison of determination results between the proposed method and the method described in YC/T 216—2013 (%)
3 结论
在标准方法的基础上设计了一种新型样品萃取瓶,采用该样品萃取瓶,不需要样品转移操作即可完成样品的脱除杂质、洗涤和淀粉萃取;而且多个样品可放在试管架上进行批量处理。与标准方法相比,本方法的样品前处理步骤简单,样品检测效率得到了显著提高。3 个不同添加水平下的回收率为96.40%~101.30%;日内、日间相对标准偏差均小于3.3%。采用本方法与标准方法YC/T 216—2013 的样品测定结果无明显差异。本方法为烟草基因编辑素材的淀粉分析提供了一种快速、准确、可靠的高通量方法。

