人晶状体上皮细胞BHMT基因过表达慢病毒载体的构建及鉴定*
周海燕,薛雨顺,王新川,高宁宁
1.陕西省人民医院眼科(西安 710068);2.空军军医大学基础医学院(西安 710032)
大量的研究已证实蛋氨酸(Methionine,Met) 对维持晶状体透明度是非常重要的,它是抗氧化物谷胱甘肽的前体[1-2]。甜菜碱高半胱氨酸甲基转移酶(Betaine-homocysteinemethy transferase,BHMT)是Met循环中重要的酶,它利用同型半胱氨酸(Homocysteine,Hcy)和提供甲基的甜菜碱(Betaine,Bet)催化 Met 的再合成[3-4]。在胎儿晶状体文库中,BHMT 是一个大量表达的基因[5]。前期我们利用基于同位素相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)标记的蛋白质组学技术研究分析了不同年龄人白内障晶状体核与透明晶状体核间的差异蛋白质,首次报道了BHMT在高龄组白内障晶状体核区的水平较年轻组明显下调,进一步通过新的临床白内障晶状体标本进行了验证[6]。但其在晶状体老化和白内障形成中如何参与代谢等确切机制尚不清楚。本研究将构建稳定过表达BHMT的慢病毒载体,并转染人晶状体上皮细胞,为进一步研究其在白内障发生发展中的作用提供生物学基础。
材料与方法
1 主要试剂及仪器 人晶状体上皮细胞(Human lens epithelial cells,HLEC)由本实验室保存,慢病毒GV358载体、AgeI / AgeI 酶切,购自上海吉凯基因化学技术有限公司。1kp DNA ladder Marker(Fermentas公司),琼脂糖(赛百盛公司),250 bp DNA ladder Marker与Primer(捷瑞生物公司)。In-FusionTMPCR Cloning Kit (Clontech公司),琼脂糖凝胶DNA回收试剂盒购自天根生化,Taq polymerase(SinoBio公司),限制性内切酶(NEB公司)。dNTP(Takara公司), PCR仪(Applied Biosystems), DMEM培养基(含10% 胎牛血清)购自 Gibco 公司,引物由上海吉凯基因化学技术有限公司合成。
2 细胞培养 HLEC培养于含体积分数15% 胎牛血清的低糖 DMEM 7培养液中,置于37 ℃、体积分数为5%CO2的恒温孵箱内培养。
3 研究方法
3.1 引物设计和合成:从Gen Bank 资料库中获得人 BHMT 的 mRNA 序列(NM-001713),基因引物设计为:上游 5′-GAGGATCCCCGGGTACCGGTCGCCACCATGCCACCCGTTGGGGGCAAAAAG- 3′;下游:5′- TCCTTGTAGTCCATACCCTGTGATTTGAATTTTTGTTTTTC - 3′。聚合酶链反应扩增 BHMT 基因片段。
3.2 BHMT-GV358 过表达质粒载体构建:用 Age I 酶对纯化的 GV358 质粒 DNA 进行酶切,对载体酶切产物行琼脂糖凝胶电泳,回收目的条带,获得线性化的 GV358 载体。将RT-PCR扩增纯化的BHMT基因片段与酶切后 GV358 质粒 DNA连接得到重组载体GHMT-GV358,行 PCR 鉴定,鉴定的阳性克隆转化子测序,测序结果和目的基因序列比对分析。将正确的菌液转接到10 ml 含相应抗生素的液体培养基中,37℃过夜培养,进行质粒抽提。
3.3 慢病毒包装及滴度测定:将该慢病毒包装系统中的3种质粒(BHMT-GV358 20 μg,pHelper 1.0载体 15 μg,pHelper 2.0 载体 10 μg)与转染试剂混匀,室温下孵育15 min,将复合物加入293T细胞培养液中孵育养,于37℃、5%CO2环境培养6~8 h, 弃去原培养基,换上10 %含 FBS 的 DMEM 10 ml,继续培养48 h,收集含有病毒颗粒的细胞上清。将取得的病毒上清液于25 000 r/min,4 ℃条件下离心2 h,收集沉淀,加入适量病毒保存液,重悬,高速离心5 min 后,取上清,分装并保存至-80 ℃冰箱。进行慢病毒滴度测定。
3.4 BHMT基因表达检测:对数生长期的293T细胞接种到24孔板中(细胞数约为 2×104),37℃、5% CO2环境培养细胞融合度达到约80%。使用Lipofectamine 2000转染,4~6 h 后观察细胞状态,更换新鲜培养基。转染24 h 后观察质粒荧光标记基因表达情况,判断转染效率,荧光率大于80%,荧光拍完后补加500 μl正常培养基,待长满后收集细胞用于RNA提取或蛋白质检测。①RT- PCR检测BHMT mRNA的表达。实验分组:阴性对照组(NC组)、BHMT过表达组(OE组)用于扩增基因的引物序列上游:5'- CCACTTTGACCCCACCATTA- 3',下游:5'- GCTAGCTCATTTGTCGTCATC- 3';以 GAPDH 基因为内参照基因,用 2-ΔΔCt法计算目的基因的相对表达量。mRNA 相对表达量=2-ΔΔCt,ΔCt=目的基因 Ct 值-内参基因 Ct 值,-ΔΔCt=对照组 ΔCt 平均值-各样品ΔCt 值。②Western blot 法检测BHMT基因表达。各组细胞裂解后超声破碎细胞,取上清 BCA 法测定蛋白浓度。取20 μg蛋白样品,经 SDS-PAGE分离后,电转移至PVDF膜上,5% 脱脂牛奶室温封闭 2 h之后于 4 ℃ 冰箱内与一抗孵育过夜,室温漂洗后给予二抗孵育1 h,再次漂洗后加入配置好的显色液,用ECL法结合X光片显色。
3.5 慢病毒感染人晶状体上皮细胞:人晶状体上皮细胞分为两组,感染组,(LV-BHMT24172-1)病毒感染,对照组,阴性对照病毒CON220感染,分别接种于 6 孔板,细胞密度为20%,感染条件为Eni.S+polybrene,以感染复数(MOI)= 10 计算病毒量,感染后 16 h更换感染液,72 h于荧光显微镜下观察GFP表达情况,荧光率要达到70%~80%左右,细胞汇合度达80%左右后进入下一步实验。
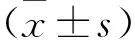
结 果
1 成功构建BHMT-GV358 载体 PCR 扩增目的基因并行凝胶电泳,见目的条带出现于1262 bp 处(图 1)。构建 BHMT-GV358 重组载体后,进行 PCR 鉴定,显示在第5~12泳道出现目的条带(图 2),阳性转化子PCR产物大小为655 kb,进行测序及比对验证,经 GenBank 中BHMT序列对比验证,序列完全一致,表明已成功构建重组质粒(图 3)。
2 转染后细胞荧光观察及滴度测定 将BHMT-GV358 病毒包装后感染 293T细胞,荧光显微镜见荧光表达结果较强(图4)。细胞内观察到明显荧光,说明目的质粒转染正常,荧光标记基因表达正常,表示 BHMT蛋白可以在 293T细胞中表达。根据计算公式qPCR 滴度(TU/ml)=N×C/V,计算平均滴度。经滴度检测,病毒滴度约为2.00E+08TU/ml。
3 RT-PCR 检测 BHMT基因表达情况 见表1。将病毒浓缩液加入293T细胞培养基,获得稳定感染的293T细胞。转染后提取细胞内总 RNA,利用RT-PCR 法检测BHMT mRNA 的表达水平,所得结果与GAPDH的结果相比较。在本实验中过表达组BHMT基因表达丰度明显升高,是对照组的986.181倍(图5),比较差异有统计学意义(P<0.05)。

表1 BHMT基因在各组的表达丰度
注:与过表达组与对照组相比, *P<0.05
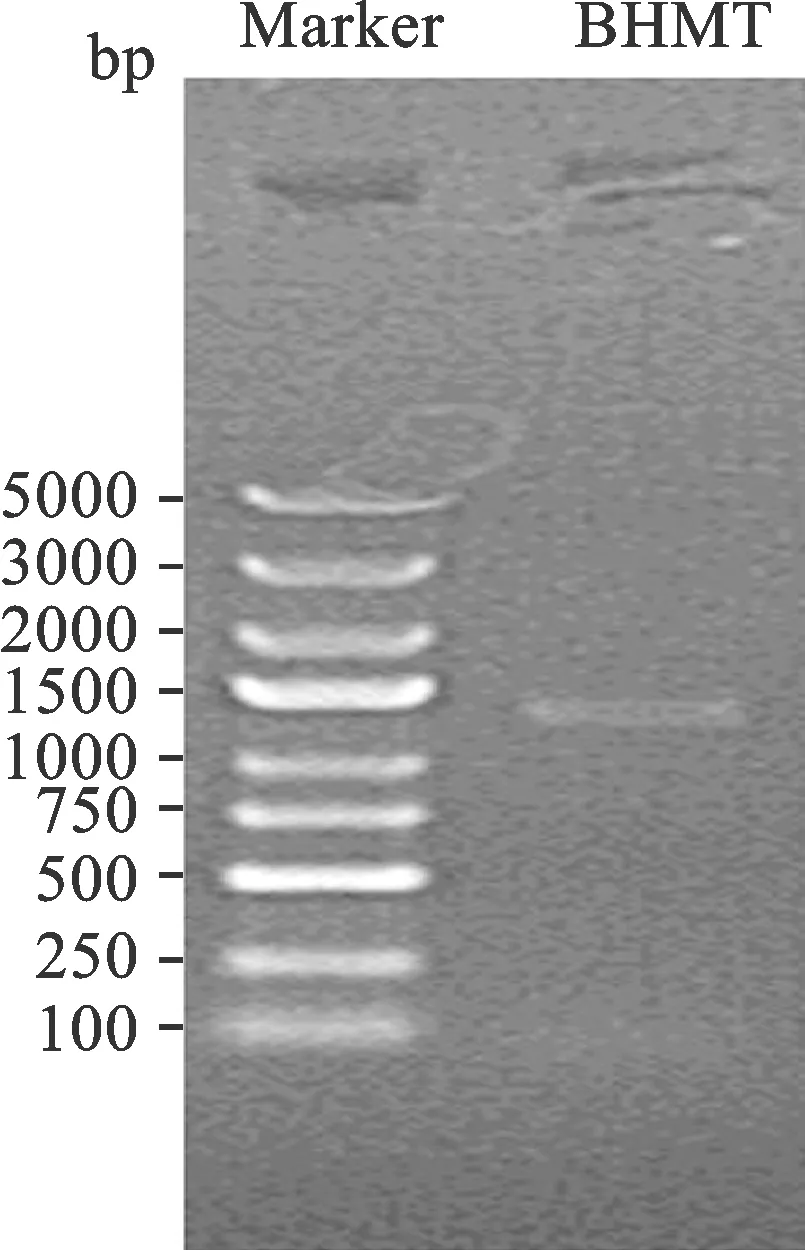
图1 BHMT基因片段的PCR扩增
1:阴性对照(ddH2O); 2:阴性对照(空载体);3:阳性对照(GAPDH);4:Marker:5、3、2 、1.5、1 kb,750、500、250、100 bp;5~12:转化子
图2 BHMT-GV358载体的酶切鉴定
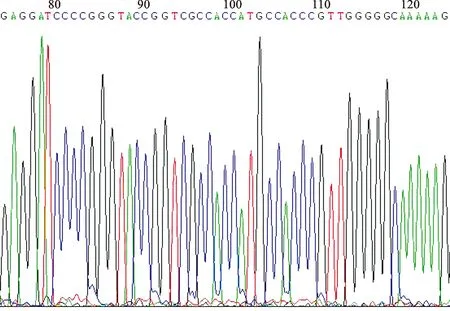
图3 克隆序列测序图

图4 BHMT-GV358载体转染293T细胞(荧光视野与明视野对照图)(100×, 200×)
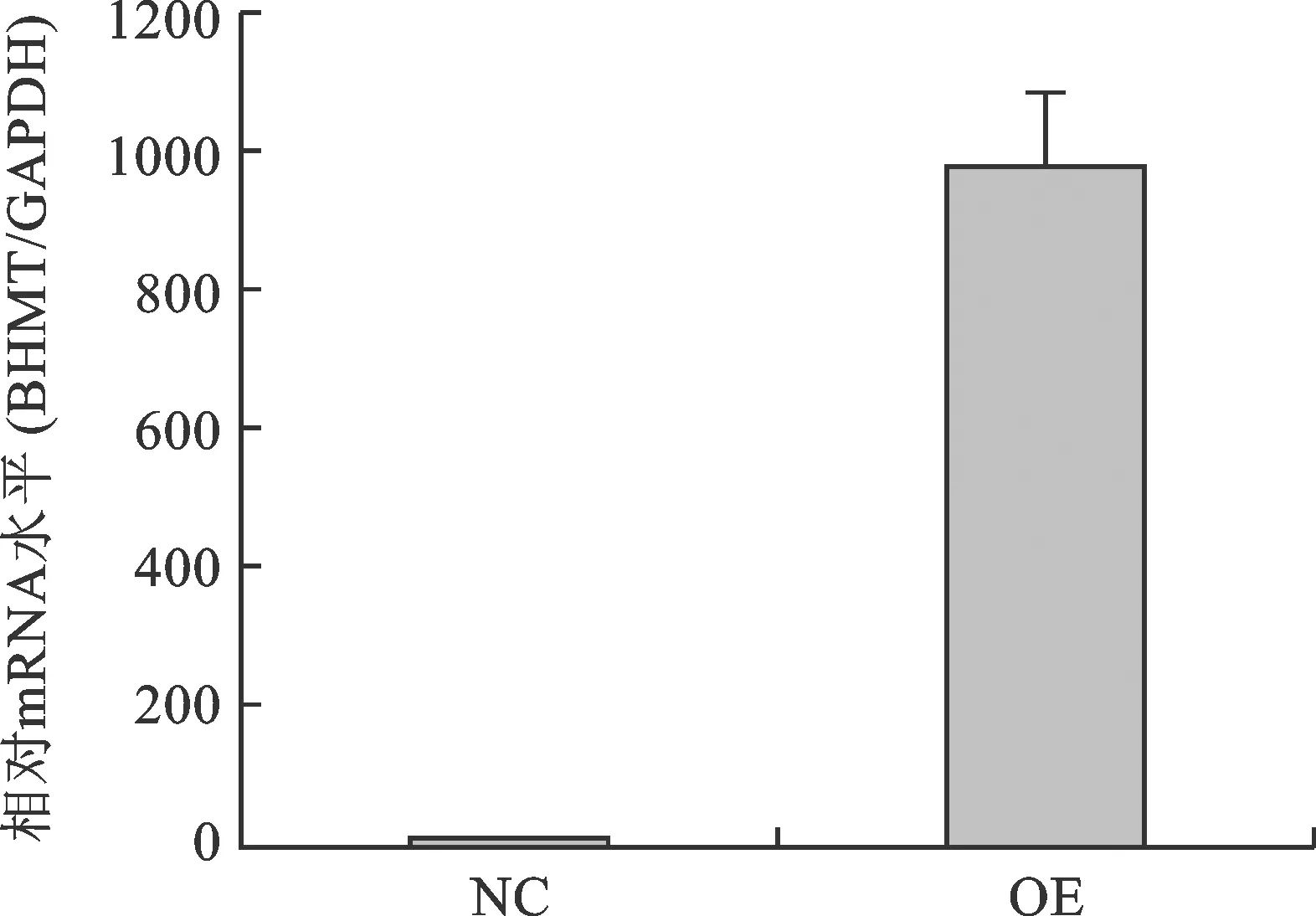
图5 转染后各组 BHMT mRNA 相对表达量 (P<0.05)
4 慢病毒感染人晶状体上皮细胞 荧光显微镜下观察病毒转染后的过表达细胞系可见GFP表达,感染效率在90%左右(图6)

图6 慢病毒感染人晶状体上皮细胞
5 Western blot 方法检测 BHMT蛋白表达情况 感染重组慢病毒BHMT 48 h 后收集重组慢病毒感染和对照未感染的293T细胞,检测BHMT蛋白表达,Western blot检测可以观察到47 kD附近处有特征条带,大小与目的基因融合蛋白吻合。提示此质粒用FLAG抗体检测到BHMT,可在 293T细胞内正常表达,且在感染组中明显高于对照组(图 7)。

图7 Western blot检测转染组(OE)与对照组(NC)BHMT蛋白表达
讨 论
前期我们利用基于同位素相对和绝对定量(iTRAQ)标记的蛋白质组学技术研究分析了不同年龄人白内障晶状体核与透明晶状体核间的差异蛋白质, 并首次报道了BHMT在高龄组白内障晶状体核区的水平较年轻组明显下调,进一步通过新的临床白内障晶状体标本进行了验证[6]。但其在晶状体老化和白内障形成中如何参与代谢等确切机制尚不清楚。Rao 等[7]第一次在恒河猴的晶状体核中发现了BHMT,其表达约占核部总蛋白的 0.5%~10%,但具体机制不清。人源 BHMT的研究表明,BHMT 是含 Zn2+的金属酶,相对分子量为 45×103,由 406 个氨基酸组成[8]。Met 或谷胱甘肽与白内障的发生密切相关[9-10]。BHMT 是 Met 循环中重要的酶, 是Hcy代谢过程中重要的酶类,在对高Hcy血症的研究中发现,BHMT 表达与生物学活性降低是高 Hcy 血症发生的分子基础, 它可以调控 Hcy 的水平。BHMT 是 Hcy 重新甲基化生成 Met 的关键酶,是机体在生理状况下维持 Hcy稳定代谢水平的重要功能蛋白质。高 Hcy 除了与心血管疾病、神经性疾病、糖尿病等全身疾病相关外[11-12],与白内障等眼部疾病的发生发展密切[13-17]。研究发现在相同的诱导条件下BHMT 转基因小鼠的高 Hcy 血症发病率明显低于对照组,并可保护肝脏细胞免受高Hcy浓度的损伤[18]。Zhang等[19]发现两种miRNAs 通过分化靶向海刺参中 BHMT 来直接影响体腔细胞中Hcy 含量,靶基因BHMT siRNA 或补充Hcy均可明显促进体腔细胞 ROS 的产生,表明靶基因BHMT通过调控Hcy的含量发挥生物学功能。更值得关注的是, BHMT 不仅对已生成的 Hcy 具有高效直接的转化功能,且由于与细胞膜有很好的亲和性,外源性 BHMT 能被吸收入细胞发挥生物学功能。因此,调控或直接补充 BHMT 已经成为高Hcy 血症治疗研究的一个新的重要热点。
慢病毒(Lentivirus)载体是基于人类免疫缺陷型病毒(HIV)发展起来的基因治疗载体,它对分裂细胞和非分裂细胞都具有感染力,能在体内较长期表达且安全性高。慢病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒[20],目前已广泛应用在以基因为靶点的各种基础实验研究中。通过慢病毒载体系统,我们能有效地将目的基因整合入宿主细胞基因组中,从而得到可以稳定表达目的基因的细胞株,是研究基因及其表达产物功能的有力工具。我们首次在人老年性白内障晶状体核中筛选鉴定出了BHMT 的表达降低,非常有必要明确其表达的变化与老化和白内障形成的机制。本实验成功构建并包装了重组 BHMT-GV358慢病毒载体,成功转染293T细胞,采用RT-PCR 在mRNA 水平检测到BHMT表达明显增加,说明BHMT BHMT-GV358能够有效介导BHMT的过表达,并用构建成功的BHMT基因过表达的慢病毒载体在体外有效感染了人晶状体上皮细胞,为进一步研究BHMT在 白内障及与Hcy有关的疾病发病机制中的作用打下了良好的实验基础。

