左心室辅助装置在高危经皮冠状动脉介入治疗术中应用1例
高好考 陈根锐 李成祥
1 临床资料
患者 男,53 岁。主因“反复胸闷、气短4个月,加重1周”于2019年2月入住空军军医大学第一附属医院。4个月前无明显诱因出现胸闷、气短,夜间频繁,1周前加重伴有夜间阵发性呼吸困难。当地医院就诊行冠状动脉造影示:左主干全程病变,累及末段分叉部,最严重部位70%狭窄;左前降支(left anterior descending coronary artery,LAD)近段80%狭窄,中段99%狭窄,心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级Ⅰ级;左回旋支(left circumflex coronary artery,LCX)中段80%狭窄;第一钝缘支、第二钝缘支均为70%狭窄。右冠状动脉(right coronary artery,RCA)近段99%狭窄,TIMI血流分级Ⅱ级,中段90%狭窄,后降支和后侧支分别为80%和70%狭窄(图 1)。为进一步治疗收入本院。既往高血压病史20年,血压最高180/100 mmHg(1 mmHg=0.133 kPa),控制可,糖尿病史2年。入院查体:双肺可闻及少量干、湿性啰音,心率 110 次/分,血压 150/100 mmHg。血常规示:白细胞计数13.53×109/L,中性粒细胞0.78。B型脑钠肽前体(pro-BNP) 1854 pg/ml(正常值<125 pg/ml),肌酸酐122 μmol/L(正常值53~115 μmol/L)。心肌酶谱正常。入院心电图示: 窦性心律,心率92次/分;Ⅱ、Ⅲ、aVF导联可见 Q波,V1~V4导联 R波递增不良(图2)。超声心动图示: 腱索水平以下左心室前壁、下壁心肌梗死;高位乳头肌水平以下余左心室壁运动普遍减低;全心大,二尖瓣反流中量,三尖瓣反流少量,左心室射血分数(left ventricular ejection fractions,LVEF)30%,左心室舒张末期容积173 ml。
初步诊断:(1)冠心病,急性冠状动脉综合征,美国纽约心脏协会(New York heart association,NYHA)心功能Ⅲ级;(2)高血压病3级;(3)2型糖尿病。入院后继续双联抗血小板、抗凝治疗,利尿、扩血管控制心力衰竭,降压、降糖等治疗,择期行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)开通血管改善心肌缺血。PCI 术前策略分析:(1)患者反复胸闷、气短,1周前加重伴有夜间阵发性呼吸困难,心力衰竭症状明显,考虑患者NYHA心功能Ⅲ级。(2)患者心电图示下壁和前壁心肌梗死。超声心动图示LVEF 30%,全心大,腱索水平以下左心室前壁、下壁心肌梗死;高位乳头肌水平以下余左心室壁运动搏动普遍减低;二尖瓣反流(中量),提示患者心肌梗死形成和心脏储备能力较差。(3)冠状动脉病变为左主干病变,合并三支血管严重狭窄,大面积心肌处于缺血状态。Logic EuroSCORE评分评估患者死亡率为10.40%和 SYNTAX 评分为44 分,表明行冠状动脉旁路移植术(coronary artery bypass grafting,CABG)或PCI术均属极高危,建议首选 CABG。(4)患者合并高血压病、糖尿病多种疾病。心外科会诊意见,患者全心大,心功能差,有心力衰竭症状,行CABG风险较大。沟通后家属拒绝CABG,愿意接受PCI术。(5)患者属于高风险PCI术人群,心肌储备功能差,为降低手术过程中血流动力学崩溃风险,考虑应用血流动力学辅助装置Impella 2.5装置(图3)辅助手术,家属同意目前手术方案。
Impella 2.5装置的应用:(1)术前经胸超声心动图显示患者主动脉瓣无狭窄或关闭不全,瓣膜功能正常。(2)局部麻醉后,将6 F鞘管经皮插入右侧股动脉,应用JR 4.0造影管显示左侧股动脉和两侧髂动脉血管无异常,患者适合行辅助装置(图4A)。(3)穿刺左侧股动脉,置入6 F鞘管后换为14 F鞘管放置到同侧股动脉,给予5000 U普通肝素(UFH)后,将猪尾导管送入左心室,把Impella 2.5专用0.018 in(1 in=2.54 cm)导丝送到左心室,撤除猪尾导管。(4)在影像指引下使Impella 2.5装置(美国ABIOMED)沿导丝通过主动脉瓣,将JR 4.0导管放置在主动脉窦位置造影,明确Impella 2.5泵的中体在主动脉瓣水平(图4B~C),随后启动泵,设置最大流量2.5 L/min,在整个手术过程中维持患者血流动力学稳定。
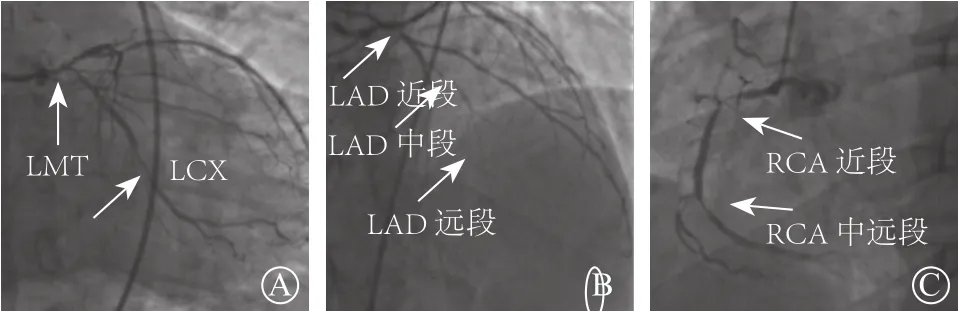
图1 当地医院冠状动脉造影结果 A. LCX中段80%狭窄;B.左主干70%狭窄;LAD近段80% 狭窄,中段99%狭窄,TIMI血流分级Ⅰ级;C.RCA近段99%狭窄,TIMI血流分级Ⅱ级,中段90%狭窄
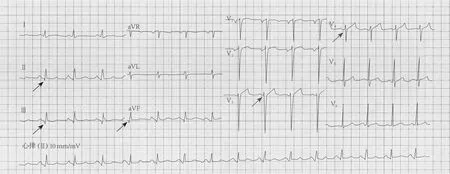
图2 入院后心电图示Ⅱ、Ⅲ、aVF 导联可见 Q波(黑色箭头),V1~V4导联 R波递增不良(灰色箭头)
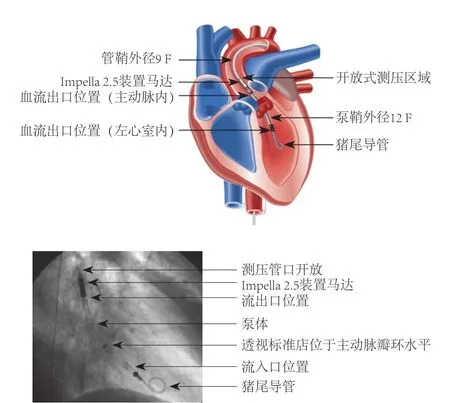
图3 Impella 2.5装置置入左心室正确位置结构及影像示意图

图4 Impella 2.5装置置入左心室 A.造影显示左侧髂动脉/股动脉血管正常;B.Impella 2.5装置沿导丝输送;C.JR 4.0导管造影显示Impella 2.5装置位置正确
经右侧股动脉入径,将6F JR 4.0指引导管成功放置于RCA口;将Runthrough NS工作导丝放置在RCA远段;首先应用2.5 mm×20 mm球囊以14~16 atm(1 atm=101.325 kPa)压力分别于中段和近段扩张,扩张后可见近段有轻度夹层形成(图5A~B) ;然后于中远段和近段分别置入Promus Element 3.0 mm×38 mm,Promus Element 3.5 mm×32 mm支架,造影显示残余狭窄<20%,效果较好(图5C)。随后将6F EBU 3.5指引导管成功放置于左冠状动脉口;为避免支架后LCX丢失, 将Sion导丝和Runthrough NS导丝分别放置在LAD和LCX远段;应用2.5 mm×20 mm球囊以14~16 atm压力扩张LAD中远段和左主干-LAD近段 (图5 D);再次应用3.5 mm×10 mm 切割球囊以12 atm压力扩张左主干-LAD开口,重塑开口部斑块,左主干分叉血流显著改善(图5 E~F)。分别于LAD中远段、近-中段和左主干-LAD近段成功放置3枚药物洗脱支架,直径分别为Promus Element 2.5 mm×38 mm,Promus Element 3.0 mm×28 mm,XIENCE PRIME3.5 mm×28 mm(图5 G),随后进行高压力后扩张支架。多角度造影提示:LCX血流分级TIMI Ⅲ级,开口无明显受压(图5 H),左主干-LAD开口无明显残余狭窄(图5 I)。
PCI术中患者血流动力学平稳,血压130/100 mmHg,停用Impella 2.5装置后5 min血压、心率平稳,撤除Impella 2.5装置,患者安返病房。术后经胸超声心动图检查未见主动脉瓣关闭不全发生及瓣膜损伤,无下肢缺血发生,肾功能未受影响。术后观察3 d,无典型症状后出院,定期门诊观察。随访9个月患者一般情况良好。
2 讨论
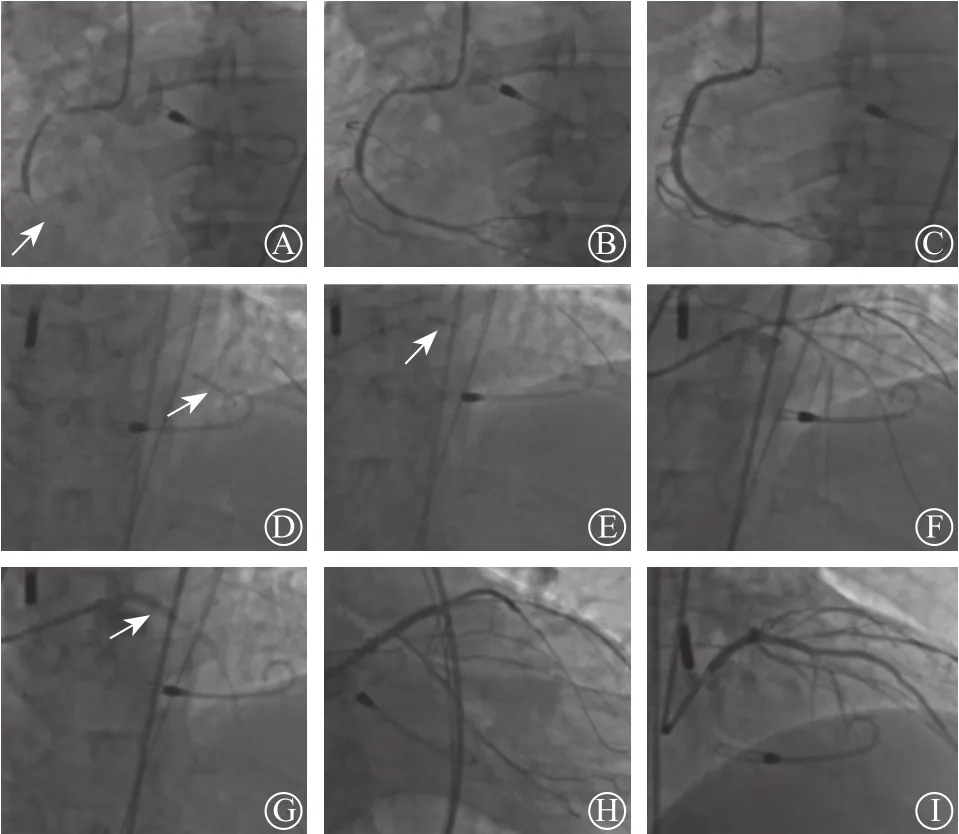
图5 RCA和LCX支架置入过程 A.球囊扩张RCA病变;B.球囊扩张后近段轻度夹层形成; C. RCA支架后影像结果;D. 球囊扩张LAD病变;E.LAD近段切割球囊扩张;F. 左主干-LAD扩张后血流改善;G. 左主干-LAD支架置入;H. LCX近段病变无明显加重;I. 最后影像结构
2015年美国心血管造影和介入学会(Society for Cardiovascular Angiography and Interventions,SCAI)/美国心脏病学会(American College of Cardiology,ACC)/美国心力衰竭学会(Heart Failure Society of Amerrica,HFSA)/美国胸外科医师协会(Society of Thoracic Surgeons,STS)高危PCI术使用心脏辅助装置的建议[1]指出:对于左主干病变、仅存单支血管或严重的多支血管病变,严重的左心功能不全(LVEF<35%)或近期曾发生失代偿心力衰竭,复杂的PCI技术,可以根据具体情况使用Impella或Tandemheart装置,体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)在患者合并有低氧血症或右心衰竭时使用[1]。《中国经皮冠状动脉介入治疗指南(2016)》[2]建议:对于ECMO等左心室辅助装置,可降低高危复杂患者PCI死亡率,有条件时可选用。本例患者心功能低下(LVEF 30%),左主干病变合并严重的三支血管病变,PCI过程中出现血流动力学崩溃的风险较高,采用临时进行循环支持,可帮助顺利渡过PCI术时短暂的冠状动脉阻断,提高手术成功率。
目前临床较常用的心脏机械辅助装置包括主动脉内球囊反搏(intra aortic ballooncounterpulsation,IABP)、ECMO、Impella、Tandemheart等装置。IABP是最常用于心肌梗死后或PCI术中出现并发症时的血流动力学支持装置。研究显示,在高危PCI术中预防性应用IABP是有效的[3-4]。然而,由于IABP仅能轻度增加心输出量和冠状动脉血流,且其作用需要依赖于尚存的左心室功能和心脏自身节律,因此当血流动力学完全崩溃时并不能提供完全的循环支持[5]。而ECMO因动脉入径并发症发生率较高,治疗复杂,需要外科医师协助等缺点,目前的趋势将ECMO作为PCI术中备用[6]。因此,近年来,在高危PCI术中ECMO的使用率降低,而心室辅助装置的使用逐渐增多。
Impella 2.5装置是一种新的心室辅助装置,应用短期循环支持,可以降低PCI术潜在的相关并发症[7]。Impella 2.5装置主要作用机制是通过插入到左心室的中空轴流导管将左心室的氧合血液泵入到升主动脉,从而降低左心后负荷,减少心肌氧耗,提高心输出量,改善冠状动脉灌注,其操作简便易学,可实现2.5~5.0 L/min心脏辅助泵血[8]。研究表明,该装置在心原性休克和高危复杂冠心病救治中具有确切的心脏辅助功能[9-10]。该装置的使用禁忌证包括严重外周血管病、机械主动脉瓣和主动脉瓣严重钙化患者。既往研究显示,Impella 2.5装置对循环血流动力学改善作用优于IABP[11-12],但是其价格更昂贵、操作更复杂,并且在高危PCI中应用的安全性和有效性是否优于IABP并不清楚。PROTECTⅡ研究[13]是一项前瞻性、多中心、随机对照试验,在非急诊高危PCI 患者中对比研究Impella 2.5装置和IABP的安全性和有效性,共入选了452例,该研究结果发现,相比IABP,Impella 2.5装置减少了33%的心脏及血管病风险,如死亡、心肌梗死、卒中、再血管化治疗和30 d内肾功能不全。目前美国食品药品监督管理局已经批准Impella 2.5装置用于择期高危PCI中血流动力学支持。 本例患者表明高危患者PCI术中Impella 2.5装置可以提供有效血流动力学支持,帮助完成部分或完全血运重建。
尽管本例患者结果表明Impella 2.5装置可以辅助血流动力学稳定,不增加主动脉瓣损伤和血管并发症,需要临床大规模前瞻性随机试验来明确其在高危PCI中提供循环支持的安全性和有效性。

