miR-34a在低氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用
马 兰 ,刘川川 ,杨全余 ,马 燕
(1.青海大学医学院高原医学研究中心,
2.青海省高原医学应用基础重点实验室,青海西宁810001)
低氧性肺动脉高压(hypoxic pulmonary artery hypertension,HPH)是由于长期低氧引起肺血管收缩和肺血管重建从而导致肺动脉压力持续升高的一种常见的慢性高原病[1]。在缺氧早期,HPH主要以肺血管收缩为主,随着缺氧时间的延长,肺血管重建参与其中[2]。在低氧引起的肺血管重建中血管平滑肌细胞的增殖发挥着重要的作用。但是目前引起肺动脉压升高和血管重建的分子机制尚不清楚。缺氧环境下miRNA表达的改变可以调节肺动脉平滑肌细胞(pulmonary artery smooth muscle cell,PASMC)的增殖、凋亡、迁移等功能,并参与HPH的形成[3]。miR-34a是一类对细胞增殖具有正调或负调作用的miRNAs,通过调控许多靶蛋白,参与细胞周期,细胞凋亡及分化[4]。Notch1是与细胞增殖密切相关的基因,已被证实为是miR-34a的靶基因之一,miR-34a通过与Notch1基因3′-UTRs区的结合位点相结合来发挥负性调控作用[5]。然而,miR-34a是否也参与调节缺氧诱导的PASMC的增殖报道较少。本课题通过细胞转染过表达和抑制miR-34a及沉默Notch1的表达后观察低氧诱导的PASMC的增殖情况,旨在探讨miR-34a在低氧诱导的大鼠低氧性PASMC增殖中的作用及其可能的机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠购自北京维通利华实验动物技术有限公司(动物合格证号:11400700292756),体质量为140~160 g。本动物实验经青海大学实验动物伦理委员会批准,并根据青海大学动物实验中心的实验动物操作标准进行。
1.2 实验试剂
DMEM培养基和胎牛血清均购自Gibco公司,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)引物由生工生物工程有限公司合成;Trizol RNA提取试剂盒和lipofectimin RNAiMax细胞转染试剂盒均购自Thermo Fisher公司;miR-34a mimics(MSY0000815)、miR-34a inhibitor(MIN0000815)、si-Notch1(SI01920744)、All star negative control(SI03650318)、Rn-miR-34a primer(MS00000224)、Rn-U6 primer(MS00033740)、Notch1 primer(QT004 00036)、18srRNA primer(QT00199374)、miScript®II RT kit、miScript SYBR Green PCR kit及 Quanti-Fast SYBR Green PCR kit均购自Qiagen公司;Fast Quant cDNA第一链合成试剂盒购自TIANGEN公司;Anti-PCNA antibody、Anti-α-tubulin及二抗均购自Abcam公司。EDU细胞增殖检测试剂盒购自广州锐博生物科技有限公司;BCA蛋白定量试剂盒和ECL发光试剂盒均购自Pierce公司。7500荧光定量PCR仪(美国ABI公司),AI 600成像仪(美国GE公司)。
1.3 大鼠PASMC的原代培养
健康SPF级雄性SD大鼠腹腔注射0.6 mL/100 g的乌拉坦麻醉后断颈处死、体积分数75%酒精消毒胸腹部,无菌条件下打开胸腔并迅速取出心肺组织,并置于预冷灭菌的PBS中将血液洗净。在体视显微镜下小心分离出左右肺中小动脉后用眼科剪沿着动脉管纵行方向剪开,再用小刀片在内壁轻轻刮几次以除去内皮细胞,然后将血管壁剪成1×1 mm2的组织小片,培养瓶内加入含体积分数20%FBS的DMEM培养基,采用组织贴块法原代培养大鼠PASMC。待细胞生长融合达80%左右后,用2.5 g/L胰蛋白酶消化传代培养,用免疫组化法检测α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)对培养的PASMC进行细胞纯度的鉴定,并取第3~5代的细胞作为实验用细胞。
1.4 大鼠PASMC低氧处理及分组
取已培养的3~5代大鼠PASMC,用2.5 g/L胰蛋白酶消化细胞并计数后,按1×105细胞密度将细胞接种在6孔培养板中,并加入含10%FBS的DMEM培养基,常氧组置于常氧培养箱中(37℃,体积分数 5%CO2、21%O2和 74%N2),低氧组置于低氧培养箱中(37℃,体积分数5%CO2、3%O2和92%N2)培养24、48 h。
1.5 细胞转染
在6孔细胞培养板中按照1×105密度接种细胞,用含10%FBS的DMEM培养基培养24 h,观察细胞待融合到80%左右,换为0.5%FBS的DMEM培养基细胞同步化12 h后开始细胞转染,将 miR-34a mimic(20 nmol/L)、miR-34a inhibitor(20 nmol/L)、Si-Notch1(40 nmol/L)及All star negative control(20 nmol/L)分别和lipofectimin RNAiMax(9 μL/孔)严格按照Thermo Fisher公司的lipofectimin RNAiMax转染试剂盒说明书配制混匀后室温孵育5 min,加入细胞中并置于低氧培养箱中继续培养4 h后换成含10%FBS的DMEM培养基继续培养24、48 h。
1.6 EDU检测细胞增殖
按照EDU细胞增殖检测试剂盒,对各组细胞按照说明逐步进行EDU标记、固定、Apollo染色,用Hoechst 33342进行DNA染色后,在激光共聚焦显微镜下进行观察和拍照,随机选取10个视野计数并统计。
1.7 细胞总RNA提取
按照Trizol试剂盒说明书一步法提取各组细胞总RNA,用NanoDrop 2000超微量分光光度计测定A260和A280纯度及浓度、甲醛变性琼脂糖凝胶电泳分析检测完整性。
1.8 RT-QPCR检测miR-34a及PCNA的表达
microRNA的反转录按照miScript®II RT kit试剂盒说明书合成cDNA第一链。并以此cDNA链为模板,按照miScript SYBR Green PCR kit试剂盒说明书,建立miR-34a和内参U6的反应体系,在ABI7500荧光定量PCR上进行PCR反应,条件为95℃,5 min;95 ℃,10 s,55 ℃,15 s,60 ℃ 30 s,40个循环;普通基因的反转录按照FastQuant cDNA第一链合成试剂盒说明书进行cDNA第一链的合成。并以此cDNA第一链为模板,严格按照QuantiFast SYBR Green PCR kit试剂盒说明书,建立PCNA及内参18 s rRNA的反应体系,然后在ABI 7500荧光定量PCR上进行PCR反应,条件为95℃,5 min;95℃,10 s,60 ℃,30 s,40个循环;以上每个样本均设3个复孔。熔解曲线的采集在以上PCR反应结束后,以每10 s上升0.5℃的速度从60℃到95℃来记录线。
1.9 Western-blot法检测蛋白表达
收集各组处理细胞,严格按照碧云天公司的RIPA总蛋白提取试剂盒提取各组细胞总蛋白,然后用pierce公司的BCA蛋白定量试剂盒对所提取的总蛋白定量后,加入含β巯基乙醇的上样缓冲液煮沸蛋白变性,取15 μg样品上样,用5%浓缩胶和10%聚丙烯酰胺分离胶进行电泳,待电泳结束后用Bio-Rad半干电转仪(恒压10 V,20~30 min)转到PVDF膜上。室温下用5%的脱脂奶粉封闭2 h后,在含相应蛋白大小的PVDF膜中分别加入PCNA的兔多克隆抗体(1∶2 000)和内参α-tubulin多克隆抗体(1∶2 000)4℃过夜。用TBST洗膜后加入羊抗兔HRP标记的二抗,在室温下孵育1 h后用TBST再次洗膜后ECL发光液发光,并用AI 600成像仪进行荧光成像并拍照。用PCNA目的蛋白的条带与内参α-tubulin蛋白条带的灰度值之比作为PCNA蛋白的相对表达量,并用Quantity one分析软件进行灰度值分析。
1.10 统计学方法
用SPSS 21.0软件对数据进行统计学分析,数据均采用均数±标准差(±s)表示,数据处理两样本间比较,数据呈正态分布且方差齐时采用t检验;多组间比较先进行正态分布和方差齐性检验,数据呈正态分布且方差齐时采用单因素方差分析(one way ANOVA),多组间比较有差异时,组间两两比较用Tukey检验,检验水准为α=0.05。
2 结果
2.1 大鼠PASMC培养和鉴定
如图所示,我们采用组织贴块法成功分离并原代培养了大鼠PASMC,在贴块培养的第3~5天,可以观察到平滑肌细胞从组织块周围爬出,并贴壁生长,细胞形态多呈长梭形,胞质丰富,细胞生长致密时呈束状平行排列(图1A),7~10 d后呈典型的“峰-谷”状(图1B)。用免疫组化法检测α-SMA对培养的PASMC进行细胞纯度鉴定,可见在视野下大多数细胞均呈阳性染色(图1C、D)。
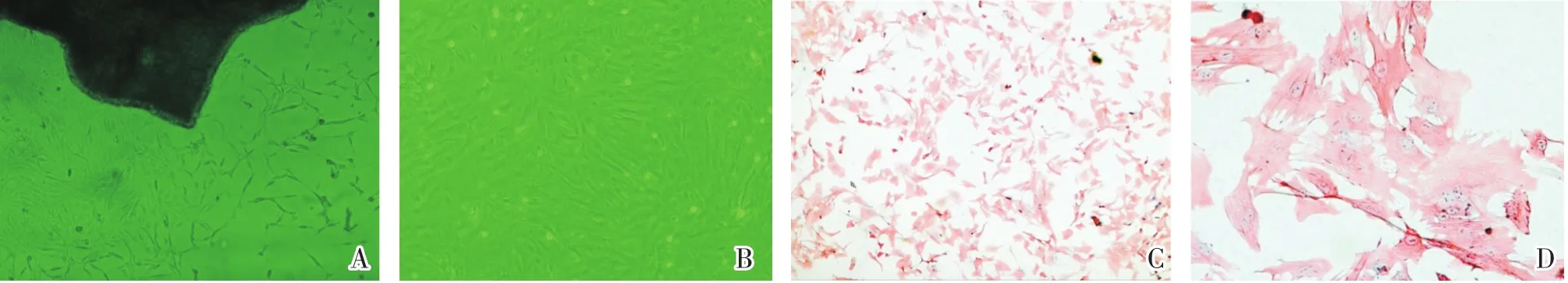
图1 PASMC培养和鉴定结果Fig.1 Cell culture and identification of PASMC
2.2 低氧诱导大鼠PASMC中miR-34a的表达
大鼠PASMC经体积分数3%的低氧处理24和48 h后,用Real-time PCR分别检测了各组PASMC中miR-34a的表达。结果显示,在低氧处理24 h后,与同时间常氧对照组相比,PASMC中miR-34a的表达降低,但是差异无统计学意义(t=2.167,P=0.096;图2),而在低氧处理48 h后,PASMC中miR-34a表达显著降低,差异有统计学意义(t=9.450,P=0.001;图2)
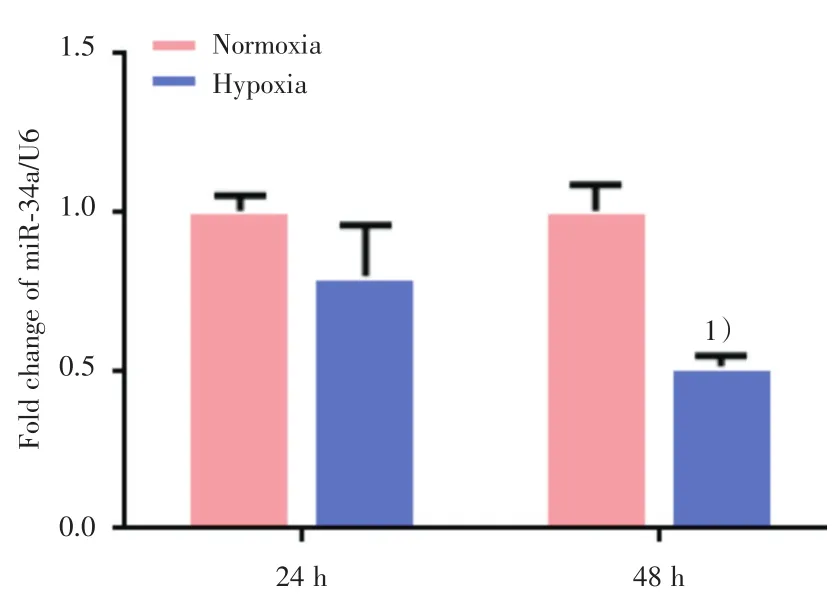
图2 低氧处理后大鼠PASMC中miR-34a的表达Fig.2 Expression of miR-34a in rat PASMC after hypoxia
2.3 低氧诱导大鼠PASMC中Notch1的表达
大鼠PASMC分别给与体积分数3%的低氧处理24和48 h后,用Real-time PCR分别检测了各组细胞中Notch1 mRNA水平的表达。分别与各时间段的常氧对照组相比,低氧处理24 h后,PASMC中Notch1 mRNA的表达水平明显增高,差异有统计学意义(t=-4.006,P=0.016;图3)。低氧处理48 h后,与其常氧对照组相比,PASMC中Notch1 mRNA的表达水平也明显增高,差异有统计学意义(t=-4.624,P=0.01;图3)。
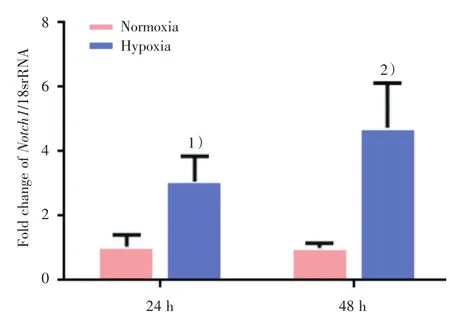
图3 低氧处理后PASMC中Notch1的mRNA表达水平Fig.3 Expression of Notch1 mRNA in rat PASMC after hypoxia
2.4 过表达和抑制miR-34a对低氧诱导的细胞增殖的影响
为了观察miR-34a对低氧引起的PASMC增殖的影响,我们用miR-34a模拟物和抑制剂及Si-Notch1分别转染大鼠PASMC,并给予体积分数3%的低氧刺激48 h后用EDU检测细胞增殖情况。结果如图4所示显示,常氧组、低氧组及低氧各转染组间比较差异有统计学意义(F=26.097,P=0.000)。与常氧对照组相比较,低氧48 h会显著刺激PASMC细胞增殖,差异有统计学意义(P=0.002)。而在低氧条件下与转染阴性对照相比,过表达miR-34a或者抑制Notch1后会显著抑制低氧引起的细胞增殖,抑制miR-34a的表达后则会促进细胞增殖,且差异有统计学意义(P<0.05)。
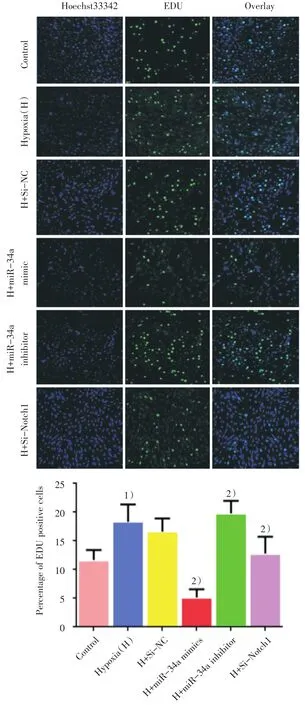
图4 低氧下过表达和抑制miR-34a对PASMC细胞增殖的影响Fig.4 Effects of over expression and inhibition of miR-34a on proliferation of PASMC under hypoxia
2.5 过表达和抑制miR-34a对PCNA表达的影响
用miR-34a模拟物和抑制剂分别转染大鼠PASMC,并给予低氧刺激48 h后,用RT-qPCR和Western blot进一步检测细胞增殖核抗原PCNA的表达。RT-qPCR检测结果如图5所示,常氧组、低氧组及低氧各转染组间比较差异有统计学意义(F=38.312,P=0.000)。与常氧对照组相比,单纯低氧组PCNA mRNA水平表达明显增高,差异有统计学意义(P=0.008)。与阴性对照组相比,过表达miR-34a或者抑制Notch1后,PASMC中的PCNA mRNA的表达水平显著降低,而抑制miR-34a后,PASMC中的PCNA mRNA的表达水平显著升高,差异有统计学意义(P<0.05)。在蛋白水平的检测结果如图6所示,常氧组、低氧组及低氧各转染组间比较差异有统计学意义(F=55.480,P=0.000)。与常氧对照组相比,单纯低氧48 h后PASMC中PCNA蛋白表达明显增高,差异有统计学意义(P=0.000)。低氧处理后,与转染阴性对照组(H+Si-NC)相比,过表达miR-34a后,PASMC中的PCNA蛋白的表达水平显著降低,而抑制miR-34a的表达后,PASMC中的PCNA蛋白的表达水平显著升高,差异有统计学意义(P<0.05),这一结果与mRNA水平相一致。
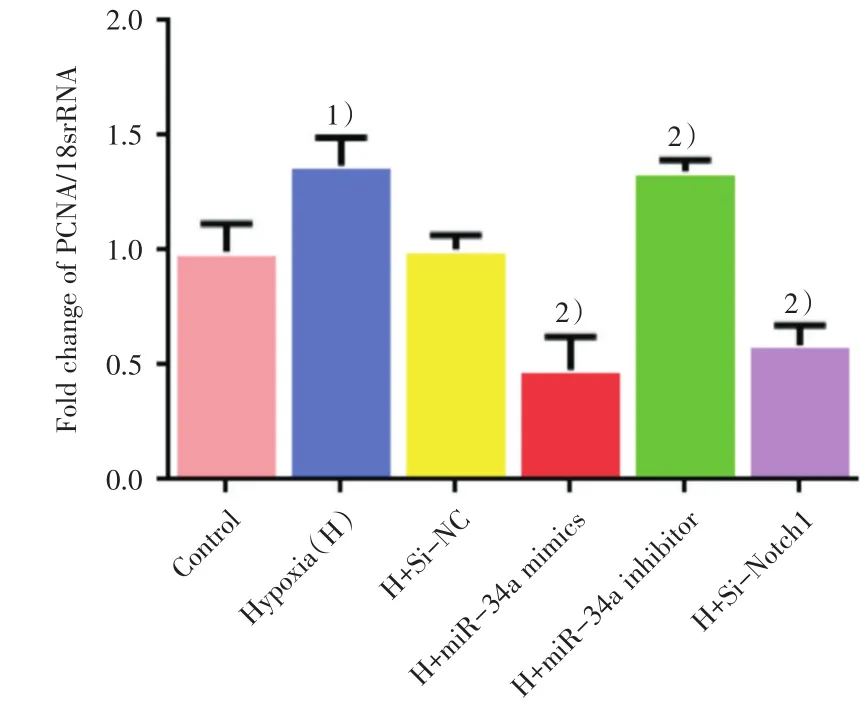
图5 低氧下过表达和抑制miR-34a后PASMC中PCNA mRNA的表达情况Fig.5 Effect of over expression and inhibition of miR-34a on PCNA mRNA expression in PASMC under Hypoxia
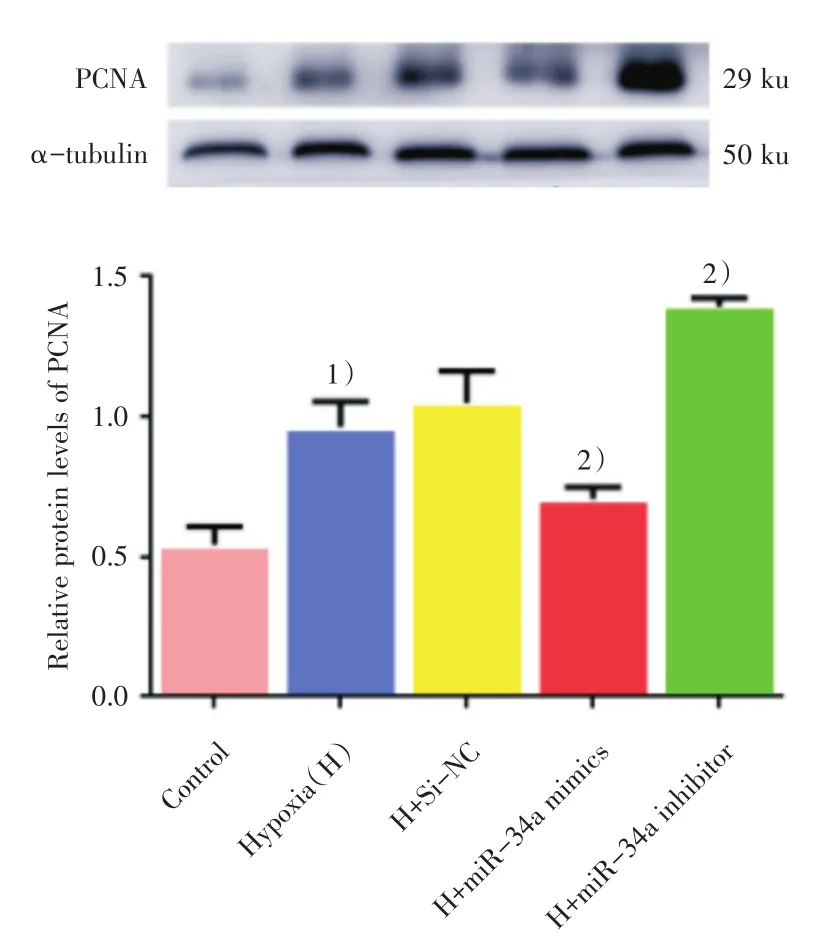
图6 低氧处理后过表达和抑制miR-34a后PASMC中PCNA蛋白的表达Fig.6 Effect of overexpression and inhibition of miR-34a on PCNA proteinexpression in PASMC under Hypoxia
3 讨论
缺氧性肺血管收缩和肺血管结构重构为HPH的主要病理学变化特点,而PASMC是在慢性缺氧过程中参与肺血管结构重建的关键细胞,也是缺氧造成肺血管收缩的主要效应细胞。既往研究表明,PASMC的异常增殖、凋亡和迁移是肺血管重建中最重要的病理生理特点。在本研究中,我们首先原代分离和培养了大鼠PASMC,并给予体积分数3%的低氧处理48 h后,用EDU染色法检测细胞增殖后发现,3%低氧48 h后,大鼠PASMC的EDU阳性染色率显著提高,提示低氧可促使PASMC的增殖活性增强,这与众多学者的研究结果是一致的[6-7]。
miRNA是近年来发现的一类长度约21 bp的内源性非编码小RNA分子,可以通过诱导靶基因mRNA的降解、抑制等抑制靶基因的表达。在细胞分化、细胞增殖、细胞凋亡和肿瘤的发生及发育中扮演重要角色[8]。在缺氧环境下,microRNA的表达改变可以调节PASMC的增殖、凋亡、迁移等功能[9-12],从而参与了HPH的形成。有些microRNA通过诱导PASMC增殖、迁移及抑制凋亡等参与了HPH的形成[13-16],而另外还有一些microRNA则是通过抑制PASMC增殖、诱导凋亡及抑制平滑肌细胞表型转化的作用防治了HPH的发生[17-18]。因此,近年来关于miRNA在HPH的发生发展中的作用成为研究和关注的热点之一。
miR-34家族是一个保守的miRNA家族,为近年来备受关注的miRNA之一,包括miR-34a、miR-34b和miR-34c三个成员[19]。已有许多实验证明miR-34a通过负调细胞周期蛋白、细胞增殖信号分子和凋亡抑制因子导致细胞周期终止、细胞凋亡和衰老[4],尤其在肿瘤的发生发展中发挥着重要的调控作用。然而miR-34a在低氧性肺血管重建中的研究甚少。因此,在本研究中,我们首先在缺氧条件下观察了大鼠PASMC中miR-34a的表达情况。结果显示,低氧后大鼠PASMC中miR-34a的表达明显降低,尤其低氧48 h后,降低更明显,差异有统计学意义(P<0.05),这与Wang等[20]的研究结果是一致的。因此,我们的结果提示在低氧下PASMC中miR-34a的下调可能参与了低氧诱导的PASMC的增殖。
Notch1是与细胞增殖密切相关的基因,已被证实为是miR-34a的靶基因之一[5],miR-34a 通过与Notch1基因3′-UTRs区的结合位点相结合来发挥负性调控作用。由此,我们推测miR-34a可能在HPH肺血管重构调控中发挥着重要的作用,而且是通过对Notch1的负性调控来发挥作用的。我们在缺氧条件下观察了大鼠PASMC中Notch1 mRNA水平的表达情况。结果显示,将原代培养的大鼠PASMC给予3%的低氧处理24和48 h后,PASMC中Notch1 mRNA的表达水平明显增高,尤其在低氧48 h后,Notch1在PASMC中的表达增高更明显,统计学有显著性差异(P<0.05),说明Notch1参与了低氧诱导的PASMC增殖过程,可能是由miR-34a的低表达负性调控了Notch1的表达,使低氧下PASMC中Notch1的mRNA水平表达显著增高从而引起PASMC的增殖。为了进一步明确是否通过这一调控通路发挥作用,我们又用miR-34a模拟物和抑制剂分别过表达和抑制miR-34a及用RNA干扰技术沉默靶基因Notch1后观察低氧诱导下的PASMC的细胞增殖情况。我们的研究结果显示,过表达miR-34a及沉默Notch1基因后,低氧诱导的PASMC的增殖明显被抑制,而用miR-34a抑制剂后PASMC细胞则显著增殖。我们又进一步检测了各处理组细胞中PCNA的表达,结果发现对大鼠PASMC给予3%的低氧刺激并过表达miR-34a或者抑制Notch1的表达后,细胞中PCNA的表达量明显降低,而给予miR-34a抑制剂后细胞中PCNA的表达是显著升高。这一结果提示在低氧诱导的PASMC细胞增殖过程中miR-34a参与了PASMC的增殖过程,且可能是通过上调Notch1引起了细胞增殖,其机制有待于进一步的研究。

