急性冠脉综合征冠脉血微粒内microRNA研究
袁玉娟 祖丽批亚·艾力 穆叶赛·尼加提
随着经济发展、人口老龄化以及糖尿病和肥胖的全球发生率增加,动脉粥样硬化性心血管疾病的发生率将逐年升高。2017年中国心血管病报告中指出中国心血管病(cardiovascular disease, CVD)发生率呈持续上升阶段,推算CVD现患人数2.9亿,其中冠心病1100万,心力衰竭450万[1]。美国心脏协会统计,每年约有250万人因急性心肌梗死住院,其中平均年龄>40岁的人群中约有18%的女性和23%的男性在被诊断为心肌梗死后一年内死亡[2]。动脉粥样硬化是一种进行性疾病,冠状动脉粥样硬化伴有腔内血栓的形成占急性心肌梗死(acute myocardial infraction, AMI)病例的80%[3]。
研究发现急性心肌梗死的动脉粥样硬化斑块的发病机制与脂质代谢紊乱、炎性反应、细胞间信号异常、内皮损伤、血小板激活、凝血酶生成、斑块破裂、血栓形成等多种因素密切相关[4]。除血小板和血液成分,局部血流动力学或动脉粥样硬化斑块成分参与调节动脉血栓形成,随着心血管领域血栓形成分子生物学机制的深入研究,发现来自内皮细胞、红细胞、单核细胞、平滑肌细胞和血小板的微粒在动脉粥样硬化的过程中扮演着重要的角色[5]。
微粒是细胞膜磷脂酰丝氨酸由细胞内层进入外层,以出芽的方式形成小泡状结构从细胞膜脱落,从而形成的磷脂囊泡,其直径在0.1~1.0μm。微粒来源包括血小板、白细胞、红细胞和内皮细胞,它的数量完全取决于各种刺激比如细胞的激活或者凋亡[6,7]。1967年Haematol等首次发现微粒当时被描述成一种细胞碎片[8]。现在越来越多的研究证明,微粒可作为很多系统疾病诊断及治疗的生物学标志物,包括心血管系统疾病、神经系统疾病和肿瘤疾病[9,10]。
前期研究发现急性冠状动脉综合征(acute coronary syndrome,ACS)患者的外周血微粒水平明显升高,其中红细胞源微粒、血小板源微粒以及内皮细胞源微粒参与 ACS 的发生、发展过程。在体外将ACS患者血浆中提取的不同浓度红细胞源微粒和血小板源微粒加入非冠心病患者血浆中,发现微粒诱导血栓形成的峰值前移,提示红细胞源微粒和血小板源微粒可能诱导凝血酶形成,从而证实 ACS 发生急性血栓与红细胞源、血小板微粒相关性[11~16]。
在微粒形成过程中,携带有来源母细胞的膜蛋白及胞内溶质分子,且发现在不同刺激因素调控下细胞释放的微粒所携带物质和含量不尽相同,使其可作为反映疾病状态的生物学标志物,同时微粒携带的表面抗原表型分子也可作为其分类筛选的依据。循环中微粒通过微粒表面蛋白与靶细胞表面蛋白识别并结合,激活靶细胞信号转导通路,从而对靶细胞进行调节,或者通过进入靶细胞内释放微粒所携带的蛋白质、mRNA、microRNA等物质调控靶细胞的功能状态[17]。
近年来循环血中microRNA作为心血管疾病的生物学标志物引来广泛关注。大量研究表明非编码RNA在表观遗传学修饰中扮演重要角色,能在基因组水平及染色体水平对基因表达进行调控,决定细胞分化的命运,microRNA在多种生理和病理过程中起关键作用,microRNA的功能损害与各种疾病和病理生理学相关[18]。microRNA是高度保守的非编码小分子RNA,是一类小的核糖核酸片段(约22个核苷酸),长约21~25nt的单链RNA,其中50%定位于易发生结构改变的染色体区域。作为内生翻译后调节基因,microRNA通过绑定在信使RNA上在反转录水平上调节基因表达,从而使信使RNA降解或翻译,故被看作是心血管生理及病理调节的关键[19]。
本研究通过提取冠脉血内微粒,分析所含microRNA表达差异谱,并进行靶基因预测及相应的功能分析,探讨微粒作为microRNA的运载体在ACS血栓形成中的作用,为冠状动脉内血栓形成的分子生物学机制提供理论依据。
材料与方法
1.研究对象:所有纳入对象均来自2017年10月~2018年2月,在笔者医院心内科住院的患者。根据严格的纳入标准和排除标准最终从42例住院患者筛选出15例纳入本研究,所有患者入院时告知研究内容并同时签署知情同意书。
研究对象分为 AMI 组(n=5)、UAP组(n=5)和稳定型冠心病组(n=5),收集研究对象的一般资料和心血管疾病相关危险因素,主要包括研究对象的一般资料,包括姓名、性别、体重指数(body mass index,BMI)、年龄、高血压病、2型糖尿病、吸烟、心脏射血分数、血脂、血糖等。
2.纳入标准:①UAP 为近1个月内新发的心绞痛或1个月内心绞痛恶化加重[心绞痛分级至少增加1级,或至少达到Ⅲ级,采用加拿大心血管病学会(Canadian Cardiovascular Society,CCS)分级],以及休息时发作的心绞痛,心电图有至少两个相邻到连出现新的或动态的ST段或T波改变,心脏肌钙蛋白 T(cTnT)检查正常;②AMI 为胸痛持续时间>20min,起病在24h内,心电图有至少两个相邻导联出现ST段抬高或压低,cTnT>0.1μg/L(正常值<0.05μg/L);③稳定型冠心病为冠状动脉造影术中诊断冠心病,非急性冠状动脉综合征患者,同时需要行支架置入术。
3.排除标准:①严重肝肾功能不全;②肿瘤性疾病;③造血系统疾病;④类风湿、系统性红斑狼疮和干燥综合征等自身免疫系统疾病;⑤脑梗死和肺栓塞。
4.样本收集:(1)冠状动脉血收集:研究对象行冠状动脉介入术时经桡动脉入路,术中导管进入冠状动脉,导丝到达病变部位,球囊进入病变斑块处,扩张球囊,其大小与病变血管相适,在球囊迅速排气后抽吸10ml冠状动脉血,球囊从导丝中撤离。(2)外周血收集:为避免冠状动脉造影及相关介入治疗影响生化指标,所有患者均在冠状动脉造影前进行外周血采集。标本为入院24h之内患者的外周血,获得知情同意书后,采集患者肘静脉血2ml,血常规、血脂等检测均在清晨空腹静息状态下抽取外周血送检。用柠檬酸钠抗凝管(美国BD公司)收集。在血液取样时保证止血带不应该保持太长时间,从而避免诱导细胞的激活或凋亡。
5.实验方法:(1)外周血红细胞源微粒的分离:①血标本以2000×g、室温下离心15min分离出红细胞(red blood cell,RBC)、白细胞(white blood cell,WBC)以及部分血小板。用一次性吸管将上清液移入无菌的1.5ml EP(Eppendorf)管中;②在23000×g、4℃离心20min后,弃掉上清液,沉淀物为无血小板的微粒,每管加入200μl磷酸缓冲盐溶液 PBS(phosphate buffer saline)溶液,连续吹打5min,样本与PBS溶液充分融合后,标本标明收集日期以及患者入组编号于-80℃保存以便将来使用。(2)RNA的抽提:采用 Qiagen serum/Plasma Kit-Qiagen#217184 并且根据生产厂商提供的标准操作流程进行样品的total RNA抽提,抽提所得total RNA经NanoDrop ND-2000分光光度计质检合格后备用。(3)芯片实验流程:①去磷酸化:使用Agilent′s miRNA complete labeling and hyb kit(p/n 5190-0456)试剂盒中的碱性磷酸酶CIP的作用来去除 RNA5′端磷酸基团;②RNA标记:使用上述试剂盒中的T4 RNA连接酶把Cyanine3-pCp连接到RNA3′端;③芯片杂交:按照Agilent miRNA芯片配套提供的杂交标准流程,在滚动杂交炉中55℃,20×g,滚动杂交20h,并在洗缸中洗片;④芯片扫描:完成杂交的芯片采用Agilent microarray scanner(Cat.# G2565CA, agilent technologies, Santa Clara, CA, US)进行扫描。用Feature Extraction software 10.7 读取数据,最后采用R软件包进行归一化处理。(4)差异基因筛选和结果展示:原始数据经归一化后,采用fold-change(表达差异倍数)以及t检验(Student′st-test)统计学方法对差异基因进行筛选,将筛选得到的不同组间的差异基因,通过散点图、火山图及热图等方法,进行直观的图形展示。(5)靶基因预测和功能分析:采用Target scan数据库进行靶基因预测,把所预测的miRNA靶基因向GO(gene ontology)数据库的各个条目(term)映射,计算每个条目的基因数目,然后应用超几何检验,与整个基因组背景相比,筛选在差异表达基因中显著富集的GO条目,同样方法通过KEGG(kyoto encyclopedia of genes and genomes)pathway行富集功能的预测。

结 果
1.ACS组和稳定性冠心病组临床基本信息和临床生化指标分析:两组患者在体重指数、是否合并糖尿病、是否合并高血压病方面比较,差异无统计学意义(P>0.05),AMI和SAP在吸烟方面比较,差异有统计学意义(表1)。
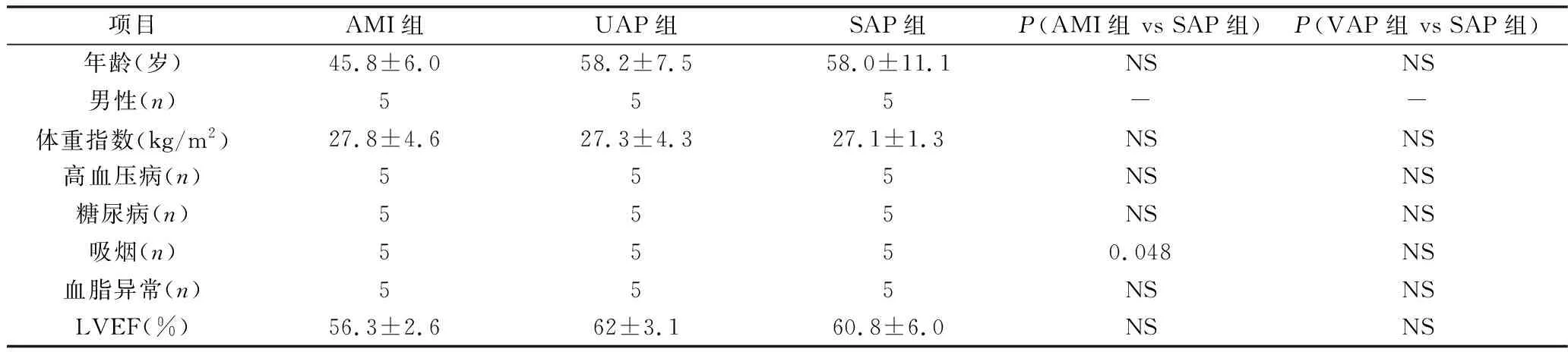
表1 两组患者临床基本信息和生化指标比较
AMI.急性心肌梗死; UAP.不稳定型心绞痛;SAP.稳定型心绞痛;NS.差异无统计学意义
2.微粒的鉴定:将离心获得微粒悬浮在PBS溶液中,于电子显微镜观察微粒的形态结构,可见其双模结果,直径为0.1~1.0μm,详见图1。

图1 ACS 外周血电子显微镜下微粒
3.差异基因结果:将筛选得到的不同组间的差异基因,通过散点图(图2、图3)、火山图(图4、图5)及聚类热图(图6、图7)进行直观的图形展示。
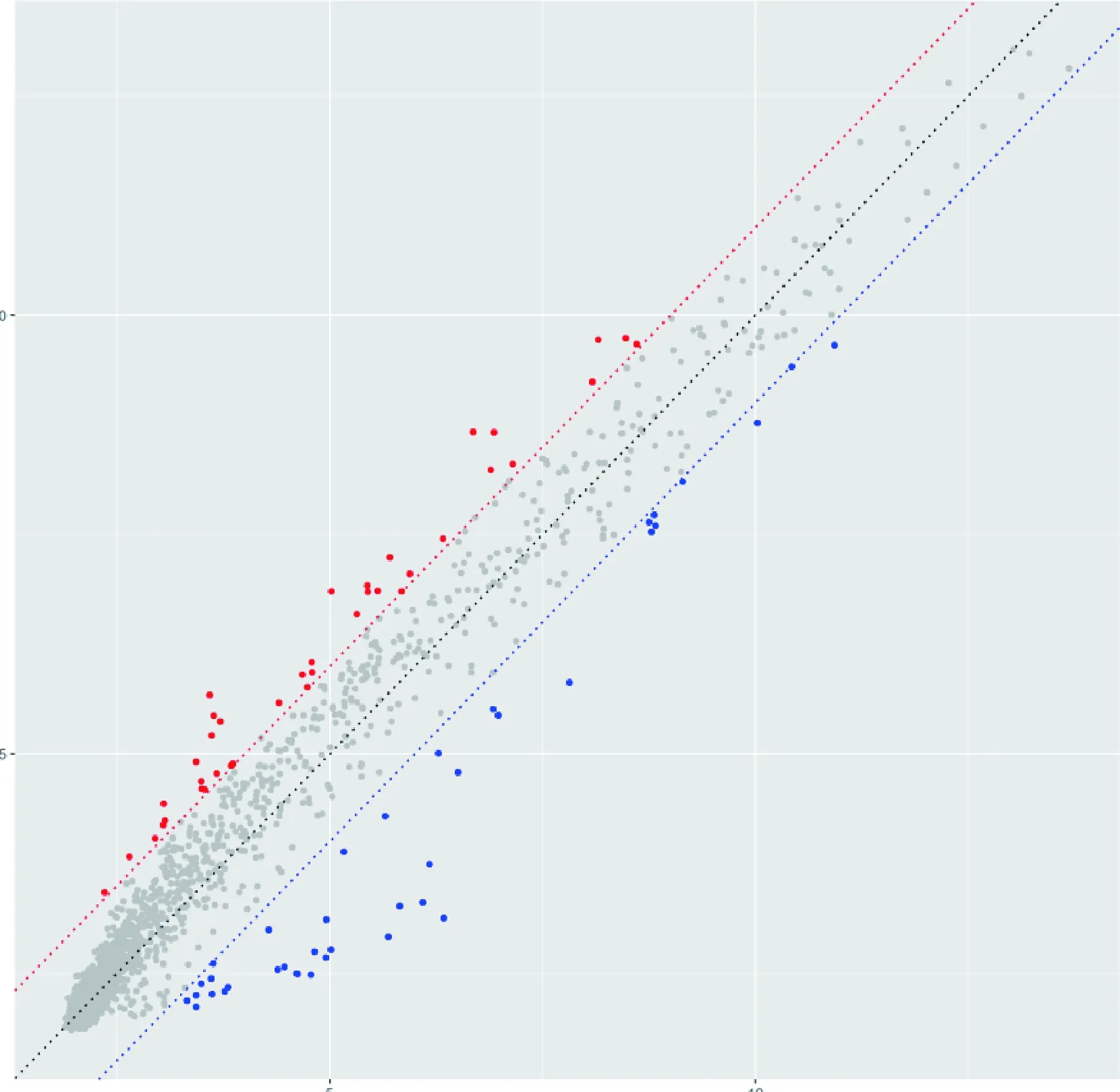
图2 急性心肌梗死和稳定型冠心病组差异microRNA 散点图

图3 不稳定型心绞痛和稳定型冠心病组差异microRNA 散点图

图4 急性心肌梗死和稳定型冠心病组差异microRNA 火山图
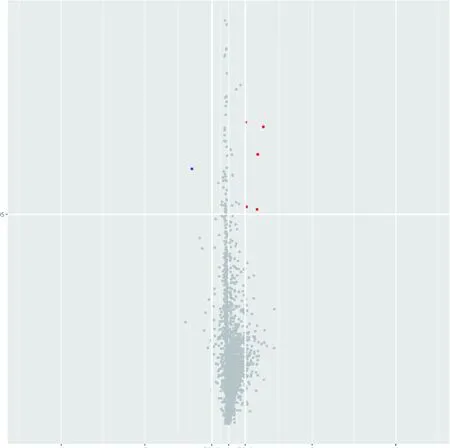
图5 不稳定型心绞痛和稳定型冠心病组差异microRNA 火山图
4.差异miRNA靶基因结果富集分析:分别做GO和KEGG分析。通过将差异基因做 GO 富集分析,可以把基因按照不同的功能进行归类,达到对基因进行注释和分类的目的,见图8、图9。将差达基因进行 KEGG 富集分析,可以把差异有统计学意义的pathway进行富集,有助于找到实验条件下显著性差异变化的生物学调控通路,见图10、图11。
讨 论
动脉粥样硬化是一种进行性疾病,是世界上心脏衰竭和死亡的主要原因,其病理生理机制涉及脂质代谢紊乱,慢性炎症和细胞间信号异常等[20]。MicroRNAs已经被广泛证实在病理性细胞间通讯中起着有效的信号作用,这是动脉粥样硬化发展的关键机制[21]。许多microRNAs调节动脉粥样硬化、脂质代谢、炎症等细胞外基质的含量[22]。研究证实,微粒作为miRNA的保护性载体,从而避免被核糖核酸酶降解,微粒内的microRNA不仅代表被释放的细胞碎片,也是细胞间信号转导的信使[23]。在心血管疾病患者外周血中的细胞微粒数量明显增多且其所含microRNA水平也与正常生理状态下循环系统的微粒microRNA水平比较差异有统计学意义,说明细胞微粒及其携带的microRNA在心血管疾病发生、发展和预后过程中起重要作用[24]。

图6 急性心肌梗死和稳定型冠心病组差异microRNA 聚类热图
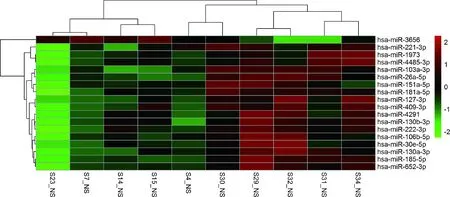
图7 不稳定型心绞痛和稳定型冠心病组差异microRNA 聚类热图
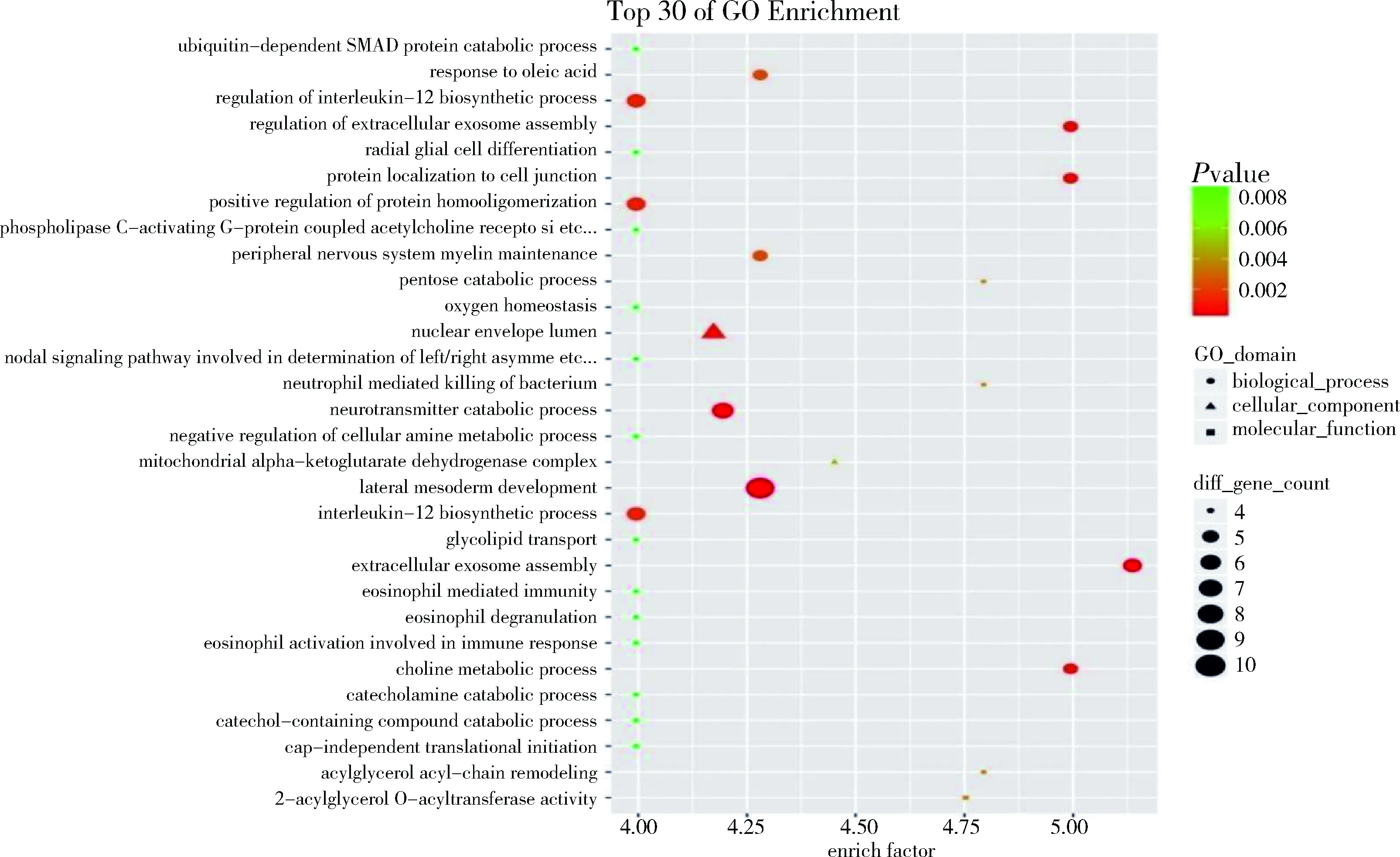
图8 急性心肌梗死和稳定型心绞痛组差异基因GO分析

图9 不稳定型心绞痛和稳定型心绞痛组差异基因GO分析
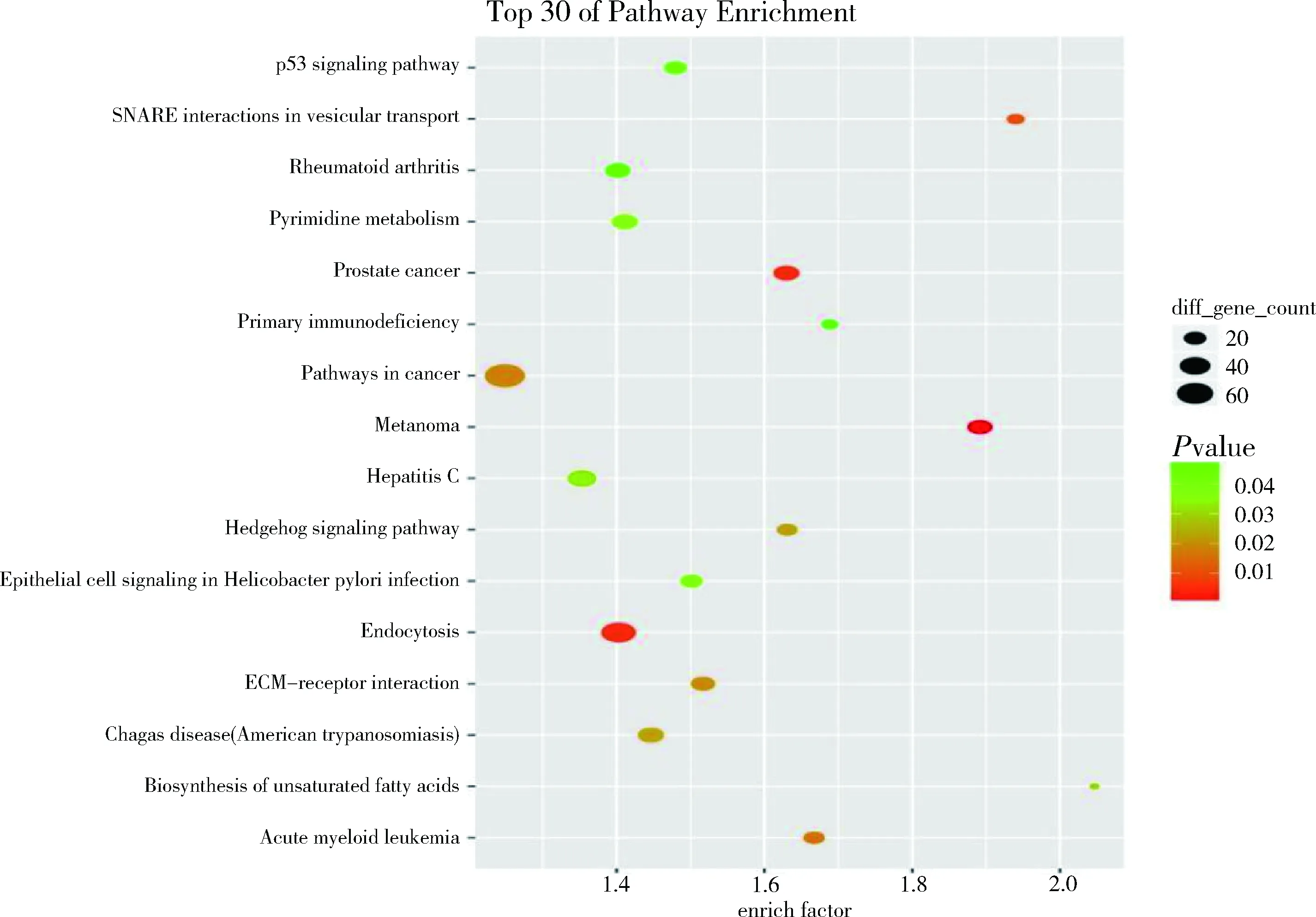
图10 急性心肌梗死和稳定型心绞痛组差异基因KEGG分析
图11 不稳定型心绞痛和稳定型心绞痛组差异基因KEGG分析
研究表明,典型的不稳定型心绞痛和血管造影证实的冠状动脉疾病患者的循环miR-19b水平明显高于血管造影阴性的对照患者,并且miR-19b主要被纳入内皮细胞源微粒(EMPs endothelial cells microparticles)中以维持循环中稳定的运输[25]。 EMPs 作为miR-19b在血管内皮细胞和其他细胞间通讯的重要载体。有研究通过小鼠尾静脉注射含有miR-19b微粒,证实含有miR-19b的微粒促进小鼠颈动脉局部脂肪沉积和炎性反应,从而加剧颈动脉粥样斑块的发展过程[26]。Zhang等[27]研究发现,AMI中EMPs水平明显高于CAD组,表明AMI内皮细胞活化的程度高于CAD,且AMI患者血浆中miR-92a的表达水平高于CAD及对照组。miR-92a 可能与心肌损伤有关,推测内皮细胞来源的 miR-92a 可能被 EMPs 从内皮细胞转移到心肌细胞,从而对心肌细胞造成损伤。
本研究在冠脉PCI术中抽取急性心肌梗死、不稳定型心绞痛和稳定型心绞痛冠脉血,离心获得的微粒经过芯片实验检测出差异表达microRNA,急性心肌梗死组与稳定型心绞痛组比较,microRNA差异表达基因共8个,其中上调的有hsa-miR-1268b、hsa-miR-4507、hsa-miR-575、hsa-miR-6875-5p、hsa-miR-7704,下调的有hsa-let-7i-5p、hsa-miR-127-3p、hsa-miR-209-3p,不稳定型心绞痛组microRNA差异表达基因18个,上调的有hsa-miR-3656,下调的有phsa-miR-181a-5p、hsa-miR-575、hsa-miR-26a-5p、hsa-miR-103a-3p、hsa-miR-342-3p等17个基因。通过Target scan数据库完成下游靶基因预测,其中急性心肌梗死组靶基因出现较多频率的有AGO2、GREM14、RHF1847和ZHF7884等,不稳定型心绞痛组有KCHJ6、PRRG3、RHF187等。差异microRNA靶基因结果分别做GO分析进行基因功能分析,通过KEGG分析得到差异有统计学意义的生物学调控通路。其中有意义的生物学途径急性心肌梗死组中正调控蛋白的同型低聚, 调节IL-12生物合成过程,细胞胞吞作用等,不稳定型心绞痛组中泛素样蛋白缀合酶活性,泛素结合酶活性,泛素介导的蛋白水解,神经营养印在信号转导途径等。
本研究通过冠脉介入术中抽吸冠脉血,获得冠脉局部血微粒,测定冠脉病变局部血微粒更能反应ACS发生、发展过程中微粒内microRNA变化,从而避免外周血受机体内环境干扰的影响因素,研究结果证实急性心肌梗死组、不稳定型心绞痛组与稳定型冠心病组冠脉血微粒所含microRNA具有明显差异,同时揭示微粒中microRNA的差异表达谱,提示冠脉血内微粒microRNA可能与ACS发生急性血栓事件相关。目前研究只是初步筛选出ACS患者冠脉血微粒内差异表达microRNA和生物学通路,具体通路机制需后续进行相关动物实验和临床试验进行研究。

