真空和面过程中面团蛋白质结构的变化
刘 锐 张影全 武 亮 孔 雁 邢亚楠 魏益民*
(1中国农业科学院农产品加工研究所 北京 100193
2农业农村部食物与营养发展研究所 北京 100081
3河北金沙河食品产业技术研究院 北京 100071)
和面是面条加工的关键环节,和面效果对后续加工和最终产品质量有重要影响。和面时间是影响和面效果的重要因素。和面时间不足,小麦粉吸水不均匀,面筋形成不充分;而和面时间较长,会使面筋延展过度,成熟的面筋网络受到破环,同时面团升温引起蛋白质变性[1]。研究和面过程中面团结构特性的变化,对理解和面过程中的物理化学变化,确定最佳和面时间,改善和面效果有重要意义。
真空和面是一种新型和面方式,其搅拌过程在真空状态下进行,水分可充分渗透至小麦粉颗粒内部,促进蛋白质、淀粉吸水的充足性和均匀性,保证面筋网络在和面及压延过程中充分形成[2-4]。Li等[5]和骆丽君等[6]研究表明,真空和面可以显著提高面条质量,改善生鲜面条的色泽,使其具有更加紧密、连续的面筋网络,降低其烹调损失,提高煮后面条的硬度和拉伸强度。刘锐等[7]研究表明,适宜程度的真空和面可以显著改善生鲜面条和冷藏面条的感官质量和烹调特性。研究真空和面过程中面团理化结构特性的变化,有助于揭示真空和面的作用机制,阐明和面时间影响面团质量的结构基础和作用机制。作者前期分析了真空和面过程中面团物理结构和水分结合状态的变化,发现和面时间适宜(8 min)时,面团质地紧实,微观结构致密、均匀,水分流动性较低[8-9]。然而,关于面团蛋白质结构的变化还需深入研究。
为明确真空和面过程中的低水分面条面团蛋白质结构的变化,以3个质量类型小麦品种磨制的面粉为材料,采用真空和面制作面团 (含水率35%),设定不同的和面时间,采用尺寸排阻高效液相色谱 (SE-HPLC)、激光衍射粒度分析仪、SDS-PAGE凝胶电泳、傅里叶变换红外光谱(FTIR)等技术手段分析蛋白质的组分、分子质量分布、亚基和二级结构,并讨论蛋白质特性的变化与面团质地的关系,以期为揭示低水分面团和面过程中的理化变化,分析真空和面改善面条质量的作用机制,探讨蛋白质结构与面团物理特性之间的关系提供参考。
1 材料与方法
1.1 材料
选用的3个小麦品种为郑麦366、宁春4号、济麦22。清理小麦样品后,根据籽粒硬度确定润麦加水量。硬麦加水量为16.5%,中硬为15.5%。润麦24 h,采用Buhler MLU 202实验磨制粉,出粉率约70%。
试验用小麦粉的质量性状如表1所示。郑麦366小麦粉的蛋白质和湿面筋含量高,面团稳定时间、最大拉伸阻力、延伸性均明显大于其它2种小麦粉,属于强筋小麦粉,其峰值黏度和崩解值也高于其它2种小麦粉。济麦22的蛋白质和湿面筋含量高于宁春4号,而面团稳定时间和最大拉伸阻力小于宁春4号,两者均属于中筋小麦粉[9-10]。
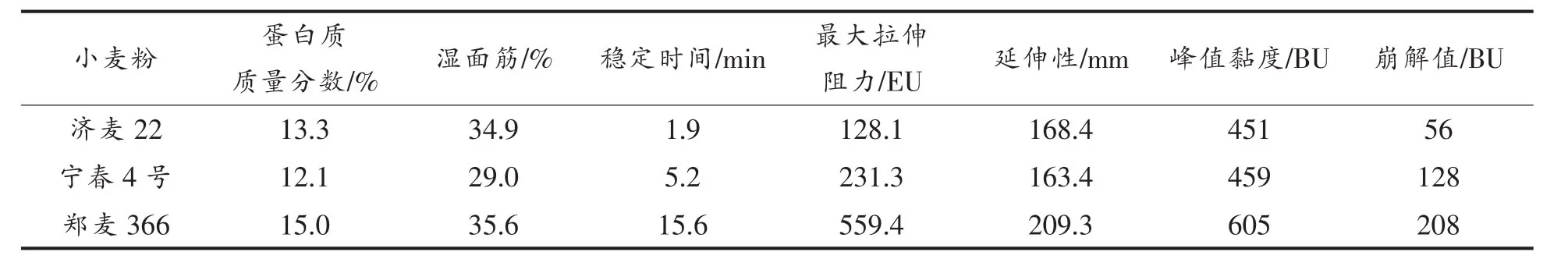
表1 3个品种小麦粉质量性状Table1 Flour quality properties of three wheat cultivars
1.2 主要仪器与设备
DA 7200型近红外分析仪,瑞典Perten公司;粉质仪,德国Brabender公司;拉伸仪,德国Brabender公司;MVAG803202型微量快速黏度仪,德国Brabender公司;真空和面机,河南东方面机集团有限公司;S3500 Bluewave型激光粒度分析仪,美国Microtrac公司;Kjeltec TM 2300凯式定氮仪,丹麦Foss公司;Ymnl-150Y超声波细胞破碎仪,南京以马内利仪器设备有限公司;1200高效液相色谱仪,美国Agilent公司;TSK-gel G4000 SWxl排阻色谱柱,日本TOSOH公司;PROTEAN II xi Cell垂直电泳仪,美国Bio-Rad公司;Tensor 27傅里叶变换红外光谱仪,德国Bruker公司;JMTD-168/140试验面条机,北京东方孚德技术发展中心;ALPHA 1-2LD PLUS真空冷冻干燥机,德国CHRIST公司;ZM200超离心粉碎机,德国Retsch公司;ComfortTM恒温混匀仪,德国Eppendorf公司;3-30K高速台式冷冻离心机,德国SIGMA公司。
1.3 和面试验设计
准确称量2 000 g小麦粉于真空和面机中,加入适量蒸馏水,控制面团最终含水量为35%,启动和面机;先低速搅拌 (85 r/min)1 min,然后高速(125 r/min)搅拌 3 min,再低速搅拌(85 r/min);真空泵在低速搅拌1 min后启动,真空度设置为0.06 MPa。低速和面时间分别设置为0,4,8 min,即真空和面总时间为 4,8,12 min。
每种小麦粉在3个和面时间下各重复和面2次,和面试验共18次。
1.4 试验方法
1.4.1 样品处理方法 将和面后的絮状面团取出,于液氮中快速冷冻,然后真空冷冻干燥24 h,绝对真空度为3.7×10-5MPa,冷冻阱温度-40℃。对冻干后的样品采用Retsch ZM200超离心粉碎机粉碎,选用0.50 mm筛圈,转速10 000 r/min。
1.4.2 GMP含量及粒度分布分析 取50 mg冻干面团样品中加入1 mL质量分数1.5%的SDS溶液,漩涡振荡混匀,30℃恒温振荡30 min,25℃15 500 g离心15 min,弃上清液,采用凯氏定氮法测定沉淀中的蛋白质含量作为GMP的近似含量[11]。每个样做2次重复,取平均值。
参照Don等[12]和曹丽等[13]的方法,略作修改。称取1.5 g冻干样品,置于50 mL离心管中,加1.5%SDS溶液30 mL,漩涡振荡混匀,30℃恒温振荡30 min,25℃ 80 000 g离心30 min,弃上清液。将1 g上层蛋白质凝胶转移到10 mL离心管中,加入5 mL 1.5%SDS溶液,混匀。采用激光粒度分析仪分析。
1.4.3 体积排阻高效液相色谱(SE-PHLC) 蛋白质的提取参照Hou等[14]的方法。将160 mg冻干面团样品中加入20 mL 1%SDS-0.1 mol/L磷酸钠缓冲液(pH 6.9),漩涡振荡混匀。采用Ymnl-150Y超声波细胞破碎仪,以5 W功率超声破碎3 min,然后置于Thermomixer上,65℃恒温振荡 30 min,37 000 g离心30 min。将上清液过0.45 μm 滤膜。每种处理的样品重复提取2次,每份提取液上样测定2次。
色谱系统:Agilent 1200高效液相色谱仪。色谱柱:TOSOH TSK-gel G4000 SWxl。色谱条件参照 Hou等[14]和 Mujoo等[15]。流动相 0.1%SDS-0.1 mol/L磷酸盐缓冲液 (pH 6.9),流速0.7 mL/min,进样量20 μL。采用1200二级管阵列检测器,检测波长210 nm。采用Sigma排阻色谱蛋白质标准品:甲状腺球蛋白(670 000)、γ-球蛋白(150 000)、清蛋白(44 300)、核糖核酸酶 A(13 700)。
参照 Johansson 等[16]、Mujoo 等[15]、Kuktaite 等[17]和Hussain等[18]的方法,根据洗脱蛋白的分子质量将色谱图分为4个部分,用Agilent ChemStation software计算吸收峰面积和面积百分比。
1.4.4 SDS-PAGE凝胶电泳 样品的制备:称取50 mg(干基)冻干面团,加入1 mL样品溶解液(0.05 mol/LTris-HCl缓冲液,pH 6.8,其中含有 2%SDS,5%(体积分数)2-巯基乙醇,10%(体积分数)甘油,0.1%溴酚蓝,混匀后室温振荡30 min,100℃加热5 min,然后8 000 g离心5 min。每种处理的样品重复提取2次,每份提取液上样测定2次。低分子质量标准蛋白 (北京索莱宝科技有限公司):磷酸化酶b 97.4 ku、牛血清白蛋白66.2 ku、肌动蛋白43.0 ku、碳酸酐酶31.0 ku、胰蛋白酶抑制剂20.1 ku、溶菌酶14.4 ku。
电泳条件:采用Bio-RadPROTEAN II xi Cell凝胶电泳系统,胶厚度1.0 mm,宽20 cm,长20 cm。 使用5%浓缩胶(pH6.8)和10%分离胶(pH 8.8),每道上样30 μL。电流恒定在10 mA,溴酚蓝指示剂迁移至胶底时停止电泳。用考马斯亮蓝染色,脱色液 (V醋酸∶V乙醇∶V蒸馏水=1∶0.5∶8.5,体积比)脱色。
1.4.5 蛋白质二级结构分析 图谱扫描:称取冻干面团约2 mg,加入优级纯溴化钾作为稀释剂,在玛瑙研钵中充分研磨后压片,14 kg压力保持1 min,然后将制得的均匀透明薄片放入傅里叶变换红外光谱仪中测定。光谱扫描范围400~4 000 cm-1,分辨率4 cm-1,信号扫描累加64次。每种处理的样品重复测定4次。
图谱处理:采用仪器自带的红外光谱软件OPUS 5.5和Peak Fit 4.12对图谱进行分析处理。首先对所得原始吸收图谱进行背景扣除和水分、CO2气氛补偿,然后对位于酰胺I带(1 600~1 700 cm-1)的吸收峰进行二阶导数、傅里叶自退去卷积分析,使得叠加的各子峰得以分辨。1 600~1 625和1 625~1 640 cm-1所对应的谱峰是分子间和分子内 β-折叠[19],1 644~1 652 cm-1是无规则卷曲,1 652~1 660 cm-1是 α-螺旋,1 660~1 685 cm-1是 β-转角[20-21]。
1.5 统计分析
采用Excel 2007进行数据整理和图表绘制。采用SPSS 16.0中的One-Way ANOVA程序对不同处理条件下得到的试验数据进行方差分析,用LSD法进行多重比较。用Bivariate Correlations程序进行相关分析,用Pearson相关系数、Two-tailed显著性检验。
2 结果与分析
2.1 谷蛋白大聚体(GMP)含量及粒度分布
谷蛋白大聚体(GMP)是小麦籽粒中最重要的蛋白质聚合体,其含量和粒度分布与面团特性和面制食品加工品质密切相关[12,22-24]。
2.1.1 GMP含量 图1显示真空和面过程中GMP含量的变化,和面时间0 min代表小麦粉。强筋小麦郑麦366制作的小麦粉、面团、面片,其GMP含量均明显高于其它2种小麦粉,这与前人[22-25]研究结论一致。GMP含量高的小麦品种,面筋含量高,强度和弹性大。对于3种小麦粉,在和面的初始阶段(0~4 min),GMP 含量显著下降(P<0.05),这与 Skerrit等[26]和 Don 等[12]的研究结果一致。Skerrit等[26]认为,GMP含量的降低是由于和面时谷蛋白聚合体发生化学降解,而Don等[12]认为和面时的物理机械作用是GMP解聚的主要原因。从图1可以看出,4~8 min,GMP含量无显著变化。进一步延长和面时间至12 min,GMP含量显著下降(P<0.05),表明过度搅拌导致GMP的进一步解聚。这可能是由于在过度搅拌的面团中,所提取的GMP的平均分子质量降低[26]。这与Kuktaite等[17]的研究结果一致,即面筋质中的大分子不溶性谷蛋白聚合体(large UPP)和总的不溶性谷蛋白聚合体(total UPP)从最低搅拌时间到最佳搅拌时间无显著变化,而在过度搅拌之后会显著下降。
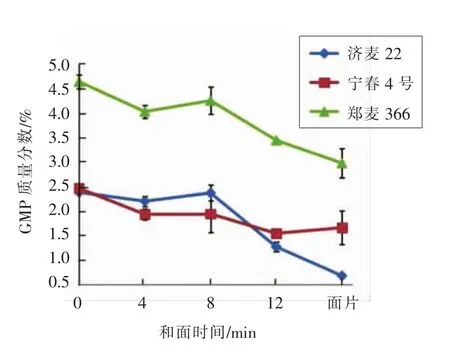
图1 真空和面过程中面团GMP含量的变化Fig.1 Change of GMP content in noodle dough during vacuum mixing
2.1.2 GMP粒度分布 小麦胚乳中GMP以球形颗粒形式存在,粒径范围1~300 μm;其粒度分布反映其聚合程度,与面团特性和烘焙品质密切相关[12,24,27]。 采用激光衍射法分析小麦粉、面团、面片中提取的GMP的粒度分布。3种小麦粉中的GMP粒度分布如图2所示。以体积百分比表示GMP粒度分布,呈3峰曲线,粒径从1~148 μm。第1个峰值出现在5 μm左右,第2个峰值出现在26~31 μm之间,第3个峰值出现在80~88 μm之间。
和面过程中GMP粒度分布呈显著变化 (表2)。对于济麦22,从小麦粉到4 min面团,大粒径(d>100 μm)GMP 的体积百分比略有降低;从 4~8 min,大粒径 GMP体积百分比显著增高(P<0.05);延长和面时间至12 min,复合成面片,这一过程中,大粒径 GMP 和中粒径(10≤d≤100 μm)GMP的体积百分比持续降低,而小粒径(d<10 μm)GMP显著增高(P<0.05)。对于宁春4号,从小麦粉到4 min面团,中粒径GMP体积百分比显著降低,而小粒径 GMP 显著增多(P<0.05);从 4~8 min,中粒径GMP的体积百分比相对增加;过度和面(12 min)会导致中粒径GMP体积百分比显著降低(P<0.05),而小粒径GMP增多。面团复合压延成面片后,GMP粒度分布无显著变化。对于郑麦366,从小麦粉到4 min面团,中粒径GMP体积百分比显著降低,小粒径 GMP 显著增多(P<0.05);和面时间为12 min时,中粒径GMP体积百分比较低。面团进一步复合成面片,大粒径GMP体积百分比降低,显著低于4 min面团,而中粒径GMP增多。
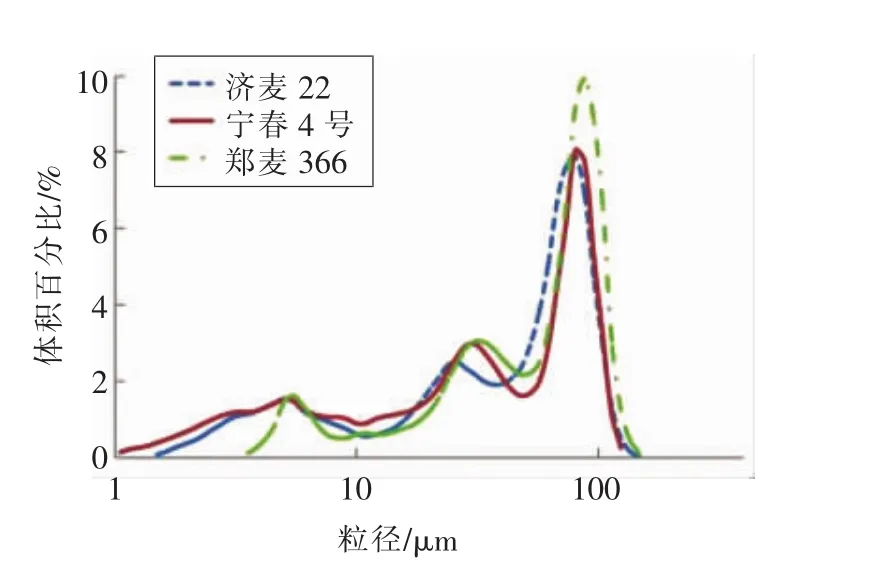
图2 3种小麦粉中GMP粒度分布Fig.2 Distribution of GMP particle size in three kinds of wheat flour
3种小麦粉,从小麦粉到和面4 min,GMP粒度分布减小,其中宁春4号和郑麦366的变化较为显著;和面时间由4 min延长至8 min,面团中的GMP粒度增大,济麦22的变化达到显著水平;延长和面时间至12 min,GMP粒径分布变小,以济麦22的变化最为显著;济麦22面团复合形成面片后,GMP粒度分布显著降低,郑麦366降低,而宁春4号的变化不显著。与宁春4号和郑麦366相比,济麦22的GMP粒度分布在和面过程中的变化更为明显。
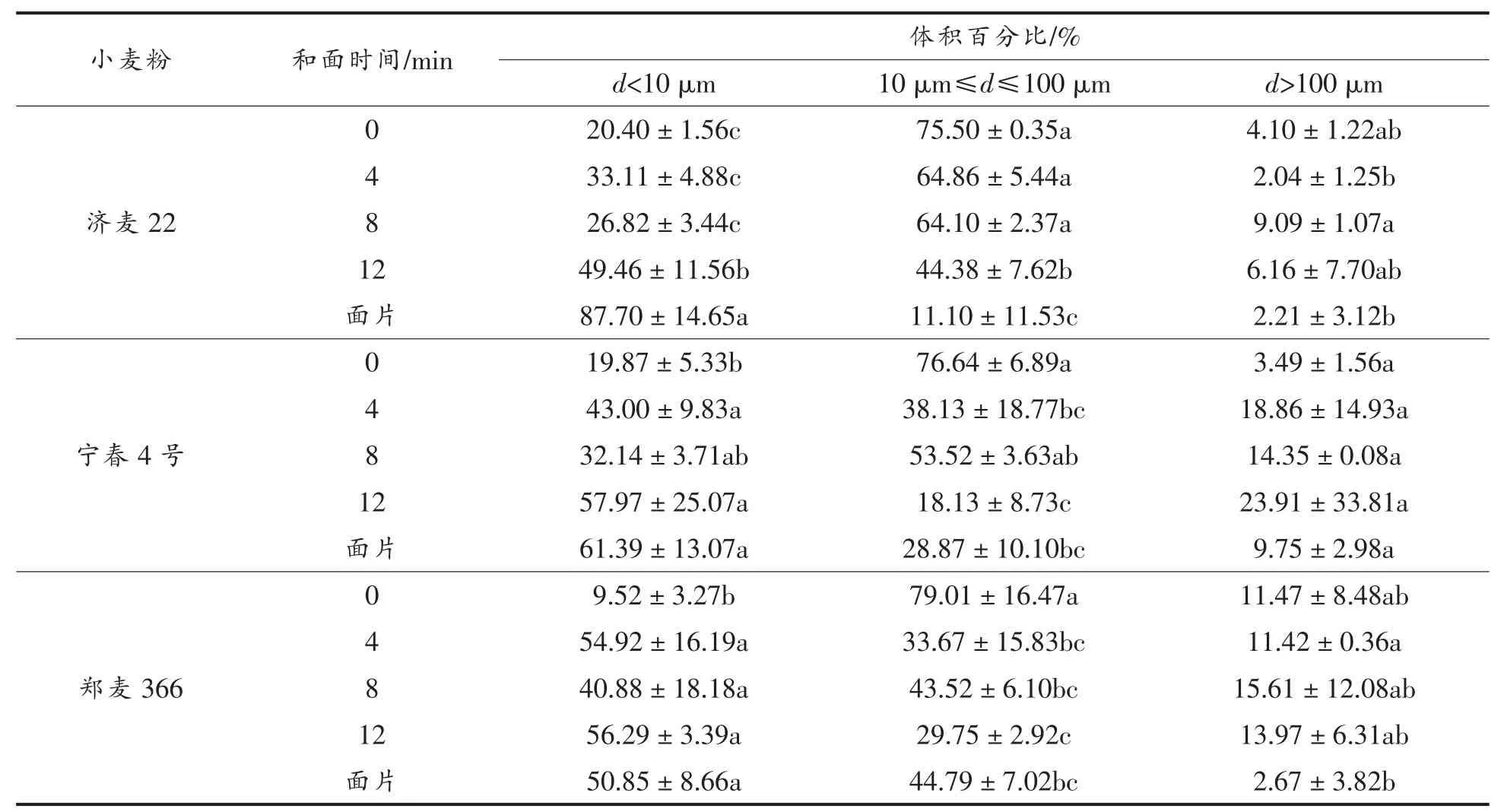
表2 真空和面过程中GMP粒度分布的变化Table2 Change in volume distribution of GMP during vacuum mixing
2.2 蛋白质分子质量分布
如图3所示,面条面团样品中蛋白质的排阻高效液相色谱图分成4个部分,这与Johansson等[16]、 Mujoo 等[15]、Kuktaite 等[17]、Hussain 等[18]关于小麦蛋白的排阻色谱图结果相似。峰1(6.0~7.5 min)和峰 2(7.5~10.8 min)分别对应大分子质量聚合体蛋白(LPP)和小分子质量聚合体蛋白(SPP),主要为谷蛋白;峰 3(10.8~13.2 min)对应大分子质量单体蛋白(LMP),主要为醇溶蛋白;峰 4(>13.2 min)对应小分子质量单体蛋白(SMP),主要为清蛋白和球蛋白[15-16]。
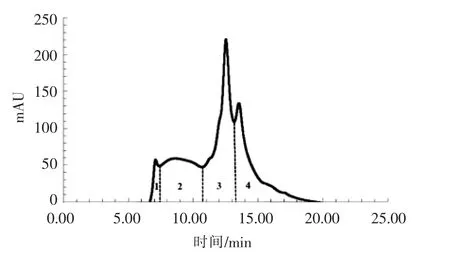
图3 某一面条面团中小麦蛋白的排阻高效液相色谱图Fig.3 Size-exclusion HPLC chromatogram of wheat proteins in a noodle dough sample
如表3所示,真空和面过程中蛋白质组分发生显著性变化。济麦22,从小麦粉到4 min面团,SPP百分比显著降低,SMP百分比显著增加(P<0.05);从4~8 min,SPP和LMP百分比显著增高,而SMP百分比显著降低(P<0.05);延长和面时间至12 min,SPP和LMP百分比显著降低,而SMP百分比显著增高 (P<0.05);复合压延成面片后,LMP显著增多,而SMP显著减少(P<0.05)。宁春4号,从小麦粉到4 min面团,LPP百分比增加,其它组分无显著变化;和面时间从4 min延到8 min,蛋白质组分无显著变化;和面时间为12 min时,面团蛋白中LMP显著增多,SMP显著减少 (P<0.05);面团压制后,SMP百分比显著增加(P<0.05),LPP和SPP百分比相对降低。对于郑麦366,从小麦粉到4 min面团,SPP百分比显著降低(P<0.05),而 LMP 和 SMP 百分比略有增加;从 4~8 min,LPP百分比显著增高,而SPP百分比显著降低(P<0.05);和面时间过长(12 min)导致面团中LPP 显著减少,而 SPP 显著增多(P<0.05);面团复合成面片后,LMP显著增多,而SMP显著减少(P<0.05)。
对于济麦22和郑麦366,小麦粉加水和面4 min,所含聚合体蛋白比例减少,单体蛋白增多,表明谷蛋白聚合体发生解聚,蛋白质分子质量分布降低;4~8 min,面团中的蛋白质聚合度增加,分子质量分布增大;而宁春4号在这一过程中变化不显著。和面时间为12 min时,3种小麦粉面团的蛋白质聚合程度显著降低,分子质量分布变小。对于济麦22和郑麦366,面团复合形成面片后,小分子质量单体蛋白减少,蛋白质聚合度有所增加;而对于宁春4号,蛋白质聚合度降低。在复合压延过程中,可能同时存在两种相反的变化,一是大分子聚合体蛋白在机械作用下发生解聚;二是在轧辊的挤压作用下,蛋白质分子间的距离降低,小分子单体蛋白通过二硫键或是非共价键聚合。蛋白质特性不同的面团在复合过程中发生的主要变化可能存在差异,从而导致不同结果,这还需进一步的研究其中的规律。
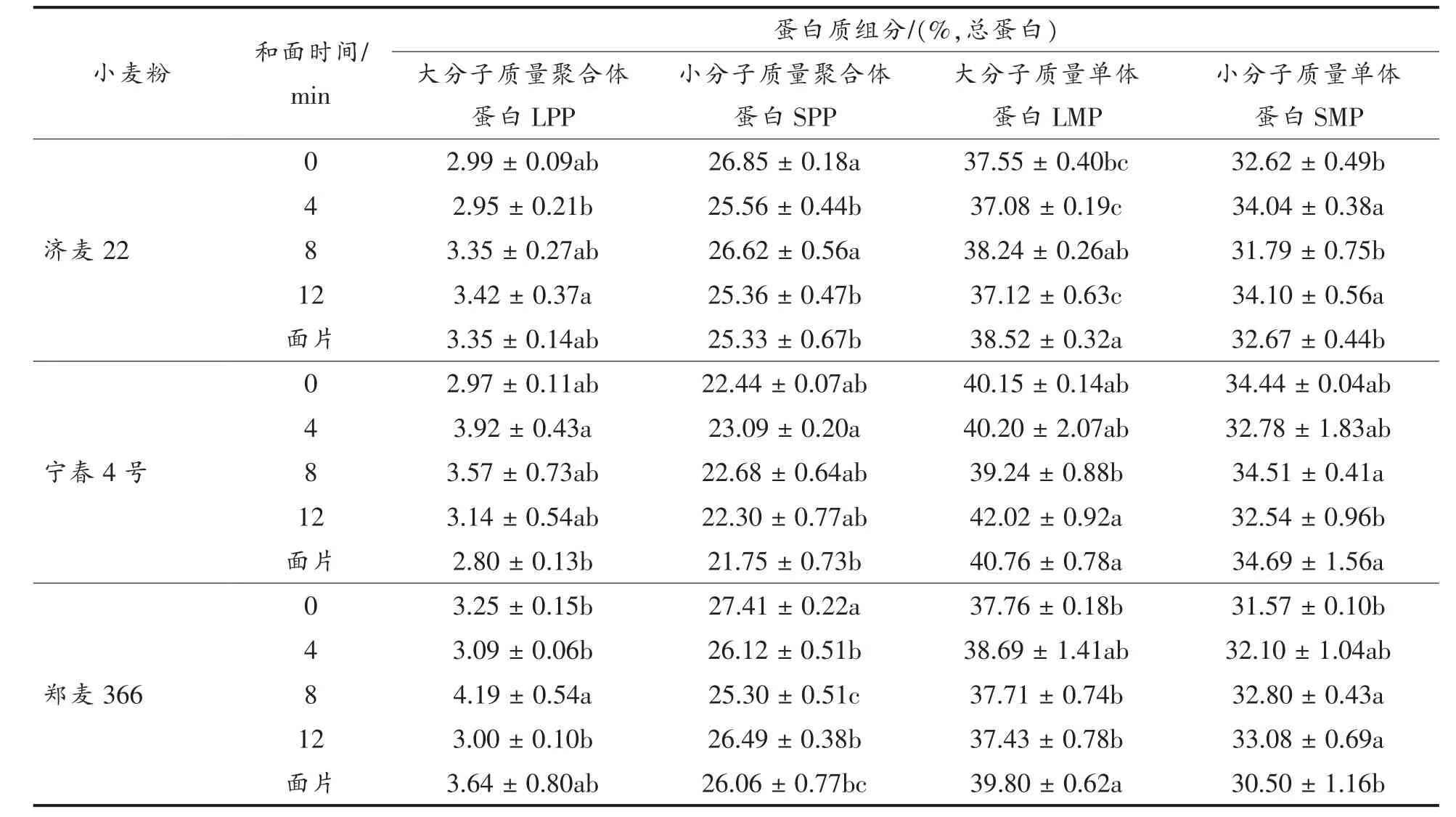
表3 真空和面过程中蛋白质组分的变化Table3 Change in protein composition during vacuum mixing
2.3 蛋白质亚基
SDS-PAGE电泳分析中,在还原条件下未检测到大分子质量蛋白质聚合体,这是由于蛋白质提取液中含有还原剂β-巯基乙醇。图4为小麦粉、面团、面片中蛋白质的SDS-PAGE电泳图。参照An等[28]和Hou等[14]的方法,根据分子质量大小将蛋白亚基分为3部分,包括高分子质量谷蛋白亚基(>84 ku)、低分子质量谷蛋白亚基和醇溶蛋白(84~29 ku)、清蛋白和球蛋白(<29 ku)。不同试验处理的蛋白质电泳条带间无显著差异,表明蛋白质亚基组成在真空和面过程中无显著变化。这一结果与SE-HPLC分析结果(表3)的差异,证实蛋白质的聚合主要是通过二硫键的作用。
2.4 蛋白质二级结构
如图5所示,3种小麦粉的蛋白质二级结构中,β-折叠所占百分比最高,其次为β-转角或α-螺旋;而面条面团的蛋白质二级结构中,β-转角所占百分比最高,其次为β-折叠、无规则卷曲和α-螺旋。这表明小麦粉中的蛋白质水合后,二级结构组成改变,β-折叠和α-螺旋减少,而β-转角和无规则卷曲增多。Bock等[20-21]认为,面筋水合程度增大会导致β-折叠减少和β-转角增多。Bock等[20]研究显示,在含水率35%的模型面团中,二级结构中大约55%为β-转角,4种二级结构的排序为β-转角>β-折叠>无规则卷曲>α-螺旋。这与本研究结果一致。
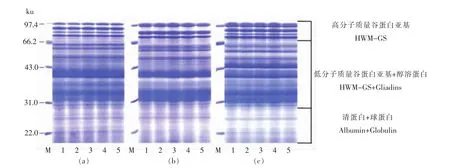
图4 真空和面过程中蛋白质的SDS-PAGE电泳图Fig.4 SDS-PAGE patterns of total protein in noodle dough samples during vacuum mixing for three wheat flours
和面时间不同的面团,其蛋白质二级结构差异显著(图5)。济麦22,和面时间从4 min增到8 min,β-转角百分比显著提高,而β-折叠和无规则卷曲百分比显著降低(P<0.05);较长的和面时间(12 min)导致β-转角百分比显著降低和β-折叠、无规则卷曲、α-螺旋百分比显著增加(P<0.05)。宁春4号,与4 min和12 min的面团相比,8 min面团中的α-螺旋百分比显著较高,而β-转角百分比显著较低(P<0.05)。 郑麦 366,和面时间从 4 min增到8 min,β-转角结构显著增多 (P<0.05);从8 min增到12 min,α-螺旋结构显著增加,而β-转角显著减少(P<0.05)。
整体来看,济麦22面团在8 min时,β-转角较多而β-折叠和无规则卷曲较少。Bock等[20-21]提出,面筋水合程度增大会导致β-折叠的减少和β-转角的增多。Jazaeri等[29]认为β-折叠少而β-转角多时,面团强度较大。据此推断,和面时间为8 min时,面筋蛋白的水合程度最大,面筋网络结构形成最充分。这与作者前期采用NMR和DSC技术分析面团中水分状态的结果相对应[8]。不同小麦粉的蛋白质特性不同,其二级结构在和面过程中的变化规律也不尽相同。宁春4号,和面8 min时,α-螺旋百分比显著较高。 Li等[3]认为,α-螺旋的增加可使整个蛋白结构变得更为有序。郑麦366,和面过程中,初期随着搅拌时间延长,β-转角结构显著增多,表明面筋蛋白水合变得更充分;继续搅拌,β-转角减少而α-螺旋结构显著增多,表明较长时间的和面使结构变得更加有序。关于低水分面团中α-螺旋和β-转角结构间的转化对面筋和面团特性的影响还需进一步的研究。
3 讨论
作者前期研究了和面时间对面条面团质地和内部水分状态的影响,结果表明,和面时间适宜(8 min)时,面团质地紧实,微观结构致密、均匀,水分流动性较低[8-9]。本研究结果表明,和面时间8 min时,GMP含量较高,粒度较大,蛋白质聚合度增加,α-螺旋或β-转角增多。通过对比分析、推断,低水分面团物理特性改善可能与面筋蛋白水合程度提高,蛋白质聚合度和分子质量增加,二级结构β-转角或α-螺旋增多有关。这与作者前期的研究结论相对应,面团质地的改善与谷蛋白大聚合体(GMP)增多和二硫键交联有关[2,9]。
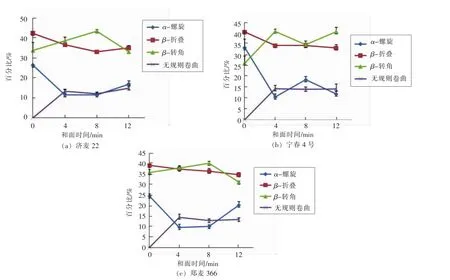
图5 真空和面过程中蛋白质二级结构的变化Fig.5 Change in protein secondary structures during vacuum mixing
不同质量特性的小麦粉,蛋白质结构在和面和轧制过程中的变化不尽相同。这与作者前期的研究结果一致。原料小麦粉特性与和面方式存在互作,蛋白质含量高、面筋筋力强的小麦粉在和面过程中较为稳定,真空度、和面时间对其面团理化特性的影响较小[2,9]。蛋白质特性不同的小麦粉,其蛋白质组成、分子质量分布、化学交联程度、二级结构均存在差异,这些化学结构的不同会导致其在和面过程中的变化规律不同,其机理及小麦粉与加工工艺的适用性等问题还需进一步研究。
4 结论
1) 和面初始阶段(0~4 min),单体蛋白增多,聚合体蛋白比例减少,GMP含量显著下降,粒度分布减小,蛋白质分子质量分布降低。和面时间由4延至8 min,GMP粒度增大,蛋白质聚合度增加,相对分子质量增大。过度和面导致GMP含量下降,粒径分布变小,游离巯基含量增加,蛋白质聚合度降低。面团质量可能与蛋白质聚合度和分子质量的增加、分子内二硫键的交联有关。和面过程中蛋白质亚基组成无显著变化。
2)小麦粉中蛋白质水合后,二级结构发生改变,β-折叠和α-螺旋减少,而β-转角和无规则卷曲增多。济麦22面团8 min时,二级结构中的β-转角较多而β-折叠和无规则卷曲较少。宁春4号,和面8 min时,α-螺旋百分比显著较高。郑麦366,和面初期随着时间的延长,β-转角结构显著增多;继续搅拌,β-转角减少而α-螺旋结构显著增多。α-螺旋或β-转角增多可能与面筋蛋白水合程度提高和低水分面团物理特性改善有关。

