致敏小鼠血清代替过敏患者血清筛选Jug r 1 IgE线性抗原表位的可行性研究
徐淇淇 张亚妮 李欣芮 范卓妍 车会莲
(北京食品营养与人类健康高精尖创新中心 中国农业大学食品科学与营养工程学院 北京 100083)
食物过敏原在引发机体产生特异性免疫应答的过程中主要是通过抗原表位来实现的[1]。抗原表位,又称为抗原决定簇,是指抗原分子表面上具有特殊结构和免疫活性的化学基团,能够刺激机体产生抗体或特异性淋巴细胞,且能够被免疫系统识别的免疫活性区域[2]。根据受体结合细胞可以将抗原表位分为T细胞表位和B细胞表位。其中,经过抗原呈递细胞处理,由主要组织相容性复合物分子(MHC)呈递,并被T细胞表面受体所识别的称为T细胞表位;而被抗体或B细胞表面受体直接识别的即为B细胞表位[3]。根据抗原表位结构的连续性可以分为线性表位和构象表位。线性表位,即连续性表位,通常是由肽链上邻近连续的氨基酸组成;而构象表位,即不连续性表位,是由空间邻近,分布在不同肽链上或相同肽链的不同部位的不连续的氨基酸组成。线性表位通常属于T细胞表位和B细胞表位,而构象表位一般都属于B细胞表位[4]。因过敏原进入机体,被抗原呈递细胞处理后过敏原的空间结构遭到破坏,通常会变成小段连续的短肽段,而B细胞可以直接识别完整的过敏原。本文研究的IgE线性抗原表位即属于B细胞线性表位,通常由8~12个氨基酸构成,且具有溶剂可及性高,可塑性好,亲水性强等特点。目前,研究抗原表位的方法主要有合成重叠肽库、生物信息学预测、肽段活性鉴定、噬菌体展示技术、X射线衍射和核磁共振分析等。其中大多数方法是针对构象表位的研究。随着科学技术的发展,对线性表位的研究方法逐渐成熟,如合成重叠肽库,这种方法方便、准确,且覆盖了过敏原的全部一级序列。
重叠肽库合成法中使用的肽库主要是指某一长度短肽的大量集合[5],可以含盖过敏原一级结构氨基酸序列中该长度短肽的大部分甚至所有的可能序列[6]。重叠短肽的合成方法通常是有机合成法,即固相合成肽技术[7]。将所有合成的与靶过敏蛋白氨基酸序列相似的短重叠肽段,通过圆点印迹试验或免疫印迹试验检测其与特异性抗体的结合情况,来判断和筛选其线性抗原表位。在这个试验中必须通过过敏患者血清中的抗原特异性IgE抗体与待测蛋白的结合能力来判断其是否与已知食物过敏原具有同源性或交叉反应性,而且需要大量的样本提高试验结果的准确性。因为血清学筛选的关键就是血清中高浓度的抗原特异性IgE抗体,若抗体浓度过低,则无法避免假阴性的结果。FAO/WHO建议,为了避免出现血清中的交叉抗体,检测时不要选用5名患者以上混合的血清池[8]。血清的数量也与试验结果的准确度相关。考虑到现实中获得大量的人体样本比较困难,而构建动物致敏模型获得致敏动物的血清是一个很好的替代方法。目前有关致敏动物模型与过敏人群在抗原结合表位的差异性的研究很少。
本研究通过合成包含核桃中主要过敏原Jug r 1一级结构氨基酸序列的重叠短肽库,利用过敏患者血清和致敏小鼠血清中的特异性IgE抗体对其进行筛选,以确定所识别的线性抗原表位,比较两种方法筛选抗原表位的差异性,为确定利用小鼠血清替代人过敏患者血清筛选抗原表位,研究食物过敏机理、食物过敏的方法诊断等提供理论基础。
1 材料与方法
1.1 主要材料及仪器
主要材料:卵清白蛋白(OVA)、牛血清白蛋白(BSA)、霍乱毒素(CT)及生物素标记的山羊抗人IgE抗体,Sigma公司;生物素标记的大鼠抗小鼠IgE,HRP标记的羊抗小鼠的IgG1及HRP标记的大鼠抗小鼠IgE抗体,Abcam公司;HRP标记链霉亲和素 (Thermo Scientific)、HRP-DAB显色液试剂盒(KPL)、十二烷基磺酸钠(SDS)、Tris-base、丙烯酰胺及甘氨酸,Amresco公司。
主要仪器:Thermo Varloskan Flash多功能酶标 仪 ,Thermo Scientific;GelDoc-ItTM 凝 胶 成 像仪,美国UVP公司;DYY-6C-电泳仪,北京六一仪器厂。
1.2 生物信息学方法分析Jug r 1的线性抗原表位
从 NCBI蛋白数据库(http://www.ncbi.nlm.nih.gov/protein)中获取Jug r 1的氨基酸序列(Accssion:AAB41308,GI:1794252),其一级序列共含有139个氨基酸。应用生物信息学软件DNAstar Protein,选用Hoop-woods的氨基酸亲水性方案、Emin的蛋白表面可及性方案、Kparlus-Schuzl的柔韧性方案以及Jameson-Wolf的抗原指数方案,对Jug r 1一级结构的亲水性、表面可及性、柔韧性以及抗原指数进行分析,4个参数预测结果的重叠部分为蛋白质一级结构中可能的线性抗原表位序列。
1.3 患者血清的获得及血清中特异性IgE的测定
为了检测核桃过敏患者血清中特异性IgE抗体与Jug r 1的结合情况,共招募10名受试者,其中6名为核桃过敏患者,通过病史和临床反应确定其对核桃存在过敏反应。患者具体信息见表1。剩余4名为非过敏受试者,作为对照。采集的血样于37℃孵育1 h,4 000 g离心10 min,取上清,分装编号,置于-80℃保存。

表1 核桃过敏患者基本信息Table1 Information of walnut-allergic patients
参照参考文献[9]免疫印迹方法,将4名非过敏患者的血清混合后作为阴性对照。将SDSPAGE分离出的蛋白样品转移到硝酸纤维素(NC)膜上,在转膜过程中要注意避免将胶刮破,且在切膜和剪切滤纸时均需戴手套,以防止污染膜上蛋白。在转膜前,将NC膜和滤纸在电转缓冲液中浸润。打开电转装置的夹子,使负极面保持水平,用少量电转液润湿,依此放入滤纸、分离胶、NC膜、滤纸,此过程中要不断用电转缓冲液润湿,且每层之间没有气泡,还要保证滤纸与膜、胶对齐,然后将其放入电泳槽,80 V电压电转2 h。由于电转过程会产热,所以需冰浴。
电转后将NC膜用5%牛血清白蛋白(BSA)封闭,室温下摇动封闭1 h。加入一抗(过敏患者血清,1∶10倍稀释),4℃过夜孵育。用TBST洗涤3次,每次5 min。加入二抗(生物素标记的山羊抗人IgE抗体1∶2 000稀释)室温下孵育1h,TBST洗涤3次,再加入1∶500稀释的辣根过氧化物酶标记的链霉亲和素,室温下孵育1 h,TBST洗涤6次。最后加入ECL化学发光剂孵育5 min,将膜转移到干净的保鲜膜上,除去残液,放入X-光片夹中,在X-光片中曝光,根据信号强弱来调整曝光时间,通常是30 s或1 min左右。曝光结束后,取出X胶片,将其浸入显影液中,当出现明显条带后将其转移至定影液中,5~10 min后将胶片取出,用自来水洗去残液,室温下晾干。注意整个显影和定影的过程要在暗室进行。最后利用凝胶图像系统进行拍照,观察显色条带是否是在15 ku处(证明存在核桃中主要过敏原Jug r 1特异性的IgE抗体,且均可与Jug r 1发生特异性结合)。
1.4 致敏小鼠血清的获得及血清中特异性IgE的测定
为了检测致敏小鼠血清中特异性IgE抗体与Jug r 1的结合情况,用3~4周龄的SPF级雌性Balb/c小鼠建立核桃致敏小鼠模型。实验开始前在动物房适应性喂养3~5 d,自由摄食和饮水(饲料中不含有鸡蛋、核桃或坚果成分),室内温度(22±1)℃,相对湿度(55±5)%。将动物按体重随机分为3组:致敏组(Jug r 1+CT佐剂)、阳性对照组(OVA+CT佐剂)和阴性对照组(PBS+CT佐剂)。每组8只小鼠。实验持续6周,每周监测动物的体重及生长情况。采用经口灌胃的方法,在试验第0,7,14,21,28 天分别经口灌胃给予各组小鼠相应的1 mg蛋白溶液 (含有10 μg的CT佐剂),并在第42天进行10倍浓度的大剂量刺激,3 000 g条件下离心并分离血清,分装后保存于-80℃,用ELISA法测定各组动物血液中特异性IgE和IgGl的水平。
将受试蛋白分别用包被缓冲液稀释至10mg/L,在 96孔板上选择需要包被的孔,每孔加入包被液100 μL,4℃过夜。用洗液洗涤3次后,加入封闭液,在37℃下封闭1 h。之后重复洗涤3次。加入1∶5稀释的小鼠血清,在37℃下孵育1 h。重复洗涤3次,每孔加入100 μL 1∶10 000稀释的HRP标记的大鼠抗小鼠IgE抗体(或抗IgG1),在37℃下孵育1 h。重复洗涤6次。每孔加入100 μL TMB显色液,37℃下显色15 min后,每孔加入50 μL硫酸终止液,在波长450 nm处读取OD值,分析得到各组动物血液中特异性IgE和IgGl的含量 (以及症状、体温变化及血浆中组胺的含量),确定成功建立核桃致敏小鼠模型,小鼠血清可用于筛选与其中特异性IgE结合的肽段。
1.5 Jug r 1重叠肽段的合成及IgE线性表位的确定
为了得到Jug r 1的氨基酸一级序列,从SDAP 数据库(http://fermi.utmb.edu/cgi-bin/SDAP/)中获得Jug r 1的蛋白质序列ID。再根据蛋白质序列ID在NCBI蛋白数据库(http://www.ncbi.nlm.nih.gov/protein)中获取Jug r 1的氨基酸序列(Accssion:AAB41308;GI:1794252),其一级序列共含有139个氨基酸。根据Jug r 1的氨基酸一级序列,利用固相合成肽法合成重叠肽段,纯度90%。每个肽段长度为15个氨基酸,偏移量为3个氨基酸,含盖了Jug r 1的全部一级序列。合成后采用高效液相色谱HPLC和质谱进行分析和鉴定,用于后续圆点印迹(Dot-blot)筛选肽段确定IgE线性表位。
为了筛选出与患者血清中特异性IgE结合的肽段,利用Dot-blot试验并参照参考文献[10]的方法。用铅笔在NC膜上轻画1 cm×1 cm格子,之后用双蒸水浸泡NC膜,直至膜全部湿润为止。从双蒸水中取出NC膜,用滤纸吸去残余在膜上的水分,在膜保持湿润状态时点样。每个格子中间点加2 μL蛋白肽段 (质量浓度3 mg/mL),室温下自然晾干。加入封闭液,将NC膜浸没在封闭液中,室温下封闭2 h后洗涤。加入按1∶10稀释6位患者血清的一抗反应液。4℃孵育过夜后洗涤。按1∶8 000稀释的二抗加入NC 膜上,37℃下避光孵育1 h后洗涤。在NC膜上加入按1∶500稀释的HRP标记的链霉亲和素,37℃下避光孵育1 h后洗涤,HRP-DAB显影5~15 min,观察并拍照记录得到的是否出现显色条带,以确定是某个肽段与特异性IgE结合,为表位区域所在。
利用Dot-blot试验筛选与小鼠血清中特异性IgE结合的肽段,方法同上。其中,将NC膜封闭后,加入1∶5稀释的混合的致敏小鼠血清,作为一抗反应液。4℃孵育过夜后洗涤。将1∶10 000稀释HRP标记的大鼠抗小鼠IgE抗体的二抗加入NC膜上,37℃下避光孵育1h后洗涤,HRP-DAB显影5~15 min,观察并拍照记录得到的是否出现显色条带,以确定是某个肽段与特异性IgE结合,为表位区域所在。
2 结果及分析
2.1 生物信息学分析得到6个Jug r 1线性抗原表位
在获得Jug r 1的氨基酸序列的基础上,利用DNAstar Protean软件对其一级结构的亲水性、表面可及性、柔韧性以及抗原指数进行分析,结果见图1。按Kyte-Doolittle的氨基酸亲水性标准分析Jug r 1的亲水性(图1a),亲水性指数>0的说明亲水性较好,结果表明,Jug r 1的亲水性区域分布较不均匀,主要集中在中部和C末端。亲水性较高的区域分别为AA20、AA23-139,亲水性区域暴露于蛋白表面的几率较高,从而形成抗原表位的几率也较大。按Emini法对Jug r 1的表面可及性进行分析(图1b),以表面可及性指数>1作为筛选标准,结果显示Jug r 1的氨基酸表面可及性较大的区域主要为 AA19、AA24~25、AA28~35、AA39、AA42~28、AA52、AA55~73、AA81~86、AA96~111、AA114、AA117~121、AA130、AA135 和 AA137。 这些表面可及性较强区域呈现在Jug r 1蛋白分子的表面,有利于与抗体结合,其成为抗原表位的可能性也较大。按Karplus-Schulz法对Jug r 1的柔性区域进行分析 (如图1c),发现主要集中在AA18~22、AA24~49、AA57~72、AA80~88、AA98~111、AA117~133 和 AA135~136。 这些区域由于具有一定的柔性,发生折叠、弯曲的几率较大,形成表位的可能性较高,易与抗体发生结合。按Jameson-Wolf法分析Jug r 1的潜在抗原表位位点(如图1d),以抗原指数>0为筛选条件,结果显示:抗原指数较高的区域为AA20~21、AA23~53、AA57~58、AA81~89 和 AA91~139,提示这些区域含有潜在优势抗原表位。
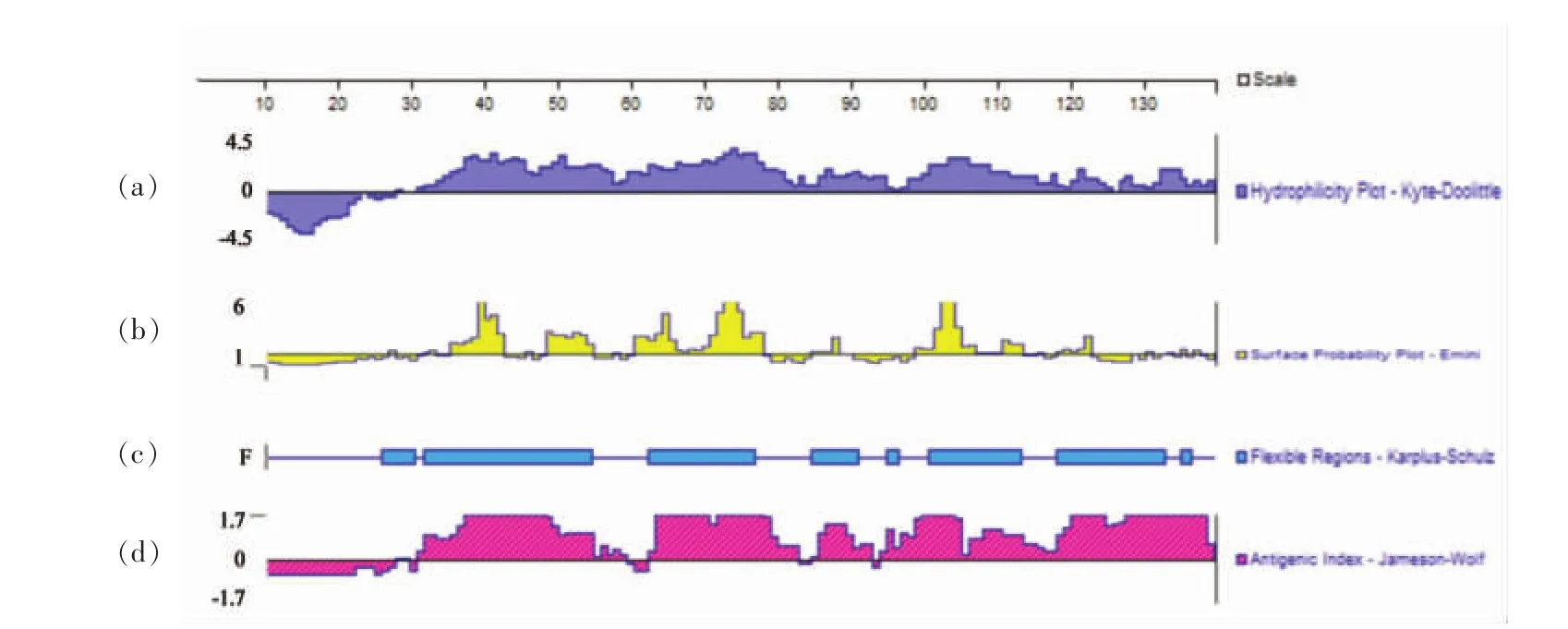
图1 Jug r 1的DNAstar Protean分析结果Fig.1 Result of the DNAstar Protean of Jug r 1
综合以上各参数,将同时满足4个参数筛选条件的表位预测为Jug r 1蛋白的可能表位位点(6个),如表2所示。DNAstar的结果表明:Jug r 1蛋白整体有几个区域具有较高的抗原指数,推测可能存在多个抗原表位,即存在潜在的致敏性。虽然DNAstar软件预测核桃蛋白表位的相对准确性较高,但是DNAstar主要是基于氨基酸一级结构,对表位的预测有一定局限性,还需通过进一步的试验进行验证。

表2 DNAstar Protean预测得到的Jug r 1的线性表位Table2 The predicted linear epitopes on Jug r 1 by DNAstar Protean
2.2 肽段的合成和鉴定
根据Jug r 1的一级氨基酸序列,合成44个15个氨基酸残基长度的肽段,如图2所示。图3中的A、B、C分别代表了1号肽 (氨基酸序列为1AALLVALLFVANAAA15)、6号肽 (氨基酸序列为16FRTTITTMEIDEDID30)和44号肽(氨基酸序列为125CGISSQRCEIRRSWF139)的液相和质谱图,其它合成肽谱图略。以上3个肽段为此次试验筛选出的表位区域。合成肽经高效液相纯化和质谱鉴定,纯度为90%,可用于后续筛选抗原表位。
2.3 核桃过敏患者血清筛选出4个Jug r 1 IgE线性抗原表位
为了确定过敏患者血清中是否存在核桃主要过敏原Jug r 1的特异性IgE抗体,利用Western Blot分析过敏患者血清与Jug r 1的结合情况,在约15ku处可见明显的条带(图4)。结果表明:6名过敏患者血清中均存在核桃中主要过敏原Jug r 1特异性的IgE抗体,且均可与Jug r 1发生特异性结合。这表明此血清对Jug r 1的特异性显著,可用于后续表位的筛选。
进一步利用上述鉴定的过敏患者血清检测Jug r 1特异性抗原表位,将前述合成的44个肽段分别与6位过敏患者血清进行Dot-blot实验,筛选出IgE结合肽段(图5)。

图2 合成的44个重叠肽段(长度为15个氨基酸,偏移量为3个氨基酸)Fig.2 Amino acid sequences of 44 overlapping,synthetic peptides(length:15 amino acid,offset 3 amino acid)

图 3 肽段 1号(a)、6号(b)和 44号(c)的 HPLC和质谱Fig.3 The HPLC profile and mass spectrum of peptides in No.1(a),No.6(b) and No.44(c)

图4 过敏患者血清与Jug r 1的Western Blot结果Fig.4 Result of Western Blot of allergic patients and Jug r 1

图5 6名核桃过敏患者血清与重叠肽段的Dot-blot实验结果Fig.5 Result of the dot-bot of 6 walnut-allergic patients’serums and overlapping peptides
合成的44个肽段中,有4个肽段可与全部过敏患者血清中的特异性IgE发生反应,分别为肽段 1 (AA1-15,AALLVALLFVANAAA)、 肽段 2(AA4~18,LVALLFVANAAAFRT)、肽段 6(AA16~30,FRTTITTMEIDEDID)和肽段 44(AA125~139,CGISSQRCEIRRSWF),均与过敏患者血清发生特异性结合,说明氨基酸序列上存在IgE活性区域。经 确 定 ,肽 段 AA1~15、AA4~18、AA16~30 及AA125~139为过敏患者血清所识别的Jug r 1的IgE线性抗原表位区域。结合2.1节中生物信息学预 测 表位 结 果 AA28~35、AA42~49、AA55~62、AA65~73、AA97~104、AA109~121,有部分氨基酸序列重合。Robotham J M等[11]也利用过敏患者血清筛选出一个免疫显性的抗原表位。而这段氨基酸序列与本研究中的过敏患者血清中的特异性IgE未发生结合,提示受试者的个体差异较大,不同的过敏患者会识别不同的抗原表位[12]。其中,患者A、B、E也与其它肽段有较弱的结合,提示不同的过敏患者血清,不同的表位肽段对过敏原蛋白的结合情况也不相同,表明不同的血清针对同一过敏蛋白的识别表位并不完全相同,这表现出抗原抗体的特异性。结合表1的患者信息,很多患者都同时对花生或榛果存在过敏反应,提示核桃与花生或榛果存在交叉反应,这在先前也有报道[13]。
2.4 核桃过敏原Jug r 1致敏小鼠血清筛选两个Jug r 1 IgE线性抗原表位
通过构建Balb/c小鼠致敏模型,收集42 d大刺激后的小鼠血清,用ELISA法测定Balb/c小鼠血清中特异性IgE和IgG1抗体水平,结果分别见图6a、6b。经口给予OVA和Jug r 1的小鼠血清中的特异性IgE和IgG1抗体水平均显著性高于阴性对照PBS组(P<0.05),说明经口给予Jug r 1蛋白可以诱发Balb/c小鼠产生Th2型抗体反应,小鼠血清中存在与Jug r 1结合的特异性IgE抗体,即此血清对Jug r 1的特异性显著,可用于后续表位的筛选。
进一步利用上述经鉴定的致敏小鼠血清,采用Dot-blot法筛选出致敏小鼠的血清中Jug r 1特异性IgE识别的抗原表位,如图7所示。结果表明,小鼠可以识别出肽段1(1AALLVALLFVANAAA15)和肽段 44(125CGISSQRCEIRRSWF139),即肽段AA1-15及AA125-139为小鼠血清所识别的Jug r 1的IgE线性抗原表位区域。与2.3节中核桃过敏患者血清所识别的Jug r 1的IgE线性抗原表位区域肽段 AA1~15、AA4~18、AA16~30及AA125~139进行比较,发现致敏小鼠血清筛选出的两个IgE线性抗原表位存在于过敏患者血清筛选出的4个IgE抗原表位中,提示可以利用小鼠血清替代人血清进行过敏原IgE线性抗原表位的筛选实验,然而也会出现假阴性结果,即部分IgE线性抗原表位没能被识别。结合2.1节中生物信息学预测表位结果AA28~35、AA42~49、AA55~62、AA65~73、AA97~104、AA109~121 没有重合部分,提示要想准确的预测出构象表位和线性表位,需要综合应用不同软件对肽段表位进行多角度、更全面的预测分析,其结果的准确性一定会有所提高[14]。

图6 Balb/c小鼠血清中特异性IgE和IgG1抗体水平Fig.6 The level of specific IgE and IgG1response in Balb/c mice

图7 核桃过敏小鼠血清与重叠肽段的Dot-blot实验结果Fig.7 Result of the dot-bot of walnut-allergic mice’serums and overlapping peptides
3 讨论
目前在利用血清筛选食物过敏原表位的研究时,大多数仍然是采用相应的食物过敏患者的血清,如Robotham J M等[15]在2002年对Jug r 1引起过敏症状的病人血清的IgE表位通过固相肽段合成并结合血清学筛选的方法鉴定,获得一个免疫显性的线性抗原表位,104QGLRGEEMEEMV115;Sordet C等[11]利用重叠肽库筛选的方法鉴定出Jug r 1的4个能与人血清抗体结合的位点,分别是6IDNPRR11,42YDEDNQRQH50,72QVVRRQQQQ80及102CGISSQRCEIRR113。然而,人体血清库的资源相对匮乏,且涉及到道德伦理问题,其发展和利用受到限制。虽然血清学结果准确、直观,但是对血清质量和数量要求较高,招募到较大量的受试者有一定的难度。若能采用动物模型来模拟代替人类进行实验研究则更为便利、可行,这也是本研究的目的所在。特别是在食物过敏原致敏性方面,很多大鼠小鼠致敏模型的成功建立,对研究食物过敏机制有很大的帮助。
有研究[16]利用小鼠血清和HMPV IgG阳性人血清,利用55条合成肽,通过肽扫描分析技术,对HMPV F蛋白的B细胞表位进行初步筛选,结果显示,33条多肽可与人血清反应,12条多肽可与小鼠抗RSV F蛋白血清反应,其中10条与人血清筛选结果重叠,说明二者存在交叉性表位,与本研究结果相似,提示可利用小鼠血清替代人血清进行实验。S Denerypapini[17]在研究小麦过敏原LPT1的几个连续表位时,发现其中一个表位是患者和小鼠共同识别的,未折叠的蛋白既不能被患者识别也不能被小鼠IgE识别,然而Battais等[18]在研究小麦蛋白抗原表位时,利用小鼠和人血清筛选出的表位,肽段序列的交叉很低,难以重合,推测可能是在前一项研究中LTP1本身的特性所致,在IgE结合中LTP1折叠和不连续表位造成的差异,相比之下,许多连续表位可被患者和小鼠IgE所识别,这种麦醇溶蛋白或LTP1致敏的小鼠中的反应以及与筛选出的IgE表位方面与患者的反应相似,这也进一步支持作者在筛选食物过敏原表位时小鼠模型替代的可行性。因种属之间的差异或者过敏原本身的特性而导致不同研究结果之间的差异性,还需要更多的研究数据进行验证。目前关于致敏动物模型与过敏人群在抗原结合表位差异性的研究报道很少。在筛选抗原表位方面,小鼠与人之间的差异性还需更深入的研究。
总之,本研究利用固相合成肽法合成了44个覆盖Jug r 1一级序列的重叠短肽,通过核桃过敏患者血清和致敏小鼠血清筛选出其IgE线性抗原表位。结果发现,过敏患者可以识别的IgE结合的抗原表位肽段为1LVALLFVANAAA15、4LVALLFVANAAAFRT18、16FRTTITTMEIDEDID30及125CGISSQRCEIRRSWF139;小鼠识别其中两个的抗原表位为1AALLVALLFVANAAA15和125CGISSQRCEIRRSWF139,提示在利用致敏动物血清替代人血清进行IgE线性抗原表位筛选时,所筛选出的IgE线性抗原表位也能够被核桃过敏患者识别,然而也有一部分IgE表位不能被识别,需要结合其它方法进一步筛选和验证。

