血液分离肠球菌毒力基因及生物膜形成相关性分析
牛冬梅,徐红静,周万青,章金春
(1.南京中医药大学第三附属医院 南京市中医院检验科,江苏 南京210001;2.南京大学医学院附属鼓楼医院微生物室,江苏 南京210008)
肠球菌属(Enterococcus)是院内感染的重要致病菌,可引起尿路感染、皮肤软组织感染、腹腔感染、心内膜炎和脑膜炎等,已成为致血流感染第二位的革兰阳性球菌[1]。肠球菌感染的致病机制复杂,其中毒力基因是主要的原因之一[2]。肠球菌毒力基因及其蛋白物质主要有聚集物质、表面蛋白、透明质酸酶、细胞溶解素、明胶酶、胶原黏附蛋白等,均在其致病中起着重要作用[3]。而细菌生物膜的形成可以阻碍或延迟细菌与抗生素接触,降低肠球菌对药物的敏感性,致使感染难以治愈[4]。对于血流感染肠球菌毒力基因及其与生物膜形成的相关研究较少[5]。本文通过对血流感染肠球菌毒力基因分布、生物膜形成能力进行检测,为了解毒力基因及生物膜形成在肠球菌致病机制作用研究提供依据。
材料和方法
1 菌株来源
收集南京大学医学院附属鼓楼医院2014年至2017年临床血培养分离非重复肠球菌86株,为使用Vitek 2 Compact全自动微生物分析仪鉴定到的菌种。包括42株粪肠球菌和44株屎肠球菌。质控菌株为粪肠球菌(ATCC 29212)和金黄色葡萄球菌(ATCC 25923)均为南京大学医学院附属鼓楼医院微生物室保存的菌株。
2 仪器和试剂
Vitek 2 Compact及配套GP鉴定卡、GP67药敏卡(法国梅里埃公司);2×Taq Mix(DBI公司);PCR引物由上海生工公司合成;PCR扩增仪(PE公司);琼脂糖干粉(法国Biowest公司);100 bp DNA Marker(大连Takara公司);胰蛋白胨大豆肉汤、胰蛋白胨大豆琼脂(青岛海博生物技术公司);96孔聚苯乙烯灭菌微孔板(美国Corning公司);10 g/L结晶紫染液(北京索莱宝科技公司);电泳仪及GelDoc XR型凝胶成像分析系统(美国Bio-Rad公司);Spectra Max M5酶标仪(美国美谷公司)。
3 药敏试验
采用纸片扩散法检测菌株对常规药物的敏感性,判定标准参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)2017版的标准[6]。
4 PCR扩增毒力基因
采用加热煮沸法提取细菌DNA[7],挑取纯培养菌落于内含200 ng/mL蛋白酶K 200μL溶液的1.5mL离心管内,56℃ 水浴2h,后置95℃水浴10min,13000×g离心30s,上清液即为基因检测模板。采用PCR扩增6种肠球菌毒力基因cyl、esp、asal、hyl、gelE和agg,参照文献[4-5]合成引物,引物序列见表1。其中cyl、esp、asal、hyl和gelE的反应体系为50μL,包括2×Taq Mix 25μL,DNA模板2μL,cyl、esp、asal、hyl和gelE的上、下游引物(10μmol/L)各1μL,dd H2O 13μL。PCR反应条件:94℃5 min;94℃1 min,56℃1 min,72℃1 min,30个循环;72℃7 min。agg的反应体系为20μL,包括2×Taq Mi×10μL,DNA模板2μL,上、下游引物(10μmol/L)各1μL,dd H2O 6μL。PCR反应条件:94℃5 min;94℃30 s;56℃30 s;72℃1min,30个循环;72℃7 min。PCR产物经12 g/L琼脂糖凝胶电泳,溴化乙锭染色后观察结果。

表1 本文所用的引物序列
5 肠球菌生物膜形成试验
生物膜的体外形成试验参照文献[5]进行。将胰蛋白胨大豆肉汤(TSB)平板上生长过夜的肠球菌用生理盐水调成3麦氏单位,取10μL菌液加入1mL的TSB肉汤(1∶100稀释)。取上述稀释后肉汤200μL加入96孔无菌微孔板中,每株菌3个复孔,以无菌的TSB肉汤作为阴性对照。将微孔板于37℃静置孵育24h后取出并弃菌液,用生理盐水冲洗3次,晾干加入100μL 0.5%结晶紫。15min后,用生理盐水洗至无色。晾干后加入200μL无水乙醇,静置20min,读取570nm处的吸光度值(A)。以大于阴性对照A值均数+3s者判定为生物膜形成阳性。以粪肠球菌ATCC 29212作为质控菌株。
6 统计学处理
采用SPSS17.0进行数据分析,率的比较采用卡方检验,以P<0.05为差异有统计学意义。
结 果
1 肠球菌药敏结果
42株粪肠球菌和44株屎肠球菌对不同抗菌药物显示出不同的耐药率,见表2。屎肠球菌对于青霉素、氨苄西林、左旋氧氟沙星耐药率高于粪肠球菌,差异有统计学意义(P<0.05);二者对于万古霉素、利奈唑胺及高浓度庆大霉素耐药率差异无统计学意义(P>0.05),检出万古霉素和利奈唑胺耐药菌株分别为4株和1株。

表2 粪肠球菌和屎肠球菌耐药率比较
2 肠球菌毒力基因检测结果
86株肠球菌中cylA、esp、asal、hyl、gelE和agg毒力基因的分布见表3,部分菌株的毒力基因电泳结果见图1。粪肠球菌携带的毒力基因以gelE、asal、cylA、esp和agg为主,未检出hyl基因;其中仅携带gelE基因10株,同时携带cyl、esp、asal、gelE和agg基因8株,同时携带cyl、esp和asal基因5株,同时携带asal和gelE基因4株,同时携带cyl、esp、asal和gelE基因3株,仅携带asal基因3株,同时携带asal、gelE和agg基因2株,同时携带esp和gelE基因2株,同时携带cyl、asal和gelE基因2株,同时携带asa和agg基因1株,未检出基因2株。屎肠球菌中仅检出esp和hyl,未检出其他4种毒力基因。其携带基因的组合方式分别为仅检出esp基因16株、仅检出hyl基因7株、同时检出esp和hyl基因9株和未检出上述6种基因12株。粪肠球菌中gelE、asal、cylA和agg毒力基因的携带率均高于屎肠球菌,屎肠球菌中hyl基因检出率高于粪肠球菌,差异有统计学意义(P<0.05)。
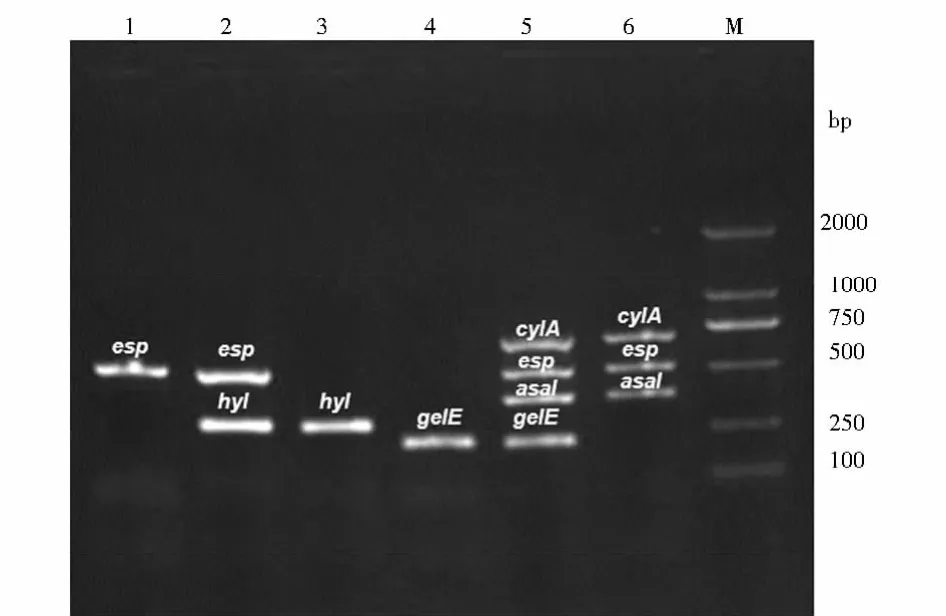
图1 部分菌株毒力基因检测电泳结果
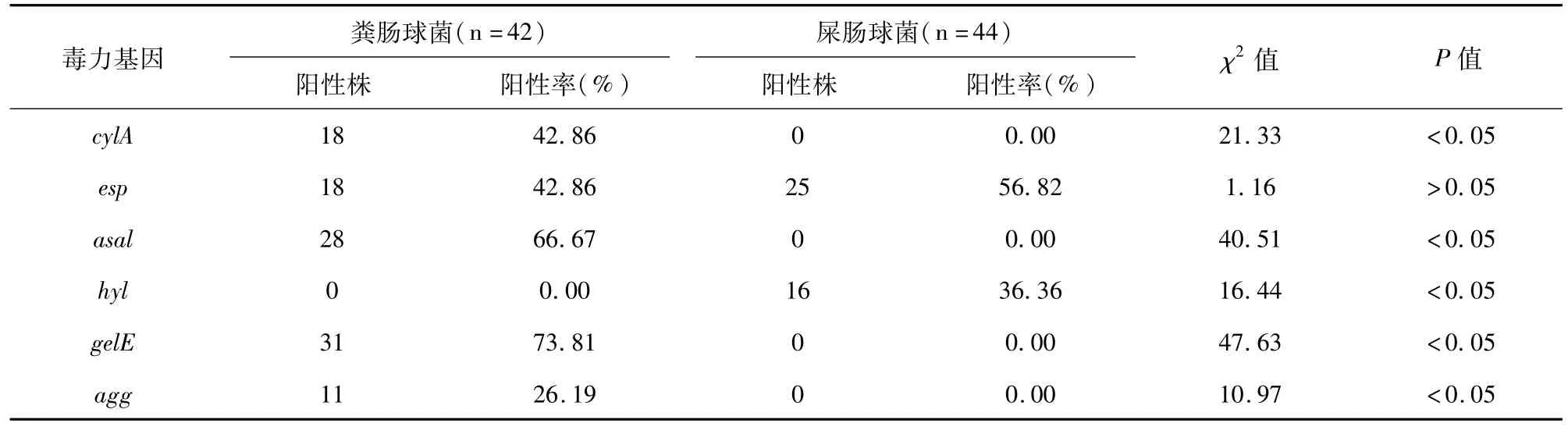
表3 粪肠球菌和屎肠球菌毒力基因携带情况
3 生物膜形成能力分析
血液分离肠球菌生物膜阳性率为32.6%(28/86)。其中42株粪肠球菌中25株能形成生物膜(59.5%),而44株屎肠球菌中有3株能形成生物膜(6.8%)。粪肠球菌的生物膜形成能力高于屎肠球菌(P<0.05)。
4 肠球菌毒力基因与生物膜形成能力的相关性
42株粪肠球菌和44株屎肠球菌各毒力基因的携带情况与生物膜形成能力间均无统计学意义(P>0.05)。见表4。
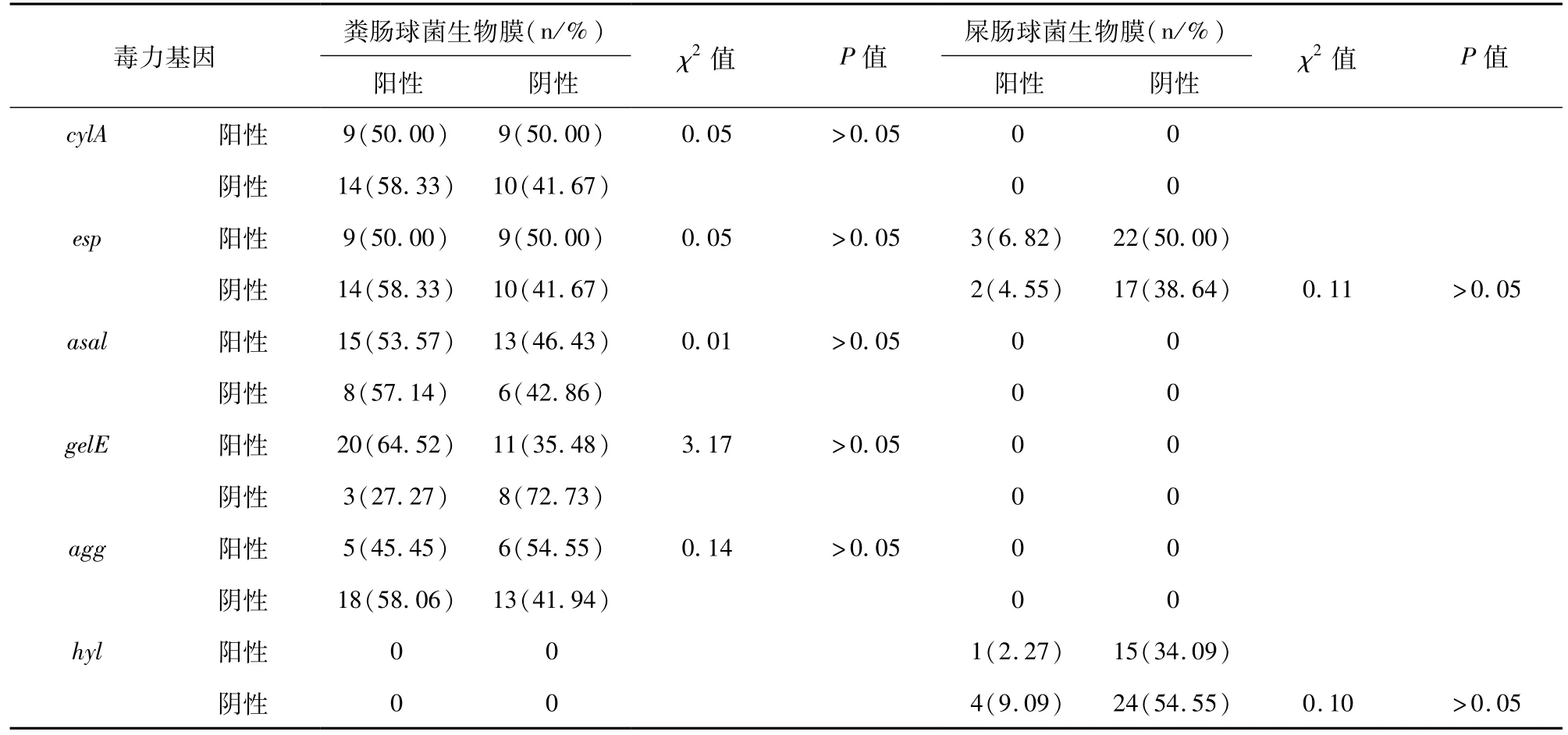
表4 粪肠球菌携带毒力基因与形成生物膜的相关性
讨 论
本文对血流感染肠球菌耐药性分析发现,血液分离屎肠球菌耐药率明显高于粪肠球菌,与全国耐药监测结果具有一致性[1]。86株血培养肠球菌中检出万古霉素耐药菌株4株(1.16%),检出利奈唑胺耐药粪肠球菌1株。万古霉素或利奈唑胺耐药菌株的检出将对临床有效的抗菌药物选择造成极大的挑战。临床对于上述药物的规范使用则是延缓耐药产生的有效措施。
肠球菌毒力基因及其蛋白物质主要有聚集物质(asal基因编码一种肠球菌表面结合糖蛋白,能使细菌聚集,增加在宿主细胞的附着能力)、表面蛋白(esp基因编码肠球菌表面蛋白,是肠球菌表面分子量最大的蛋白质,对感染初期肠球菌的定植和生物膜的形成起重要作用)、透明质酸酶(hyl基因编码透明质酸酶,协助细菌在组织内扩散)、细胞溶解素(cylA基因与编码溶细胞素相关,可溶解细胞,加重肠球菌感染的严重程度)、明胶酶(gelE基因编码明胶酶,溶解宿主细胞的胶原蛋白或组织蛋白,使宿主细胞丧失完整性,有利于肠球菌及其致病物质向组织周围扩散)、胶原黏附蛋白(agg基因)等,均在其致病中起着重要作用[5]。本文结果显示,血液分离粪肠球菌携带的毒力基因以gelE、asal、cylA、esp和agg为主,未检出hyl基因;屎肠球菌中仅检出esp和hyl,未检出其他4种毒力基因。粪肠球菌中gelE、asal、cylA和agg毒力基因的携带率均高于屎肠球菌,而屎肠球菌中hyl基因检出率高于粪肠球菌,差异有统计学意义(P<0.05)。文献[5]报道,cylA、asal、gelE为粪肠球菌所特有,hyl为屎肠球菌特有。本文结果与文献[5,8]报道具有一致性。肠球菌感染的致病机制复杂,单一毒力基因并不能决定其致病性,而是有许多因子参与其致病过程[9]。本文发现血流感染肠球菌携带的毒力基因的组合方式有多种。
细菌生物膜在慢性和迁延感染中起着重要的作用。本文发现血流感染肠球菌生物膜形成率为32.6%(28/86),低于文献[8]报道。其中粪肠球菌形成生物膜的能力(59.5%)显著高于屎肠球菌(6.8%),这与其他研究结果相一致[9],但仍低于张肖肖等[8]的研究结果。本文选取的血液分离肠球菌中,毒力基因阳性菌株和阴性菌株均可以形成生物膜,表明肠球菌普遍具有生物膜形成能力[8]。研究报道毒力基因esp、gelE及agg的表达与粪肠球菌生物膜形成密切相关,而esp基因的携带与屎肠球菌生物膜形成密切相关[8,10]。亦有研究发现esp基因的表达与生物膜形成能力间无相关性[11]。本研究发现上述毒力基因菌株的生物膜形成能力无相关性,这一差异可能与选取的菌株数量及来源有关,本文选取菌株为血液分离肠球菌。还有待于进一步的验证。

