小檗碱对A549 细胞增殖、迁移和侵袭的影响
邱胜卫, 王 彬, 蔡乃亮
(1.海南省三亚市人民医院中医科,海南 三亚572000;2.海南省三亚市人民医院呼吸内科,海南 三亚572000)
肿瘤微环境是指肿瘤发生、发展、转移等过程中肿瘤细胞所处的内外环境,主要包括肿瘤细胞、肿瘤局部浸润的免疫细胞、活性介质、间质细胞共同构成的局部内环境[1],其中作为局部浸润的免疫细胞中最主要的免疫细胞——肿瘤相关巨噬细胞参与肿瘤转移和侵袭、免疫调节、血管和淋巴管形成,在肿瘤发生发展过程中起着至关重要的作用[2-3]。在胃癌组织中发现大量肿瘤相关巨噬细胞浸润,而且胃癌大小、淋巴结转移、TNM 分期与其有关[4];临床数据显示,其大量浸润是造成乳腺癌预后不良的主要原因[5],可通过分泌多种细胞因子及趋化因子来降低放疗、化疗的敏感性,促进乳腺癌侵袭、浸润和转移,还可促进相关血管生成[6],目前已将其作为多种肿瘤治疗靶点及潜在预后指标。
小檗碱也称为黄连素,是从黄连中分离得到的主要有效成分,用于治疗肠道细菌感染引起的腹泻[7],它除了具有抗炎、抗微生物等作用外,还可用于抗肿瘤,其机制大多为抑制肿瘤细胞增殖和转移、造成肿瘤细胞代谢功能紊乱、诱导肿瘤细胞凋亡等[8-9],在多种肿瘤中影响相关巨噬细胞极化[10-12],但其是否通过免疫调节肿瘤相关巨噬细胞来最终发挥抑制肿瘤发生发展目前尚无报道。研究证实,肿瘤相关巨噬细胞和肿瘤微环境与肺癌发生、发展、转移等多种生物学特性密切相关[13],故本实验通过THP-1 细胞诱导M2 型肿瘤相关巨噬细胞,研究小檗碱对与其共培养肺癌A549 细胞增殖、迁移和侵袭的影响,以期为该成分在肺癌临床治疗中提供实验依据。
1 材料
小檗碱(批号110715-200911) 购于中国食品药品检定研究院,含有量99%。人肺癌A549 细胞株、人急性单核细胞白血病细胞THP-1 均购于中国科学院上海生命科学院细胞库。二甲基亚砜(批号S16065)、Matrigel 胶购于美国Sigma 公司;RPMI 1640 培养基(批号20150714)、胰蛋白酶(批号25200-78)、胎牛血清(批号20150618) 购于美国Gibco 公司;青霉素、链霉素购于赛默飞世尔生物化学制品有限公司; Trizol 试剂 (批号16827454) 购于美国Invitrogen 公司;MTT 检测试剂盒(批号140705) 购于碧云天生物技术有限公司;ELISA 检测试剂盒(批号D710323-0048)、实验所用引物均购于或合成于上海生工生物工程有限公司; BCA 蛋白定量试剂盒 (批号D9109B)、ECL 发光检测试剂盒(批号IH0028) 购于大连宝生物工程有限公司; 逆转录试剂盒 (批号RR048A)、RT-PCR 试剂盒(批号RR421A) 购于日本TaKaRa 公司;IL-10 抗体、TGF-β 抗体及辣根过氧化物酶标记的二抗均购于美国Novus Biologicals 公司; Transwell 小室 (孔径8.0 μm, 直径6.5 mm) 购于美国Corning 公司。
2 方法
2.1 细胞增殖检测 采用MTT 法。将处于对数生长期的THP-1 细胞以5×103/孔密度接种于96 孔细胞培养板中,置于37 ℃培养箱中培养12 h,分别用0、5、10、20、50 μmol/L 小檗碱处理,每组设置3 个平行复孔,分别处理24、48、72 h 后,每孔细胞中添加5 mg/mL MTT 溶液20 μL, 置于37 ℃培养箱中继续孵育4 h,弃去上清液,再向每孔细胞中添加100 μL 二甲基亚砜,避光充分振荡混匀,待沉淀完全溶解后, 酶联免疫检测仪于490 nm波长处检测光密度值(OD 值),计算细胞增殖率,公式为增殖率= (实验组OD 值/对照组OD 值) ×100%。
2.2 细胞诱导和分组 参照文献[14],将处于对数生长期的THP-1 细胞以3×105/孔密度接种于6 孔板中,将细胞分为3 组:对照组细胞直接加入终浓度100 nmol/L 的PMA 处理72 h,THP-1 细胞转化为巨噬细胞; 模型组细胞在加入终浓度100 nmol/L PMA 处 理 6 h 后, 加 入 终 浓 度20 ng/mL IL-4 继续诱导66 h,此时THP1 细胞转化为2 型巨噬细胞; 小檗碱组先加入终浓度20 μmol/L小檗碱预处理1 h 后,再加入终浓度100 nmol/L PMA 处理6 h, 最后加入终浓度20 ng/mL IL-4 诱导66 h。各组细胞经PBS 洗涤后,不同激活状态的巨噬细胞更换1 mL 无血清RPMI 1640 培养基培养24 h 后,收集上清液和细胞。
2.3 CD206、IL-10、TGF-β 表达检测 采用RTPCR 法。各组细胞以Trizol 法提取总RNA,紫外分光光度计检测浓度和纯度后,选取两者都达到要求的RNA,采用逆转录试剂盒合成cDNA,将其质量浓度调整为50 ng/μL,RT-PCR 试剂盒进行检测,实时荧光定量PCR 仪检测目标基因。反应条件为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min,40 个循环,最后72 ℃终延伸10 min。以β-actin 为内标,以相对定量2-△△Ct检测细胞中CD206、IL-10、TGF-β 表达。
2.4 IL-10、TGF-β 表达检测 采用Western blot法。各组细胞中加入蛋白裂解液, 置冰上裂解30 min后提取蛋白,BCA 试剂盒测定蛋白浓度,取120 μg,10%聚丙烯酰胺凝胶电泳分离蛋白,半干法转移凝胶上的蛋白至PVDF 膜上,于5%小牛血清封闭液中封闭4 h,分别加入IL-10 一抗(1 ∶1 000倍稀释)、TGF-β(1 ∶1 000 倍稀释) 进行杂交,摇床上4 ℃孵育过夜,TBS 洗膜后,加入二抗(1 ∶1 500 倍稀释) 进行杂交,室温孵育2 h。TBS洗涤后,ECL 化学发光试剂盒进行发光,暗室中曝光拍照,Image J 图像分析系统分析各条带灰度值,以β-actin 为内标蛋白,以相对灰度值表示IL-10、TGF-β 蛋白相对表达。
2.5 IL-10 水平检测 采用ELISA 法。将各组细胞培养上清按照相应ELISA 检测试剂盒说明书进行操作,分别为一抗工作液进行孵育,洗去未结合成分;二抗工作液进行孵育,洗去未结合成分;发光工作液进行孵育,待孵育完成后需立即终止反应,酶标仪上检测各孔OD 值,参照标准曲线检测IL-10 水平。
2.6 共培养对A549 细胞增殖的影响 采用MTT法。将单核细胞THP1 诱导为肿瘤相关巨噬细胞后,收集各组不同激活状态的巨噬细胞上清液,将其与A549 细胞共培养24、48、72 h 后,检测对A549 细胞增殖的影响,方法同“2.1” 项。
2.7 细胞侵袭和迁移能力检测 采用Transwell 实验。Matrigel 胶以无血清培养基稀释后,加到Transwell 小室的上室中, 置于37 ℃培养箱中静置30 min,制备Matrigel 基质胶涂层。将各组细胞用0.25%胰蛋白酶消化,PBS 洗涤后用无血清培养基重悬细胞制成单细胞悬液,将细胞密度调整为2×105/mL,Transwell 上室加入200 μL 细胞悬液,下室加入各组不同激活状态的巨噬细胞上清液500 μL,37 ℃培养箱中培养24 h,取出Transwell小室,拭去上室细胞及碎片,结晶紫染色,PBS 清洗在倒置显微镜下观察小室滤膜下室附着的细胞,随机选取5 个视野,计数穿过膜的细胞数,统计细胞侵袭能力。 同法检测各组细胞迁移能力,Transwell 上室滤膜不经Matrigel 基质胶涂覆,其余步骤同Transwell 侵袭实验。
2.8 统计学分析 通过SPSS 21.0 软件进行处理,数据以表示,组内比较采用单因素方差分析,组间比较采用SNK-q 检验,每组数据代表3 个生物学重复。P<0.05 表示差异有统计学意义。
3 结果
3.1 小檗碱对THP-1 细胞增殖的影响 图1 显示,处理48 h 后0、5、10 μmol/L 小檗碱对THP-1细胞增殖无显著影响(P>0.05);浓度从20 μmol/L开始增加时,细胞增殖率逐渐降低,并随着作用时间延长呈反比,与对照组比较差异具有统计学意义(P<0.05);浓度为50 μmol/L 时,处理THP-1 细胞24、48、72 h 后细胞增殖率均显著下降(P <0.05),表明有一定毒副作用,故选择20 μmol/进行后续实验。

图1 小檗碱对THP-1 细胞增殖的影响Fig.1 Effect of berberine on THP-1 cell proliferation
3.2 小檗碱对THP-1 细胞转化为M2 型肿瘤相关巨噬细胞的影响 图2 显示,与对照组比较,模型组CD206、 IL-10、 TGF-β 表 达 显 著 升 高 (P <0.05),表明肿瘤相关巨噬细胞诱导成功,而且诱导后的细胞表型为M2 型;与模型组比较,小檗碱组三者表达显著降低(P<0.05)。
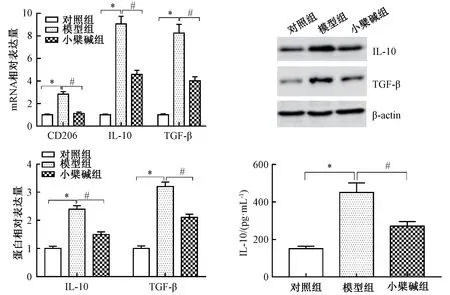
图2 小檗碱对THP-1 细胞转化为M2 型肿瘤相关巨噬细胞的影响Fig.2 Effect of berberine on the conversion of THP-1 cells into M2 tumor-associated macrophages
3.3 小檗碱对A549 细胞增殖的影响 图3 显示,模型组上清培养液共培养的A549 细胞在24、48、72 h 的OD 值均显著高于对照组(P<0.05),而小檗碱组均显著低于模型组(P<0.05)。

图3 小檗碱对A549 细胞增殖的影响Fig.3 Effect of berberine on A549 cell proliferation
3.4 小檗碱对A549 细胞迁移的影响 图4 显示,模型组上清培养液共培养的A549 细胞迁移能力显著高于对照组(P<0.05),而小檗碱组显著低于模型组(P<0.05)。
3.5 小檗碱对A549 细胞侵袭的影响 图5 显示,模型组上清培养液共培养的A549 细胞侵袭能力显著高于对照组(P<0.05),而小檗碱组显著低于模型组(P<0.05)。
4 讨论
肺癌是一种常见的肺部恶性肿瘤,其发病率和死亡率正逐年上升,给人类健康和生命造成严重影响,其发病原因目前尚不十分明确,但其增殖、侵袭和转移恶性生物学特性是导致患者死亡的主要原因,也是治疗难点[15]。研究表明,肿瘤微环境与肿瘤细胞能在特定器官发生和转移紧密相关[16],它是由大量不同类型细胞构成的局部病理环境,免疫细胞是主要组成,参与抗肿瘤免疫反应的激活,发挥清除肿瘤细胞作用,还可被肿瘤细胞募集,促进免疫细胞的长,在肿瘤行为学特性中发挥举足轻重的作用[17]。
肿瘤相关巨噬细胞是免疫细胞的成员之一,组织类型、肿瘤类型、肿瘤分期等多项因素影响其异质性,它具有的表型及功能与浸润到肿瘤组织的部位相关,在肿瘤发展不同阶段其表型也不同,慢性炎症阶段大多呈M1 型,浸润及血管生成阶段则大多呈M2 型[18]。其中,M1 型可分泌一些促炎细胞因子、趋化因子;M2 型可分泌多种抗炎分子,如CD206、IL-10、TGF-β 等[19-20]。本实验发现,由单核细胞THP1 诱导成的肿瘤巨噬细胞CD206、IL-10、TGF-β 表达均上调,表明它们具有M2 分子表型,故将其用于后续实验。

图4 小檗碱对A549 细胞迁移的影响Fig.4 Effect of berberine on A549 cell migration

图5 小檗碱对A549 细胞侵袭的影响Fig.5 Effect of berberine on A549 cell invasion
小檗碱具有抗炎、抗氧化、抗肿瘤等多种药理活性,但其作用机制目前尚不清楚。体内实验中,小鼠灌胃小檗碱后细菌感染存活率明显升高;体外实验中,小檗碱处理小鼠巨噬细胞后可增强炎症小体活化,促进成熟IL-1β 释放及细胞凋亡,表明该成分可通过增强巨噬细胞抗菌功能来达到抗菌消炎作用;在小鼠皮下移植结肠癌CT26 细胞后用小檗碱治疗移植瘤,发现其生长明显受到抑制,而且CD206、CD68 阳性细胞数显著增多,表明该成分是通过调节肿瘤相关巨噬细胞形成来抑制肿瘤生长[21];本实验发现,与模型组相比小檗碱组M2型巨噬细胞标志物CD206、IL-10、TGF-β 表达明显降低,表明该成分可抑制巨噬细胞向M2 型转化。另外,小檗碱可抑制脂多糖、白细胞介素-4诱导小鼠巨噬细胞RAW264.7 细胞向M2 型极化,在维持M1/M2 动态平衡中发挥作用[22],与本实验结果一致;可抑制家族性腺瘤性息肉病(FAP) 动物模型Apc(Min/+) 小鼠肠道息肉的生长,其作用机制与其诱导息肉组织中的肿瘤相关巨噬细胞分化,抑制环氧合酶-2 表达有关[23];可抑制LPS 诱导巨噬细胞相关炎症因子的释放, 抑制JNK、IKKβ 信号通路激活,介导脂肪细胞的糖代谢功能恢复[24];可抑制子宫内膜癌细胞转移,抑制细胞分泌IL-8 及与肿瘤巨噬细胞共培养的子宫内膜癌细胞增殖[11];本实验通过不同激活状态的肿瘤相关巨噬细胞培养上清与肺癌A549 细胞共培养,发现小檗碱可抑制A549 细胞增殖、迁移和侵袭,与以上研究一致。
综上所述,小檗碱可通过作用于肿瘤相关巨噬细胞来抑制肺癌A549 细胞的增殖、侵袭和迁移,可能与其调控肿瘤巨噬细胞表型有关,但它在体内是否发挥同样作用仍需进一步证实。本实验可为肺癌治疗提供理论依据,也为抗肿瘤机制研究提供新方向。

