合成微生物群落共培养研究概况
张 鑫,梁建东*,田维毅,梁宗琦
1贵州中医药大学基础医学院;2贵州大学真菌资源研究所,贵阳 550025
微生物是新型天然产物的重要来源,在药物发现等领域具有不可替代的应用[1]。如今,随着宏基因组学技术的发展,赋予了挖掘微生物天然产物的新内涵。基因组测序显示,微生物基因组,尤其是真菌基因组,包含大量的基因簇,具有比预期更加丰富的天然产物,它们可能产生结构更多样化的次生代谢物,但是在传统的培养条件下,许多微生物基因簇保持沉默。近年已发展了一些激活这些神秘基因的手段,其中,基于微生物组学原理及方法的合成微生物群落共培养研究正在兴起[2]。笔者从合成微生物群落共培养的价值与构建方法、共培养产物的检测和微生物群落的共培养应用等方面对国内外有关合成微生物群落共培养的研究进行概述,旨在为合成微生物群落共培养的进一步深入研究及开发应用提供参考。
1 合成微生物群落的共培养体系
合成微生物群落是在成分明确的基质条件下,人工创建的两个或多个物种共培养的微生物群体系[3]。合成微生物群落通过微生物之间的相互作用实现特定功能,其中的微生物能够通过相互交流和分工行使不同的复杂功能,具有复杂度低、可控性高、稳定性好等优点。合成微生物群落中存在多种相互作用,这些相互作用可以通过改变细胞间交流、物种代谢作用以及空间结构等方式进行调控,从而实现对合成群落的改造[4]。在自然界和人类社会中,微生物群落在生物地球化学循环[5],食物生产[6],工业过程[7]以及人类健康和疾病[8]中皆发挥着重要作用。然而,传统的微生物研究方法(如纯分离和纯培养等方法)一定程度上却又制约着微生物的研究和应用。实则,微生物在自然界中,经常以防御或营养竞争状态生活在群落中,它们的相互作用产生多种次级代谢物。如,在细菌或真菌的生长环境中(土壤,根际,植物,粘膜和肠等),微生物持续地相互作用,会导致复杂调节机制的激活,进而促使高度多样化的天然产物的生物合成,例如信息素,防御分子和参与共生关联的代谢物。此外,应激诱导分子(诱导子)表现出特异性的抗微生物,抗癌,和植物毒性活性[9]。为了发现新药物,人们可借助这些相互作用,在化学生态学研究的框架内,模仿自然存在的群落,构建(合成)一个人工群落,如,专门用于研究群落成员间对抗区天然产物诱导(主要发现新的活性化合物)的合成群落[10]。为进一步拓宽待研究物种和代谢产物的多样性,研究者们基于微生物群落中菌株间发生的化学——生态互作关系,开发了新的培养微生物的方法——共培养法[11,12],该方法自兴起以来,受到越来越多的重视。
1.1 合成微生物群落共培养价值和策略
共培养(co-culture)是在一个培养容器中一起培养两种或多种微生物的方法[13]。共培养可以在液体或固体培养基中进行。当使用液体培养时,该方法也称为 “混合发酵”(mixed-fermentation)。
通常,共培养的策略是通过模拟自然生态,来构建人工的微生物群落[14]。在模拟自然微生物环境条件下,共培养可导致现有天然产物积累的增加[15],或由于微生物串扰和化学防御而触发沉默生物合成途径的表达,产生新的化合物[4]。实现这些目标与微生物及其产生的酶和其他物质密切相关。酶抑制可以引起天然产物生物合成的诱导和抑制。向培养基中添加酶抑制剂可以阻断某些生物合成途径,从而将次级代谢物生物合成转变为从沉默或表达不良的基因簇产生其他天然产物[16]。在某些情况下,沉默通路的激活需要第二种微生物的存在,单独的代谢物不总是足以诱导刺激代谢产物的产生,微生物间的相互作用是产生次级代谢产物的必然驱动力,可能与空间/营养的竞争、寄生和拮抗等不同机制以及诱导植物防御反应有关[4]。共培养对于特定基因的激活取决于相互作用类型,可能会诱导由各种不相关途径产生的代谢物。微生物共培养可以激活沉默基因簇,但实现这一目标的分子机制尚不十分明确。微生物可以产生具有转录调节和表观遗传修饰功能的化合物[17]。微生物的共培养还可以导致基因突变和其他沉默基因簇的表达,甚至整个基因片段的交换(水平基因转移),这可以产生以前未检测到的化学结构[18]。共培养也可以监测药物对合成微生物菌群的影响,与药物研究高度相关[19],还能减少代谢负担,限制多余副产物的形成,已成为合成和生产生物活性化合物的替代方法[20]。此外,由于天然微生物群落的复杂性,合成微生物群落可以随时间单独测量每种基因型的生长和代谢特性,因此通常更适用于数学建模[21]。
Chen等[22]在大米培养基上将土曲霉Aspergillusterreus与枯草芽孢杆菌Bacillussubtilis或蜡质芽孢杆菌Bacilluscereus共培养,与单一的土曲霉培养相比,其产生的天然产物积累增加了34倍。Kumari & Naraian[23]将佛罗里达平菇Pleurotusflorida和立枯丝核菌Rhizoctoniasolani共培养,得到了比单培养更高的生物产量。海洋真菌,Emericellasp.(CNL-878)和Salinisporaarenicola(CNH-665)共培养,使缩酚酸肽的产量增加了100倍[24]。共培养系统优于单一菌种培养或许是它们更为丰富的酶系统和生物诱导效应利用了中间代谢物,从而有利于生物量的快速增长[25]。杂色曲霉A.versicolor与枯草芽孢杆菌共培养产生的3,4-二氢萘醌-(2H)-1- 1- 1(1-四酮)衍生物,aspvanicin A及aspvanicin B从未从真菌或细菌单独的培养物中检测分离到。真菌-细菌共培养是一种诱导产生新的次生代谢产物的有效方法[26]。在放线菌Nocardiopsissp.RV163和Actinokineosporasp.EG49的共培养中诱导产生了三种在任一微生物单独培养物中都未检测到的化合物[27]。以上结果都表明,共培养是提高代谢产物含量和发现新的生物活性代谢物的重要潜在策略。
1.2 微生物共培养的固、液体系
培养条件会影响微生物的代谢产物,这促使研究人员用不同的培养基进行实验以优化代谢物的产生。培养基的可利用性取决于培养微生物的类型,无论在固体或液体中培养,培养条件必须对共培养双方都相容[10]。因此,人们可利用不同的底物类型和培养条件来改变微生物群落的培养特征。
1.2.1 固体基质上的共培养
在固体培养基上,可研究菌丝体前端的形态发生和代谢变化及其互作模式。利用真菌在固体培养基上的拮抗生长特征及物种的形态,可定位共培养微生物代谢物诱导的“化学战”区域(即代谢物诱导现象可能发生的地方)。但在培养皿中进行的固体培养下,只能提取有限数量的代谢物,当需要分离特定代谢产物进行重新鉴定或生物活性研究时,这种局限非常明显[10]。
1.2.2 液体培养基中的共培养
液体培养基中不同种类微生物的共培养也被称为混合发酵。混合发酵是增加天然产物库的有效方法,不仅有助于发现新的次级代谢产物,还有助于激活已知的微生物生产力[28]。在液体培养中,不易明确微生物之间相互作用的方式,但可以监测天然产物的诱导,如通过比浊法监测培养物的生长[10],通过高效液相监测代谢的变化。液体环境中的共培养已应用于各种微生物的开发利用中[29]。
1.2.3 固、液环境下共培养的优缺点
与液体培养相比,固体培养能产生更多数量的代谢物,也有助于观察真菌的相互作用区域,估计增长率等。另外,在固体培养基上共培养构成了一种简单、灵活且低成本的方式,在筛选真菌共培养中的诱导现象时优于液体培养[30]。然而,在固体培养基上大规模生产共培养产物仍然是一个相当复杂的过程。目前,已经开发了几种利用固体培养基共培养物的技术[31],这些方法能够产生足够数量的代谢物,从而对微生物代谢产物进行分离,用于深入的生物活性研究。然而,如果需要升级到工业生产,使用纯菌株和混合发酵则仍然是至关重要的。
1.3 不同分类群共培养体系的建立
细菌-细菌、真菌-真菌或细菌-真菌的共培养组合,代表了模拟生理条件的自然驱动方法[18]。科学家已成功研究了不同微生物组合的共培养对微生物种群生长、互作以及不同活性代谢物的影响[32]。表1列举了其中一些成功的实例。
1.3.1 细菌-细菌的共培养
细菌通常以细胞种群在微生态位上形成生物膜,一个或几个细菌物种密切相互作用并在群落中进化,以在有限的环境中利用有限的资源来确保物种存活,并得到诸如营养获取、动态生长、增加抗性等优势[33]。细菌共培养能够促使产生未知的次级代谢产物,包括许多具有抗肿瘤、抗癌、抗菌和防污特性的分子[34]。很多时候,这类细菌主要是革兰氏阳性的链霉菌,它们分布于土壤、各种海藻和海洋沉积物中[35]。
1.3.2 真菌-真菌的共培养
真菌-真菌的共同培养及其诱导的天然产物已见报道[36]。在共培养中两个彼此接近的菌丝体可以以不同的方式互作,包括共生,中性或竞争,它们也可以从一种类型转换到另一种互作类型。当不同菌株的菌丝在互作区相遇作用时,菌丝形态的改变加强,竞争性的菌株间可形成抗衡区,常强烈着色,暗示了显著的代谢活动,可用以寻找新的代谢物。在互作过程中发生的变化还包括细胞外酶和胞外次级代谢产物的产生,特别是酚类和醌类化合物,这意味着对“合作伙伴”的氧化应激,进而加速真菌的新陈代谢转变为次生代谢[10,37]。
1.3.3 细菌-真菌共培养
细菌-真菌的共培养是诱导次生代谢物、激发沉默基因簇的重要途径[15,26]。Machín-Ramírez 等[38]的实验表明,使用真菌-细菌共培养体系可以增强苯并[a]芘(Benzo[a]pyrene)的生物降解。几种不同细菌与曲霉共培养表明,真菌-细菌共培养体系是一种可丰富这些真菌化学多样性的有效工具[39](表1)。细菌与真菌共培养增加了真菌的生物活性,这或许与细菌在培养基中产生的次生代谢产物有关,这些细菌化合物作为信号分子诱导真菌合成抗菌化合物以提高真菌的生存[1]。
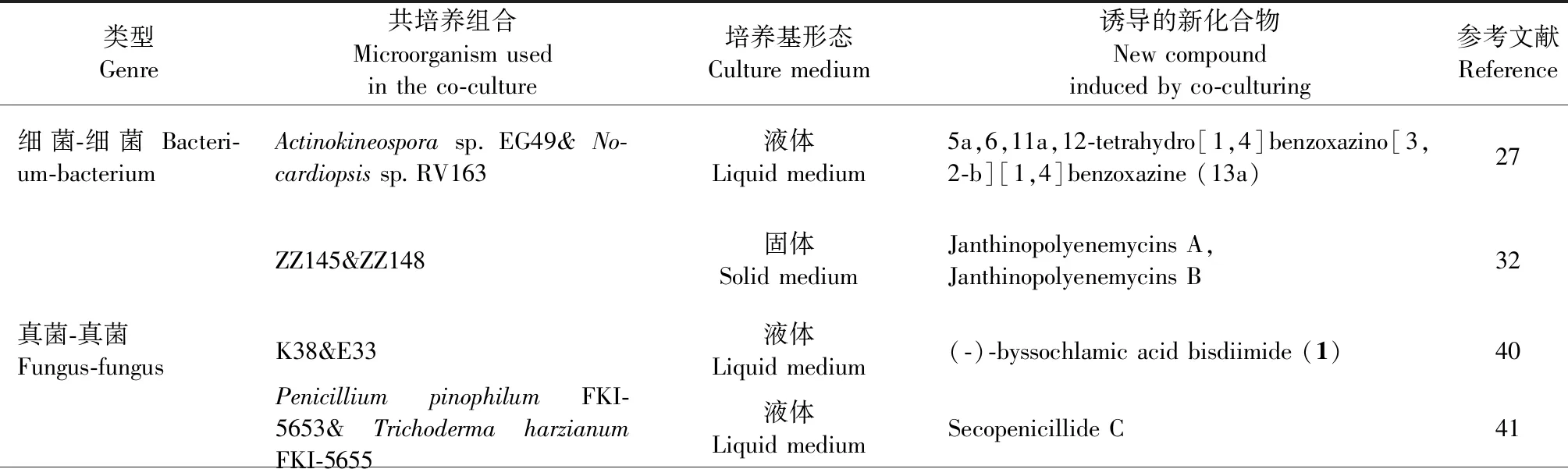
表1 一些共培养微生物组合及其诱导产生的重要生物活性化合物Table 1 Some co-cultured microbial combinations and important bioactive compounds induced by them
续表1(Continued Tab.1)
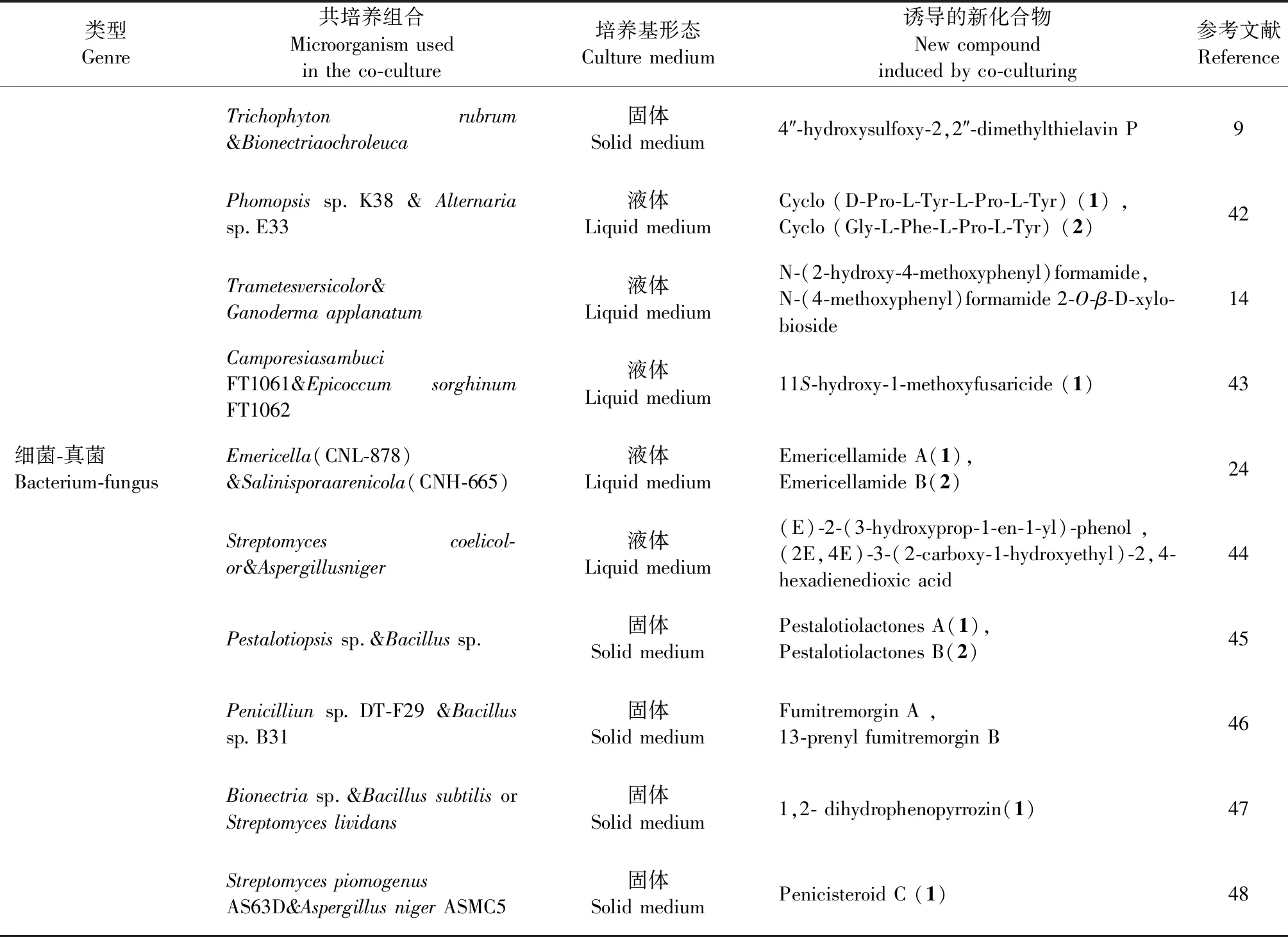
类型Genre共培养组合Microorganism usedin the co-culture培养基形态Culture medium诱导的新化合物New compound induced by co-culturing参考文献ReferenceTrichophyton rubrum &Bionectriaochroleuca固体Solid medium4″-hydroxysulfoxy-2,2″-dimethylthielavin P9Phomopsis sp.K38 & Alternaria sp.E33液体Liquid mediumCyclo (D-Pro-L-Tyr-L-Pro-L-Tyr) (1) ,Cyclo (Gly-L-Phe-L-Pro-L-Tyr) (2)42Trametesversicolor&Ganoderma applanatum液体Liquid medium N-(2-hydroxy-4-methoxyphenyl)formamide, N-(4-methoxyphenyl)formamide 2-O-β-D-xylo-bioside14Camporesiasambuci FT1061&Epicoccum sorghinum FT1062液体Liquid medium11S-hydroxy-1-methoxyfusaricide (1)43细菌-真菌Bacterium-fungusEmericella(CNL-878)&Salinisporaarenicola(CNH-665)液体Liquid mediumEmericellamide A(1),Emericellamide B(2)24Streptomyces coelicol-or&Aspergillusniger液体Liquid medium (E)-2-(3-hydroxyprop-1-en-1-yl)-phenol , (2E,4E)-3-(2-carboxy-1-hydroxyethyl)-2,4-hexadienedioxic acid 44Pestalotiopsis sp.&Bacillus sp.固体Solid mediumPestalotiolactones A(1),Pestalotiolactones B(2)45Penicilliun sp.DT-F29 &Bacillus sp.B31固体Solid mediumFumitremorgin A ,13-prenyl fumitremorgin B 46Bionectria sp.&Bacillus subtilis or Streptomyces lividans固体Solid medium1,2- dihydrophenopyrrozin(1)47Streptomyces piomogenus AS63D&Aspergillus niger ASMC5 固体Solid mediumPenicisteroid C (1)48
2 共培养产物的检测
由于微生物提取物的复杂性,先进的分析方法是成功检测和鉴定共培养代谢产物的关键。目前常用监测代谢物的方法主要有以下几种。
2.1 高效液相色谱法(HPLC)
这种方法提供了一种监测单一培养和共培养的不同色谱图之间的变化,可容易地鉴定共培养液中的代谢物,以检测代谢谱的变化[49]。
2.2 超高压液相色谱时间质谱指纹图(UHPLC-TOF-MS)
此法是近年来另一种检测共培养代谢物的有效方法[50,51]。它能在培养皿水平上筛选固体培养基中的真菌共培养物,通过自动生成的峰列表,进行统计处理来比较共培养物获得的LC-MS数据及其相应的单一培养物,突出真菌互作高表达的代谢物[30]。Bertrand等证明,这种方法可有效检测到几十种诱导代谢物[9]。Schroeckh等利用UHPLC-TOF-MS证明了通过真菌共培养可以诱导已知化合物的新硫酸化类似物[52]。
2.3 液相色谱/质谱(LC-MS)法
通常从培养基中提取天然产物,随后进行液相色谱-质谱(LC-MS)分析以纯化和分离潜在的新次级代谢产物,再利用核磁共振(NMR)技术对结构进行分析[19]。其它一些研究者也用这种方法发现和鉴定了通过共培养产生的多种活性物质[14]。
2.4 核磁共振(NMR)
此方法是代谢组学研究中应用的另一种主要分析技术,是结构鉴定的首选方法[53]。在利用核磁技术时,不需要进行样品分离或制备,且是非破坏性的,具有很强的追踪代谢途径的能力,能够明确鉴定未知代谢物的结构,在识别复杂混合物中的分子方面特别有效,因此有助于群落新陈代谢的直接生化分析[54]。Bertrand等[9]通过NMR技术成功鉴定了共培养的诱导物来源及新化合物的结构。
当能够直接观察到代谢物诱导现象时,可用前述简单的高效液相色谱(HPLC);如果没观察到显著的代谢物变化时,则需要利用高级数据挖掘的敏感代谢组学方法[10]。代谢组学被定义为一种非选择性,普遍适用的综合分析方法。该研究领域致力于获得完整的代谢物指纹,检测代谢物之间的差异并产生假设来解释这些差异[19,55]。此外,使用代谢组学分析可以快速鉴定在真菌-真菌相互作用过程中产生的新化合物[4]。而这些数据分析可以利用一些有利的工具进行,如MultiGeneBlast(用于手动挖掘基因组)[56],PubChem数据库(专注于化合物的数据库)[57],GNP / iSNAP网络应用程序(用于天然产物鉴定的代谢组学工具)[58],SMBP(用于基于代谢组学的次级代谢研究,可在http://www.secondarymetabolites.org上公开获取)[59],Mminte(用于预测微生物间发生的相互作用类型,可在www.github.com/mendessoares/MMinte上公开获取)[60]等。此外,共培养产物的分析也是一项重大的有挑战性的工作,它可通过使用多种提取方法[61]和互补的复杂分析平台[62],对产生的结构信息与复杂混合物中代谢物的鉴定进行比较[63]。
3 微生物群落的共培养应用
通过共同培养多种微生物而促进天然产物形成的研究表明,共培养是一种可促进生物活性代谢物形成的(在单一培养中不存在)极有前途的方法[64]。微生物组和功能菌群的研究推动了基础研究向实际应用的转化,具有巨大的应用潜力,并获得了一些创新性的进展。表2总结了近年来共培养在工业、生态等领域的应用实例。

表2 不同微生物共培养组合的成功应用实例Table 2 Successful application examples of different microbial co-culture combinations
4 结论
微生物群落的共培养已成为诱导沉默的次级代谢产物合成基因簇的一种强有力的方法[73,74]。对于合成微生物群落共培养,在今后研究中需要关注如下几个问题。
首先,合成微生物群落,通过改变细胞间交流、物种代谢作用以及空间结构等方式进行调控,实现极为精细的合作分工。为了更深入地了解微生物共培养的分子机制,可以利用宏基因组方法,从菌群基因组水平解析微生物群落组成及代谢调控多样性。
其次,在微生物共培养体系中产生的次级代谢产物产量相对较少,因此开发分析工具变得越来越重要。将代谢分析工具和代谢网络优化工具转化为共培养应用程序,促进未知代谢物的鉴定,开发衍生化合物的共享数据库是我们进一步理解微生物间互作的重要环节[75]。
共培养与生物转化的结合也十分重要。微生物转化法是通过微生物整体细胞或产生的酶将复杂的底物进行结构修饰和改造,其本质在于利用微生物代谢过程中产生的某个或某一系列的酶对底物(或外源化合物)进行催化反应,使一种化合物转变成更有经济价值的产物。活性天然产物的生物转化产生的代谢产物具有较强的生物活性和较低的毒性[76]。除了共培养产生新的代谢产物外,生物转化大大增加了发现新化合物的概率,这为药物发现提供了新的思路和途径[43]。本实验室利用灵芝菌-蛹虫草共培养发酵太子参的实验中发现,在共培养的过程中,虫草素的含量高于单菌发酵,说明在共培养的过程中会促进某些次级代谢产物的形成,导致现有天然产物积累的增加。

