体循环肠灌流法研究红禾麻提取物在类风湿性关节炎大鼠与正常大鼠体内的肠吸收差异
李 莹,康宁芳,巩仔鹏,陈思颖,兰燕宇
贵州医科大学 贵州省药物制剂重点实验室 省部共建药用植物功效与利用国家重点实验室 民族药与中药开发应用教育部工程研究中心药学院,贵阳 550004
类风湿性关节炎(rheumatoid arthritis,RA)是一种常见的全身性免疫病,其主要症状是多滑膜关节炎和关节外损伤,它通常会导致肿胀、发红、疼痛、关节损伤畸形等,严重危害病人的健康[1]。由于目前该病的发病机制仍不明确,临床治疗往往以西药为主,作用机制呈现单一的特点,因此亟需新型安全、疗效独特的治疗药物。在治疗RA方面,我国传统医学通过“整体观念、辨证论治”,将中药应用于类风湿性关节炎的治疗,展现了其“多成分、多环节、多途径、多靶点”的作用特点和治疗优势。
红禾麻又名“红活麻”,系荨麻科艾麻属植物珠芽艾麻Laporteabulbifera(Sieb.et Zucc.)Wedd.的新鲜或干燥全草[2],是贵州地区用于治疗风湿及类风湿性关节炎的常用苗药,其主要化学成分包括内酯类、鞣质类、黄酮类及苯丙素类等[3-6]。红禾麻药用价值较高,具有抗炎、镇痛、降血脂、祛风湿、免疫抑制等作用[7,8]。目前,关于红禾麻的文献报道主要集中在药理作用及化学成分等方面,未见红禾麻体内吸收及其影响因素的报道,尤其是RA病理状态下的肠吸收研究尚属空白。Gong等[9]认为,疾病状态会影响中药的药代动力学特征,生理及病理状况的变化在一定程度上会影响体内药物代谢酶、转运蛋白、细胞膜通透性、微生物菌群等的改变,导致中药在机体内的吸收、分布、代谢、排泄过程发生显著改变。故本研究采用在体循环肠灌流法,考察红禾麻提取物中8种代表成分在生理病理状态下的肠吸收差异,探讨不同因素对其肠吸收特性的影响,为红禾麻临床治疗RA的合理用药提供参考。
1 仪器与试药
Acquity UPLC超高压液相-三重四级杆串联质谱仪(美国Waters公司,包括Masslynx 4.1质谱仪工作站);PV-200型足趾容积测量仪(成都泰盟生物有限公司);HL-2S型恒流泵(上海青浦沪西仪器厂);红禾麻药材采收于贵州省贵安新区,由贵州中医药大学孙庆文教授鉴定为荨麻科艾麻属植物红禾麻Laporteabulbifera(Sieb.et Zucc.)Wedd.的新鲜全草;新绿原酸、绿原酸、隐绿原酸对照品(江西佰草源生物科技有限公司,批号分别为BCY-0921,BCY-0414,BCY-0920,纯度均≥98%);芦丁、异槲皮苷、槲皮苷、山奈酚-3-O-芸香糖苷、木犀草苷、葛根素对照品(中国食品药品检定研究院,批号分别为100080-201610、112007-201602、111538-201606、111809-201403、111720-201408、110752-201514,纯度均≥98%);完全弗式佐剂(CFA,sigma公司,批号:SLBW5971);乙腈、甲醇、甲酸(色谱纯,德国Merck公司);水为超纯水。
健康雄性SD大鼠,SPF级,体重 220~250 g,购于长沙天勤生物技术有限公司,动物生产许可证号:SCXK(湘)2014-0011。经贵州医科大学实验动物伦理委员会批准,批准号:1503017。
2 方法
2.1 分析条件
2.1.1 色谱条件
色谱柱 Waters BEH C18(2.1 mm×50 mm,1.7 μm);流速 0.35 mL/min;柱温 45 ℃;流动相 0.1%甲酸乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱条件(0~0.5 min,5%~9% A;0.5~2.0 min,9%~15% A;2.0~4.0 min,15%~20% A;4.0~4.5 min,20%~95% A;4.5~5.0 min,95%~5% A),进样体积3 μL。
2.1.2 质谱条件
电喷雾电离源(ESI);毛细管电压3 KV;离子源温度150 ℃;去溶剂气温度400 ℃;去溶剂气 N2,流速800 L/h;反吹气 N2,流速50 L/h;质谱数据采集及处理软件为MassLynx V 4.1工作站;扫描方式为单离子监测(SIR)。监测离子:m/z(-)353.3(新绿原酸);m/z(-)353.1(绿原酸);m/z(-)353.2(隐绿原酸);m/z(-)609.1(芦丁);m/z(-)463.0(异槲皮苷);m/z(+)449.1(槲皮苷);m/z(-)593.0(山奈酚-3-O-芸香糖苷);m/z(-)447.3(木犀草苷);m/z(+)417.0(葛根素);锥孔电压分别为:25、35、35、50、45、30、50、35、25。
2.2 溶液的配制
K-R营养液[11]:精密称取NaCl 7.8 g,KCl 0.35 g,NaHCO31.37g,NaH2PO40.32 g,MgCl20.02 g,CaCl20.37 g,葡萄糖1.40 g,溶解在少量水中,氯化钙单独溶解并逐滴加入,蒸馏水溶解后定容至1 L。
内标溶液:精密称取葛根素对照品适量,加甲醇溶解并定容,得浓度为葛根素(1.280 mg/mL)的储备液。置于冰箱-20 ℃保存,备用。
混合对照品溶液:精密称取对照品适量,加甲醇溶解并定容,得浓度分别为新绿原酸(1.024 mg/mL)、绿原酸(1.114 mg/mL)、隐绿原酸(1.086 mg/mL)、芦丁(0.508 mg/mL)、异槲皮苷(0.538 mg/mL)、槲皮苷(0.710 mg/mL)、山奈酚-3-O-芸香糖苷(0.531 mg/mL)、木犀草苷 (1.022 mg/mL)的储备液。取上述储备液适量,37 ℃氮气下吹干,空白K-R营养液溶解并逐级稀释至所需质量浓度,得混合系列标准溶液。置于冰箱-20 ℃保存,备用。
空白肠循环液:取37 ℃ K-R液50 mL,置于量筒中,进行在体肠灌流试验,循环3 h,即得。
红禾麻提取物供试液[10,11]:取红禾麻药材5 kg干燥打粗粉并均匀混合,按文献方法[6]回流提取,即得红禾麻固体提取物,提取率为2.87%。取上述提取物适量,加入适量的K-R营养液,超声30 min溶解,5 000 rpm 离心10 min,取上清液,即得2.5、5.0、10.0 mg/mL的供试液。经UPLC-MS/MS法测定,红禾麻提取物中各成分的含量分别为新绿原酸(2.32%),绿原酸(6.54%),隐绿原酸(4.68%),芦丁(11.45%),槲皮苷(0.63%),异槲皮苷(2.15%),山奈酚-3-O-芸香糖苷(2.30%),木犀草苷(1.04%)。
2.3 大鼠在体肠吸收试验
2.3.1 大鼠分组与造模
将SD大鼠随机分为对照组和模型组。根据文献方法[12],模型组采用0.1 mL完全弗氏佐剂(CFA)注射于每只大鼠右后足跖皮内,使其致炎,正常组注射相应体积的生理盐水,并在7天后再次免疫,持续21天后,佐剂性关节炎(adjuvant arthritis,AA)大鼠模型成功复制。由于AA大鼠模型的临床表现、病理机制、免疫学变化等方面与RA有诸多相似性,故选用此模型。
参照文献方法[13],分别于大鼠造模前及造模后第9、13、17、21天按照关节炎指数(AI)评分标准对AA大鼠进行评估,累计评分>6分的大鼠用于实验。评分标准见表1。

表1 大鼠关节指数评分标准(0~4级)Table 1 Rat arthritis index scoring criteria (grade 0-4)
2.3.2 在体循环肠灌流试验
正常和AA模型大鼠禁食不禁水12 h,麻醉(腹腔注射10%水合氯醛,3.7 mL/kg)后固定于手术台上,其余按照文献方法操作[14,15],使试验肠段与恒流泵形成回路。取37 ℃红禾麻提取物溶液50 mL,以5 mL/min流速循环15 min后,将流速调节为2.5 mL/min,立刻读出肠循环液的体积并从循环液量筒中取样1 mL,作为零时间的样品。另需向量筒中补加37 ℃ K-R营养液1 mL,其后于30、60、90、120、150、180 min时同法读数,取样并补加 K-R液,循环3h后终止。待循环完毕后,用空气排净管路和肠道内液体,并量取其体积,即为管路、肠道的死体积。死体积加上各时间点的量筒读数体积即为该时间点循环液体积。以此方法进行肠循环液的体积校正,进而计算各时间点药物的量,即剩余药量Ptn(μg)。
A%=(Pt0-Pt3)/Pt0×100%
其中,Ptn为 tn 时刻循环液中的剩余药量;Ct1为循环液药物初始浓度;Vt1为循环液初始体积;Ctn(i=n)为tn时刻肠循环液药物浓度;Vtn为 tn 时刻肠循环液体积;Pt0为0 h时的剩余药量;Pt3为3 h时的剩余药量;A为3 h累积吸收转化率。以剩余药量的自然对数对取样时间t作图,所得的直线斜率即为吸收速率常数(Ka)。
2.4 样品处理方法
取样品200 μL,加入葛根素(1.0 μg/mL)内标溶液20 μL,0.1%甲酸水溶液40 μL,加入甲醇400 μL,涡混3 min,超声(80 Hz)10 min,12 000 rpm离心10 min。取上清液于37 ℃氮气下吹干,残渣加入100 μL 50%甲醇水溶解,涡混3 min,超声(80 Hz)10 min,12 000 rpm离心10 min,取上清液UPLC-MS/MS进样分析。
3 结果
3.1 方法学考察
3.1.1 专属性
取空白肠循环液、空白肠循环液加内标及混合对照品溶液、含红禾麻提取物的实测样品,按“2.4”、“2.1”项下操作,得到色谱图A、B、C。结果表明8种成分分离完全,空白肠循环液无干扰,各成分及葛根素的保留时间(RT)分别为1.12、1.49、1.58、1.86、2.89、3.04、3.17、3.47、3.70 min,该法的专属性良好。
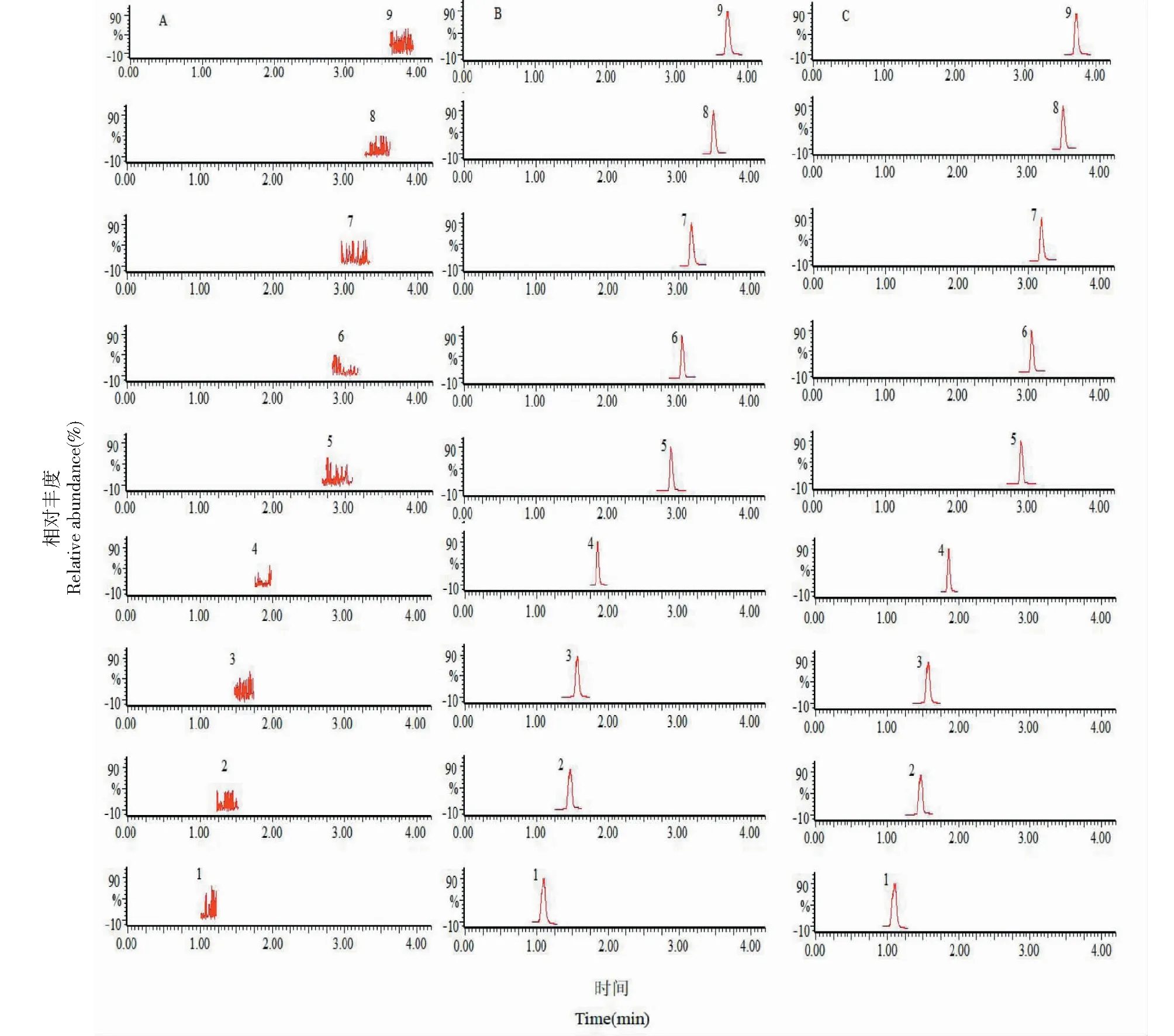
图1 典型色谱图Fig.1 Typical chromatogram 注:A:空白肠循环液;B:空白肠循环液加对照;C:实测肠循环液样品;1.新绿原酸;2.绿原酸;3.隐绿原酸;4.葛根素;5.芦丁;6.异槲皮苷;7.槲皮苷;8.山奈酚-3-O-芸香糖苷;9.木犀草苷;Note:A:blank solution;B:blank solution spiked with standands;C:real sample;1.neochlorogenic acid;2.chlorogenic acid;3.cryptochlorogenic acid;4.puerarin;5.rutin;6.isoquercetin;7.quercetin;8.kaempferol-3-O-rutinoside;9.galuteolin.
3.1.2 标准曲线与定量下限、最低检测限
取“2.2”项下系列浓度混合对照品溶液200 μL(新绿原酸质量浓度分别为0.37、0.74、1.49、2.98、5.95、11.91 μg/mL,绿原酸质量浓度分别为0.81、1.62、3.24、6.48、12.95、25.91 μg/mL,隐绿原酸质量浓度分别为0.79、1.58、3.16、6.31、12.63、25.26 μg/mL,芦丁质量浓度分别为2.95、5.91、11.81、23.63、47.25、94.50 μg/mL,异槲皮苷质量浓度分别为0.39、0.78、1.56、3.13、6.26、12.51 μg/mL,槲皮苷质量浓度分别为0.19、0.37、0.74、1.49、2.97、5.94 μg/mL,山奈酚-3-O-芸香糖苷质量浓度分别为0.77、1.54、3.09、6.17、12.35、24.70 μg/mL,木犀草苷质量浓度分别为0.77、1.55、3.10、6.19、12.38、24.77 μg/mL),按“2.4”、“2.1”项下操作。以待测物的峰面积与内标物峰面积之比(A/Ai()为纵坐标(Y(,各物质浓度((C()为横坐标(X(进行直线回归,权重系数为1/(X(,获得回归方程。最低定量限(LLOQ)定义为S/N=10,最低检测限(LLOD)定义为S/N=3。各成分标准曲线方程依次为y= 0.966 7x+ 0.374 7(r=0.999 1)、y=0.753 6x+0.440 1(r=0.999 5)、y= 1.238 9x+0.515 8(r=0.999 6)、y= 3.607 8x+2.185 3(r=0.999 2)、y=4.424 4x+0.567 0(r=0.999 6)、y=8.327 9x+1.050 8(r=0.999 4)、y= 4.389 9x+3.349 9(r=0.999 2)、y=1.829 5x+1.111 7(r=0.999 2)。各成分在其线性范围内线性关系良好(r≥0.999),LLOQ分别为0.37、0.81、0.79、2.95、0.39、0.19、0.77、0.77 μg/mL,LLOD分别为0.022、0.045、0.038、0.168、0.021、0.018、0.053、0.059 μg/mL。
3.1.3 精密度和准确度
按“3.1.2”项下方法,分别配制同一分析批的8种成分定量下限以及低、中、高浓度(新绿原酸0.74、2.23、8.93 μg/mL;绿原酸1.62、4.86、19.43 μg/mL;隐绿原酸1.58、4.74、18.94 μg/mL;芦丁5.91、17.72、70.88 μg/mL;异槲皮苷0.78、2.35、9.38 μg/mL;槲皮苷0.37、1.11、4.46 μg/mL;山奈酚-3-O-芸香糖苷1.54、4.63、18.52 μg/mL;木犀草苷1.55、4.64、18.57 μg/mL)混合质控(QC)样品,各浓度平行制备5份,按“2.4”、“2.1”项下操作,考察批内精密度和准确度;同法配制3个分析批的定量下限以及低、中、高质量浓度质控样品,各样品连续进样3天,各浓度平行测定5次,考察批间精密度和准确度。结果表示:批内精密度的RSD为2.84%~9.45%,准确度(RE)为-3.82%~7.56%;批间精密度的RSD为9.35%~10.22%,准确度(RE)为-4.26%~5.45%,符合生物样品的测定要求。
3.1.4 提取回收率
取“2.2”项下空白肠循环液200 μL,置于1.5 mL离心管中,分别加入“3.1.2”项下方法配制的系列浓度混合对照品溶液适量,按“2.4”、“2.1”项下操作,得各成分峰面积(A提取);另取空白肠循环液200 μL,按“2.4”项下方法处理至氮气吹干,残渣加入相应质量浓度的系列混合标准品溶液,混匀,使最终质量浓度与前者一样,再按“2.1”项下进样,得各成分峰面积(A未提取);提取回收率=(A提取/A未提取)×100%。每个质量浓度平行5个样本。结果表明,8种成分的提取回收率为71.45%~83.26%(RSD<7%,n=5);内标的提取回收率为80.22%~ 85.12%(RSD<8%,n=5)。
3.1.5 基质效应
取“2.2”项下低、中、高浓度混合对照品溶液适量,37 ℃氮气下吹干,加入空白肠循环液200 μL使溶解,按“2.4”、“2.1”项下操作,每个质量浓度进样5次,记录峰面积(A1);另取对应质量浓度的混合对照品溶液适量,37 ℃氮气下吹干,加入50%甲醇200 μL使溶解,每个质量浓度进样5次,记录峰面积(A2);基质效应=A1/ A2×100%。结果表明,各待测物的基质效应为81.35%~ 112.65%(RSD<8%,n=5),内标的基质效应为86.22%~105.43%(RSD<8%,n=5),基质效应不影响待测物的测定。
3.1.6 稳定性
在组织胚胎学中,外分泌腺根据腺细胞的数目,可以被分为单细胞腺和多细胞腺。其中单细胞腺是单个有分泌机能的腺上皮细胞。这种腺上皮细胞呈杯状,分泌粘液。由许多上皮细胞构成的腺被称为多细胞腺,多细胞腺分为两部分:导管与腺体。多细胞的外分泌腺根据腺体部的形态及导管的分枝与不分枝,可分类如下:
按“3.1.2”项下方法配制各待测物低、中、高质量浓度混合对照品溶液,按“2.4”项下处理后,分别于0、2、4、6、8、12 h(室温)取样,按“2.1”项下进样,以各指标成分峰面积计算该样品的稳定性。结果表明,各成分的RSD值均小于8.5%(n=6),提示肠灌流液样品在12 h内稳定。
3.2 红禾麻提取物的肠吸收试验
3.2.1 红禾麻提取物的PH对肠吸收的影响
取AA模型大鼠与正常SD大鼠各16只,每组4只,选择5.0 mg/mL红禾麻提取物溶液作为肠灌流液,按“2.3.2”项下方法操作,考察AA模型与正常大鼠在不同pH(5.0、6.0、6.8、7.4)红禾麻提取物中各成分的A和Ka,见表2~3。结果表明,正常组与AA模型组中各成分的吸收均受pH的影响,pH为6.0时各成分的A和Ka较大,故选择pH6.0的红禾麻提取物进行后续实验。
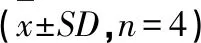
表2 pH值对正常大鼠8种成分肠吸收的影响Table 2 Effect of pHvalue on intestinal absorption of 8 components in normal
续表2(Continued Tab.2)
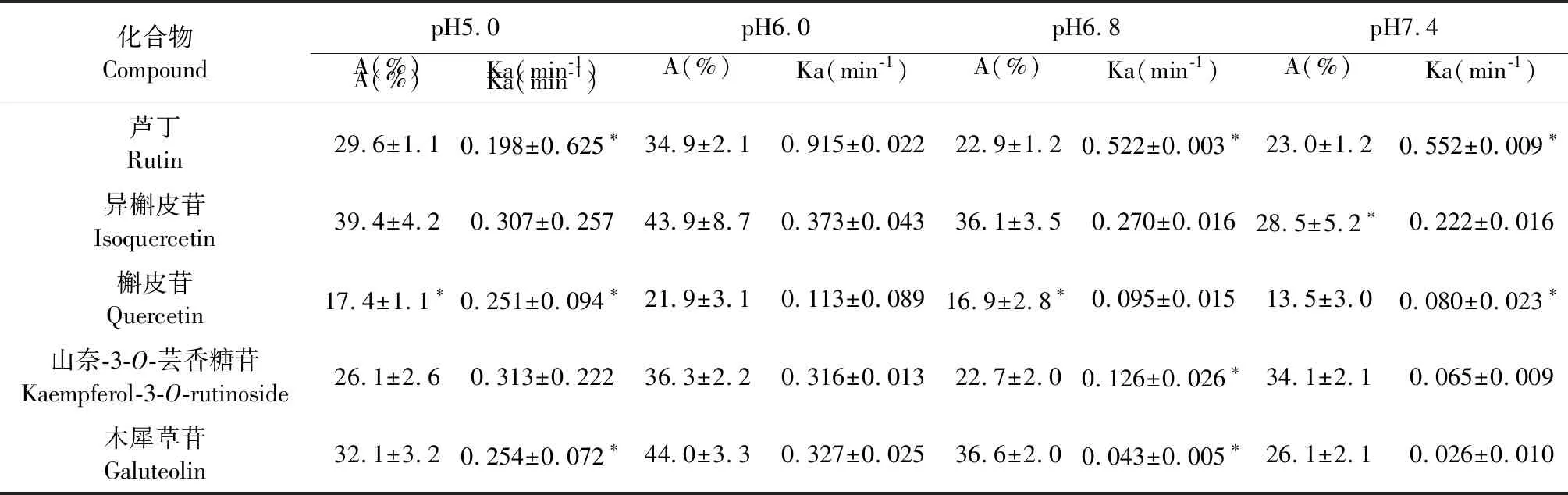
化合物CompoundpH5.0pH6.0pH6.8pH7.4A(%)Ka(min-1)A(%)Ka(min-1)A(%)Ka(min-1)A(%)Ka(min-1)A(%)Ka(min-1)芦丁Rutin29.6±1.10.198±0.625∗34.9±2.10.915±0.02222.9±1.20.522±0.003∗23.0±1.20.552±0.009∗异槲皮苷Isoquercetin39.4±4.20.307±0.25743.9±8.70.373±0.04336.1±3.50.270±0.01628.5±5.2∗0.222±0.016槲皮苷Quercetin17.4±1.1∗0.251±0.094∗21.9±3.10.113±0.08916.9±2.8∗0.095±0.01513.5±3.00.080±0.023∗山奈-3-O-芸香糖苷Kaempferol-3-O-rutinoside26.1±2.60.313±0.22236.3±2.20.316±0.01322.7±2.00.126±0.026∗34.1±2.10.065±0.009木犀草苷Galuteolin32.1±3.20.254±0.072∗44.0±3.30.327±0.02536.6±2.00.043±0.005∗26.1±2.10.026±0.010
注:与pH6.0组相比,*P<0.05;与正常组相同pH相比,aP<0.05。
Note:Compared with pH6.0,*P<0.05;Compared with the normal group at the same pH,aP<0.05.
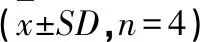
表3 pH值对AA模型大鼠8种成分肠吸收的影响Table 3 Effect of pHvalue on intestinal absorption of 8 components in AA model
注:与pH6.0组相比,*P<0.05;与正常组相同pH相比,aP<0.05。
Note:Compared with pH6.0,*P<0.05;Compared with the normal group at the same pH,aP<0.05.
3.2.2 红禾麻提取物的质量浓度对肠吸收的影响
考察质量浓度为2.5、5.0、10.0 mg/mL(pH6.0)的红禾麻提取物供试液,各取50 mL置于37 ℃恒温水浴中,按“2.3.2”项下方法操作,进行大鼠在体循环肠灌流实验,考察供试液中8种成分的A和Ka,见表4和5。结果表明,在考察浓度范围内,病理及生理状态下的槲皮苷存在高浓度饱和现象,表明其体内吸收方式为主动转运,其余7个成分的A和Ka呈随着浓度的增加而增大的趋势,提示其余7个成分的吸收机制可能为被动扩散。
与正常组同一浓度相比,模型组中各成分的吸收趋势总体上优于正常组。AA模型组中芦丁与槲皮苷在低、中浓度下的A、Ka值显著高于正常大鼠,山奈酚-3-O-芸香糖苷在高浓度时的A、Ka显著高于正常大鼠,推测病理状态下,AA模型大鼠的肠黏膜通透性增加,吸收增强。
3.2.3 红禾麻提取物在不同肠段的吸收特征
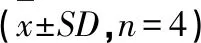
表4 浓度对正常大鼠8种成分肠吸收的影响Table 4 Effect of concentration on intestinal absorption of 8 components in normal
注:与高浓度组相比,*P<0.05;与正常组相同浓度相比,aP<0.05。
Note:Compared with high concentration,*P<0.05;Compared with the normal group at the same concentration,aP<0.05.
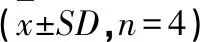
表5 浓度对AA模型大鼠8种成分肠吸收的影响Table 5 Effect of concentration on intestinal absorption of 8 components in AA model
注:与高浓度组相比,*P<0.05;与正常组相同浓度相比,aP<0.05。
Note:Compared with high concentration,*P<0.05;Compared with the normal group at the same concentration,aP<0.05.
3.2.4 胆汁和P-gp对红禾麻提取物肠吸收的影响
取AA模型大鼠与正常SD大鼠各12只,每组4只,模型与正常大鼠均分为对照组(结扎总胆管,不加P-gp抑制剂)、不结扎组(不结扎总胆管,不加P-gp抑制剂);P-gp抑制剂组(结扎总胆管,加P-gp抑制剂盐酸维拉帕米108 μg/L)。选择5.0 mg/mL (pH6.0)红禾麻提取物溶液作为肠灌流液,以全肠段为目标肠段,通过方差分析比较A,考察胆汁及P-gp对红禾麻提取物吸收的影响,见表8和9。
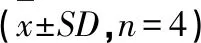
表6 肠段对正常大鼠8种成分肠吸收的影响Table 6 Effect of intestinal segment on intestinal absorption of 8 components in normal
注:与十二指肠组相比,*P<0.05;与正常组相同肠段相比,aP<0.05。
Note:Compared with the duodenum,*P<0.05;Compared with the normal group at the same intestine,aP<0.05.
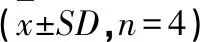
表7 肠段对AA模型大鼠8种成分肠吸收的影响Table 7 Effect of intestinal segment on intestinal absorption of 8 components in AA model
注:与十二指肠组相比,*P<0.05;与正常组相同肠段相比,aP<0.05。
Note:Compared with the duodenum,*P<0.05;Compared with the normal group at the same intestine,aP<0.05.
结果表明,与结扎胆总管后的对照组相比,胆汁对正常组中的绿原酸、芦丁、木犀草苷有显著抑制作用,对槲皮苷有显著促进作用;此外,胆汁对模型组中新绿原酸、芦丁有显著抑制作用,对异槲皮苷、槲皮苷有显著促进作用。故实验之前需进行胆管结扎,以排除胆汁对各成分的影响,保证实验数据可靠。
与未加P-gp抑制剂的对照组相比,正常与AA模型组的肠吸收均受盐酸维拉帕米的影响。正常大鼠与AA模型大鼠中绿原酸的A和Ka值均有所减小,但对槲皮苷的吸收明显增加,推测槲皮苷可能是P-gp的底物。与正常组相比,AA模型组中各成分在肠道的吸收总体上增加。
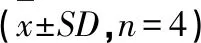
表8 胆汁和P-gp抑制剂对正常大鼠8种成分肠吸收的影响Table 8 Effect of bile and p-gp inhibitor on intestinal absorption of 8 components in normal
注:与对照组相比,*P<0.05;与正常组相同项下相比,aP<0.05.
Note:Compared with the control,*P<0.05;Compared with the normal group at the same item,aP<0.05.
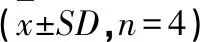
表9 胆汁和P-gp抑制剂对AA模型大鼠8种成分肠吸收的影响Table 9 Effect of bile and p-gp inhibitor on intestinal absorption of 8 components in AA model
注:与对照组相比,*P<0.05;与正常组相同项下相比,aP<0.05.
Note:Compared with the control,*P<0.05;Compared with the normal group at the same item,aP<0.05.
4 讨论
红禾麻提取物中8个成分在肠道的吸收试验表明,正常与病理状态下,槲皮苷不完全依赖浓度梯度转运,其在小肠的吸收方式可能为主动转运,其余7个成分的吸收速率与药物浓度呈良好的线性关系,提示其吸收机制可能为被动扩散,各成分的吸收均受pH、胆汁和P-gp的影响。除绿原酸和隐绿原酸外,正常大鼠对其余各成分的总体吸收趋势为回肠>十二指肠>空肠>结肠,AA模型对其余各成分的总体吸收趋势为十二指肠>回肠>空肠>结肠。与正常大鼠相比,AA模型大鼠的主要吸收部位为十二指肠,各成分的吸收趋势优于正常大鼠,表明RA可能会使红禾麻提取物中某些成分从小肠中的最大吸收部位后移,推测病理状态可能会改变药物的主要吸收部位,猜测其原因可能为[16]炎症能够调节细胞膜上有关转运体的表达、细胞膜的通透性,从而可能使药物的药代动力学行为发生变化,但具体机制尚待探究。
因AA模型与人RA在发病机制、临床表现、病理、免疫等方面有诸多相似性,且AA模型易于操作,越来越被研究者所认可。在该实验中,造模大鼠的关节表现出明显的炎症反应,如短时间内不同程度的发红、发热、肿胀等,表明该模型建立成功,与文献中报道[17]一致。
在体循环灌流模型既保证了实验动物血液和淋巴液的供应,又提高了实验动物各肠段的生物活性,且该模型能较好的模拟人体体内环境,更接近生物体本身,因而能够真实地反映药物的吸收情况。但该法也有一定的局限性[18]:(1)在探讨肠段对红禾麻提取物肠吸收的过程中,通过结扎各肠段来形成灌流通路,以等浓度的药物灌流液进行实验,但在实际情况中,药物口服后,依次经过十二指肠、空肠、回肠及结肠,到达各肠段的药物浓度往往不相等,使得实验结果发生偏倚;(2)在体循环实验中,灌流时间较长,可能对肠黏膜造成损伤,导致实验结果产生误差。
P-gp能够与药物结合使药物外排出细胞外,从而影响药物的吸收,导致进入体内的浓度降低而影响药物发挥效应。盐酸维拉帕米既是P-gp底物,又是其外排的典型抑制剂,在小肠的吸收较完全,被广泛应用。本实验中,加入P-gp抑制剂维拉帕米后,不同状态下槲皮苷的A和Ka显著性增加,表明槲皮苷的吸收受肠道上皮细胞中P-gp外排的影响,可能是P-gp的底物,为其临床药物相互作用的分析提供了重要理论依据。
研究表明[19],槲皮苷和异槲皮苷可以完整的分子形式透过单层Caco-2细胞而被肠道收,同时在细胞内和基底侧存在广泛的代谢转化,推测槲皮素糖苷之间可能具有相同的肠道吸收机制。本实验中,槲皮苷的吸收机制为主动转运,异槲皮苷的吸收机制为被动扩散,与文献结果矛盾,基于此,课题组后续将采用其他方法和模型(如Caco-2细胞、离体外翻肠囊法等)对本研究结论进行验证,进一步探讨红禾麻提取物在肠道中的吸收特征。

