过氧化氢法改性羊肚菌多糖研究
张雪松,谢春芹,凡军民,曹 正,许俊齐,刘焕颖
江苏农林职业技术学院茶与食品科技学院,句容 212400
羊肚菌是一种珍稀食用菌品种,具有丰富的营养,药用价值较高。近年来的研究表明食用菌多糖具有抗氧化、抗肿瘤、降血脂、降血糖、提高人体免疫力、抑菌、抗癌等重要生物学功能[1,2]。目前,对羊肚菌多糖的研究主要集中在提取、分离纯化以及抗肿瘤、抗氧化等生物活性研究[3,4]。
糖苷酶是一种可以水解糖苷键的酶,在糖和糖复合物的水解和合成中起着关键作用。目前为止,在2型糖尿病的治疗药物中,糖苷酶抑制剂因其具有毒副作用小甚至无毒,且作用温和持久等优点,得到越来越多的研究者青睐[5]。天然糖苷酶抑制剂的研究开发在近年来已成为比较活跃的领域。目前,以淀粉、麦芽糖、蔗糖为底物的糖苷酶抑制剂定向筛选模型因其作用机制明确、靶向作用具体、假阳性率低等优点而备受关注[6]。
从食药用真菌中筛选天然糖苷酶抑制剂是一条极为重要的途径,同时,不断尝试以分子结构母体为模型进行修饰改性,开发新型、廉价、高效的降糖药是糖苷酶抑制剂研究领域的研究趋势和最终目的。近年来,已经有学者对灵芝多糖、山茱萸多糖等深入研究并表明多糖在糖苷酶抑制剂开发方面具有诱人的价值[7,8]。食用菌多糖被视为较为理想的来源,但由于其性质和结构的限制,其生物活性很难与药物相比。多糖的生物活性与其糖苷键的类型、相对分子量、空间结构有很大的关联性[9],通过多糖的改性研究能够改变其空间结构、分子量和取代基的种类数量,从而影响抗肿瘤、抑菌、抗氧化等生物活性[10]。多糖经过改性后其生物活性可以得到明显提升,甚至产生新的生物学活性。Chen、Wang等[11,12]曾对羊肚菌多糖以及无花果多糖分别进行乙酰化和超声改性,乙酰化及超声改性产物的抗氧化等生物活性均有所增强。
目前对羊肚菌多糖体外降血糖研究尚少,更是鲜有文献对羊肚菌多糖改性产物进行深一步的体外降血糖研究。因此,本文在课题组前期研究的基础上,选择对α-淀粉酶抑制率相对较低的羊肚菌多糖进行改性研究。在筛选羊肚菌多糖改性方法的基础上,选择过氧化氢氧化降解羊肚菌多糖,以α-淀粉酶抑制率对许多改性方法进行研究,针对过氧化氢氧化法进行了单因素试验以及响应面分析,考察料液比、时间、pH值、温度等因素的影响,优化其工艺条件,进一步提升羊肚菌多糖对糖苷酶的抑制能力,为多糖类物质的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
羊肚菌,江苏农林职业技术学院食用菌教学基地种植栽培。4-硝基苯基-α-D吡喃半乳糖苷、蔗糖、麦芽糖、淀粉、无水碳酸钠、氢氧化钠、3,5-二硝基水杨酸、磷酸二氢钾、磷酸氢二钾、30%过氧化氢、乙酸酐、硫酸铵、正丁醇、酒石酸钾钠、氯仿均为分析纯,国药集团化学试剂有限公司。四种酶制剂见表1。

表1 酶制剂 Table 1 Enzyme preparations
1.2 仪器与设备
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;GZLYZ-1真空冷冻干燥机 诸城市博汇机械有限公司;HWS24型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;KQ-500DV型数控超声波清洗器 昆山市超声仪器有限公司;CP214电子天平 奥豪斯仪器(上海)有限公司;SY-5000旋转蒸发器 上海亚荣生化仪器厂;Nicolet5700傅里叶红外光谱仪 美国Thermo公司。
1.3 试验方法
1.3.1 羊肚菌多糖的制备
取65 ℃下烘干羊肚菌实体进行粉碎并过40目筛,按照1∶10的比例加入蒸馏水混合搅拌,超声波功率为400 W,55 ℃提取45 min。提取液4 ℃静置12 h后经过滤,离心得上清液。上清液水浴浓缩后,Sevag法离心除蛋白。上清液按6倍量加入无水乙醇,-20 ℃静置12 h。收集沉淀,真空冷冻干燥后得到羊肚菌多糖。
1.3.2 羊肚菌多糖改性物制备
1.3.2.1 盐酸水解法制备羊肚菌多糖改性物
称取羊肚菌多糖0.1 g,加入2 mol/L盐酸溶液10 mL,90 ℃保温3 h。氢氧化钠调pH至中性。浓缩后经真空冷冻干燥得改性产物。
1.3.2.2 过氧化氢氧化降解法制备羊肚菌多糖改性物
称取羊肚菌多糖1 g,加入5 mL过氧化氢后用蒸馏水定容至25 mL,40 ℃水浴保温3 h。浓缩后经真空冷冻干燥得改性产物。
1.3.2.3α-淀粉酶酶解法制备羊肚菌多糖改性物
称取羊肚菌多糖1 g,加入40 U/mL、pH6的α-淀粉酶25 mL,50 ℃水浴保温15 min。浓缩后经真空冷冻干燥得改性产物。
1.3.2.4 乙酰化法制备羊肚菌多糖改性物
称取羊肚菌多糖1 g,加入30 mL蒸馏水,用1 mol/L氢氧化钠调至pH9,按照料液比1∶4加入乙酸酐,50 ℃水浴保温1 h。用1 mol/L氢氧化钠调pH至中性。浓缩后经真空冷冻干燥得改性产物。
1.3.2.5 硫酸化法制备羊肚菌多糖改性物
称取羊肚菌多糖1 g,按照料液比1∶8(g/mL)加入浓硫酸,继续加入0.1 g硫酸铵,正丁醇2.5 mL,放入冰水浴中反应1 h。用1 mol/L氢氧化钠调pH至中性。浓缩后经真空冷冻干燥得改性产物。
1.3.2.6 超声波法制备羊肚菌多糖改性物
称取羊肚菌多糖1 g,按照料液比1∶50加入蒸馏水,超声功率300 W,温度90 ℃, 超声时间20 min。浓缩后经真空冷冻干燥得改性产物。
1.3.3 糖苷酶抑制率的测定
1.3.3.1α-淀粉酶抑制率的测定
样品溶液的配制:取0.2 g样品加入蒸馏水配制成浓度为40 mg/L样品溶液。
α-淀粉酶抑制率的测定参照文献[13]略加改动。加入2%淀粉溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL、40 mg/L样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,再在空白管和抑制剂管加入0.5 mL、20 U/mLα-淀粉酶,对照管加入0.5 mL蒸馏水。置于37 ℃水浴中反应10 min后,加入1.0 mL DNS,再放入沸水浴中反应5 min,加入10.0 mL蒸馏水,冷却至室温,于540 nm处测其吸光值,得A。
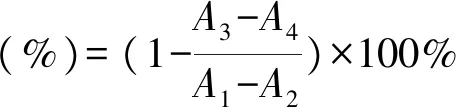
式中,Α1、Α2、Α3和Α4分别为540 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.3.3.2 麦芽糖酶抑制率的测定方法
麦芽糖酶抑制率的测定参照文献[14]略加改动。加入2%麦芽糖溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL、40 mg/L样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,再在空白管和抑制剂管加入0.5 mL、20 U/mL麦芽糖酶,对照管加入0.5 mL蒸馏水。置于37 ℃水浴中反应10 min后,加入1.0 mL DNS,于沸水浴中反应5 min,加入10.0 mL蒸馏水,冷却至室温,于405 nm处测定吸光值,得A。
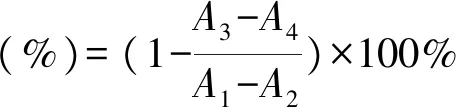
式中,Α1、Α2、Α3和Α4分别为为405 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.3.3.3 α-葡萄糖苷酶抑制率的测定方法
α-葡萄糖苷酶抑制率的测参照文献[15]略加改动。加入4-硝基苯基-α-D吡喃半乳糖苷(PNPG)溶液2.0 mL,在抑制管和抑制对照管中加入1.0 mL、40 mg/L的样品溶液,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,再加入2.0 mL磷酸盐缓冲溶液。置于37 ℃水浴中保温10 min,在空白管以及抑制管加入1.0 mL、20 U/mLα-葡萄糖苷酶,在对照管加入1.0 mL蒸馏水。再次放入37 ℃水浴中保温15 min,加入5.0 mL碳酸钠溶液终止试验。冷却至室温,于405 nm处测得吸光值,得A。
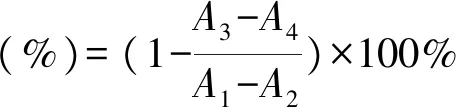
式中,Α1、Α2、Α3和Α4分别为405 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.3.3.4 蔗糖酶抑制率的测定方法
蔗糖酶抑制率的测定参照文献[16]略加改动。加入2%蔗糖溶液0.5 mL,在抑制管和抑制对照管中加入1.0 mL、40 mg/L抑制剂,在空白管和空白对照管中加入1.0 mL蒸馏水进行对照,再在空白管和抑制剂管加入0.5 mL、20 U/mL蔗糖酶,对照管加入0.5 mL蒸馏水。置于37 ℃水浴中反应10 min后,加入1.0 mL 3,5-二硝基水杨酸(DNS),于沸水浴中反应5 min,加入10.0 mL蒸馏水,冷却至室温,于550 nm处测定吸光值,得A。
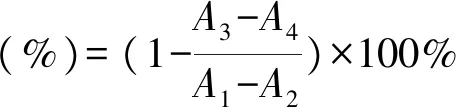
式中,Α1、Α2、Α3和Α4分别为550 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
1.4 傅里叶变换红外光谱分析
将样品磨成粉末,与溴化钾混合后一起压片,得到均匀的薄片进行测试。扫描范围为4 000~500 cm-1。
1.5 单因素试验
1.5.1 时间对改性产物α-淀粉酶抑制率的影响
称取1 g样品加入5 mL、30%过氧化氢溶液,加入pH7的磷酸盐缓冲溶液定容至25 mL,在40 ℃下分别反应0.5、1.0、1.5、2.0、2.5、3 h。浓缩后经真空冷冻干燥得改性产物。
1.5.2 料液比对改性产物α-淀粉酶抑制率的影响
称取1 g样品,按料液比1∶1、1∶3、1∶5、1∶7、1∶9、1∶11和1∶13加入30%过氧化氢溶液,加入pH7的磷酸盐缓冲溶液定容至25 mL,在40 ℃下反应3 h。浓缩后经真空冷冻干燥得改性产物。
1.5.3 反应温度对改性产物α-淀粉酶抑制率的影响
称取1 g样品,加入料液比为1∶9的30%过氧化氢溶液,加入pH7的磷酸盐缓冲溶液定容至25 mL,在20、30、40、50、60 ℃条件下,反应3 h。浓缩后经真空冷冻干燥得改性产物。
1.5.4 pH对改性产物α-淀粉酶抑制率的影响
称取1 g样品,加入料液比为1∶9的30%过氧化氢溶液溶解样品,加入pH分别为5、6、7、8、9的磷酸盐缓冲溶液定容至25 mL,在50 ℃下反应3 h。浓缩后经真空冷冻干燥得改性产物。
1.6 响应面试验
综合单因素试验结果,采用Design-expert进行试验设计和分析。以α-淀粉酶抑制率为衡量指标,响应面试验因素水平如表2所示,表2中时间、料液比、温度、pH四因素分别对应试验因素中的A、B、C、D。
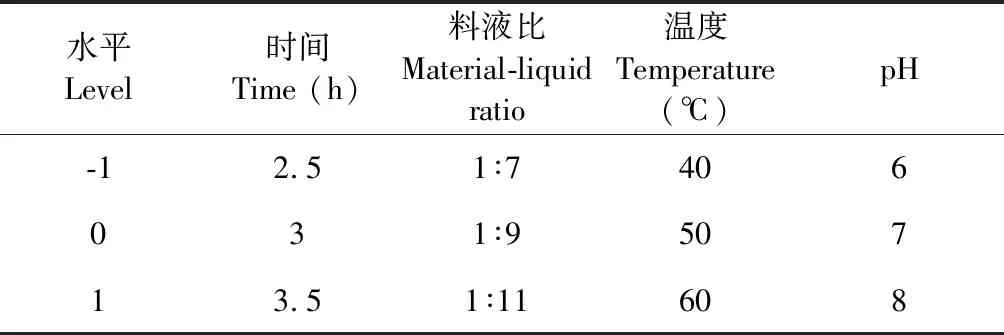
表2 响应面试验因素水平表 Table 2 Factor level of response surface experiments
2 结果与讨论
2.1 羊肚菌多糖改性方法筛选
不同改性方法对α-淀粉酶抑制率的影响见图1。由图1可知,盐酸水解法、过氧化氢氧化降解法、α-淀粉酶酶解法、乙酰化法以及超声波法均能提高羊肚菌多糖改性产物的α-淀粉酶抑制率,而采用浓硫酸处理则没有效果。研究表明多糖的生物活性与其糖苷键的类型、相对分子量、空间结构有很大的关联性[9]。用盐酸、过氧化氢以及α-淀粉酶处理羊肚菌多糖,可使其发生降解,降低了多糖分子量,这可能有助于提升对α-淀粉酶的抑制能力。乙酰化则是在多糖酚羟基中引入乙酰基,改变多糖的空间结构。而超声波能够破坏空间结构,降解大分子物质,降低分子量[17]。硫酸化处理羊肚菌多糖,其改性产物对α-淀粉酶的抑制能力有所下降,这可能是浓硫酸使得多糖发生碳化和氧化[18]。在六种改性方法中,过氧化氢法制备羊肚菌多糖改性产物对α-淀粉酶抑制率提升效果最高,在试验条件下可提高约14倍,故选择过氧化氢法氧化降解羊肚菌多糖。
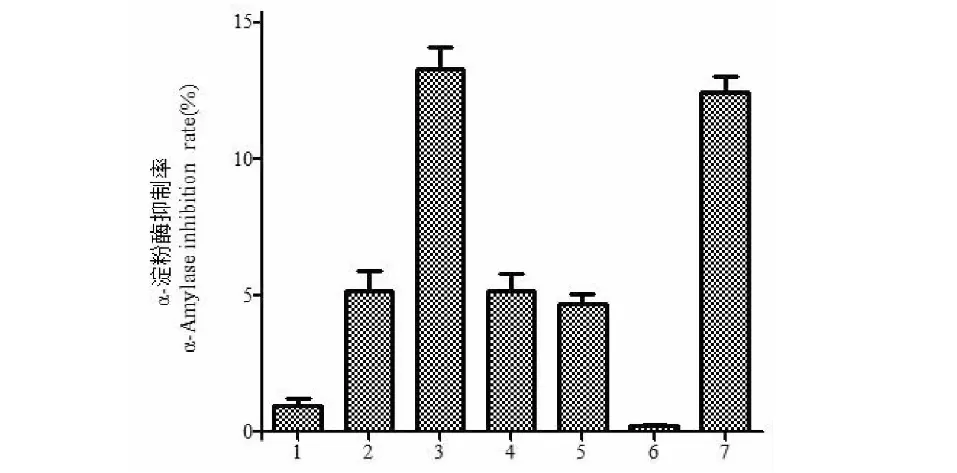
图1 不同改性方法的影响Fig.1 Effect of different modification method of Morchella polysaccharide 注:图中横坐标1表示羊肚菌多糖初始α-淀粉酶抑制率, 2-7分别表示羊肚菌多糖经盐酸水解、过氧化氢氧化降解、α-淀粉酶酶解、乙酰化、硫酸化以及超声波处理后的改性产物对α-淀粉酶的抑制率。Note:Number 1 of abscissa indicates the initial α-amylase inhibition rate of Morchella polysaccharides,and number 2-7 indicates α-amylase inhibition rate of the Morchella polysaccharides modified product by hydrochloric acid,hydroperoxide degradation,α-amylase enzymatic hydrolysis,acetylation,sulfation and ultrasonic treatment.
2.2 单因素试验结果分析
2.2.1 反应时间对改性产物α-淀粉酶抑制率的影响
反应时间对羊肚菌多糖改性产物α-淀粉酶抑制率的影响见图2。由图2可知,随着反应时间的延长,羊肚菌多糖改性产物对α-淀粉酶的抑制率逐渐升高,当反应时间为3 h时抑制率达到最大。超过3 h后,继续延长时间则抑制率趋于平缓。
2.2.2 料液比对改性产物α-淀粉酶抑制率的影响
料液比对羊肚菌多糖改性产物α-淀粉酶抑制
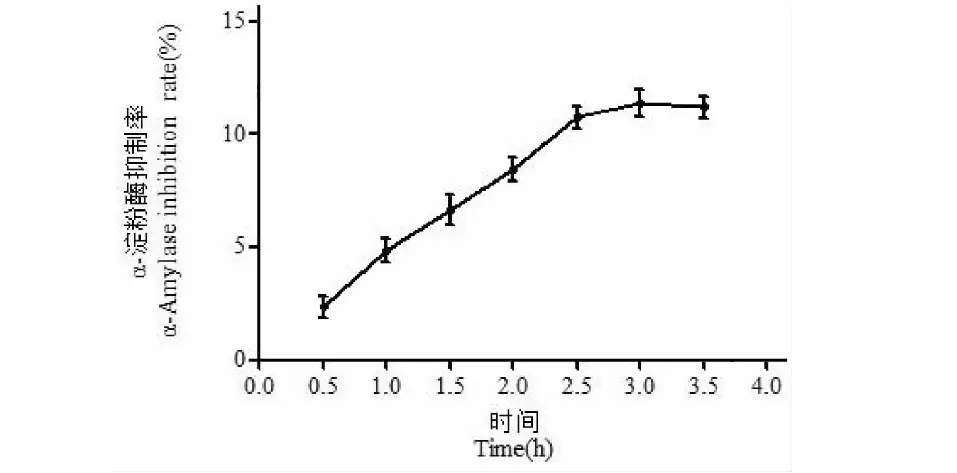
图2 反应时间对α-淀粉酶抑制率的影响Fig.2 Effect of reaction time on inhibition rate of α-amylase
率的影响见图3。由图3可知,随着料液比的逐渐增加,羊肚菌多糖改性产物的α-淀粉酶抑制率先升高后降低,当料液比为1∶9时抑制率达到最大。过氧化氢量越多,会提供更多的羟基自由基,多糖的降解程度就越大。同时过氧化氢的过度氧化作用会使C-O-C发生断裂,使得分子量进一步降低,从而导致α-淀粉酶抑制率降低[19]。
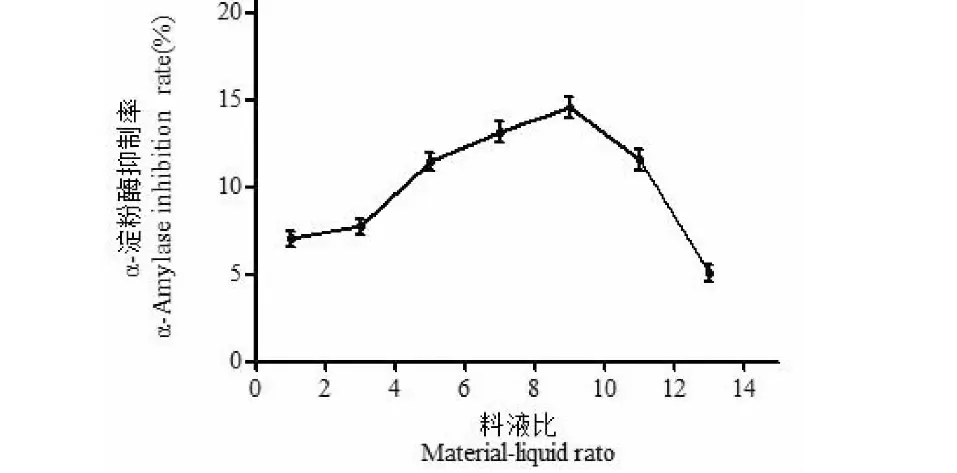
图3 料液比对α-淀粉酶抑制率的影响Fig.3 Effect of material-liquid ratio on inhibition rate of α-amylase
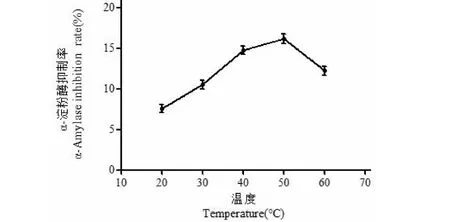
图4 反应温度对α-淀粉酶抑制率的影响Fig.4 Effect of reaction temperature on inhibition rate of α-amylase
2.2.3 反应温度对改性产物α-淀粉酶抑制率的影响
反应温度对羊肚菌多糖改性产物α-淀粉酶抑制率的影响见图4。由图4可知,随着温度的逐渐升高,羊肚菌多糖改性产物的α-淀粉酶抑制率出现先增大后减小,在50 ℃条件下抑制率达到最大。这可能是由于过氧化氢不稳定,高温下易降解,从而降低了氧化能力。
2.2.4 pH对改性产物α-淀粉酶抑制率的影响
pH对羊肚菌多糖改性产物α-淀粉酶抑制率的影响见图5。由图5可知,随着pH的逐渐升高,羊肚菌多糖改性产物的α-淀粉酶抑制率先升高后降低,pH7时抑制率最大。过氧化氢虽然在酸性条件下显示出更强的氧化性,但是过度的氧化可能会导致羊肚菌多糖改性物的分子量进一步变化,同时其羟基氧化成羧基的可能性也大大增强。在碱性环境下会降低其稳定性,并且抑制过氧化氢的氧化性,从而降低了改性产物的α-淀粉酶抑制能力。
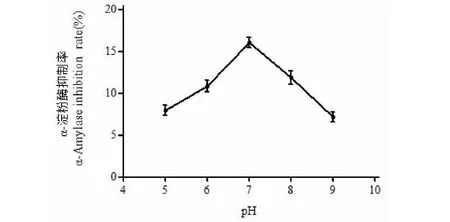
图5 pH对α-淀粉酶抑制率的影响Fig.5 Effect of pH on the inhibitory rate of α-amylase
2.3 响应面试验设计结果及分析
羊肚菌多糖改性响应面试验设计及结果见表3。
表3 响应面试验设计及结果 Table 3 Response experimental results
续表3(Continued Tab.3)
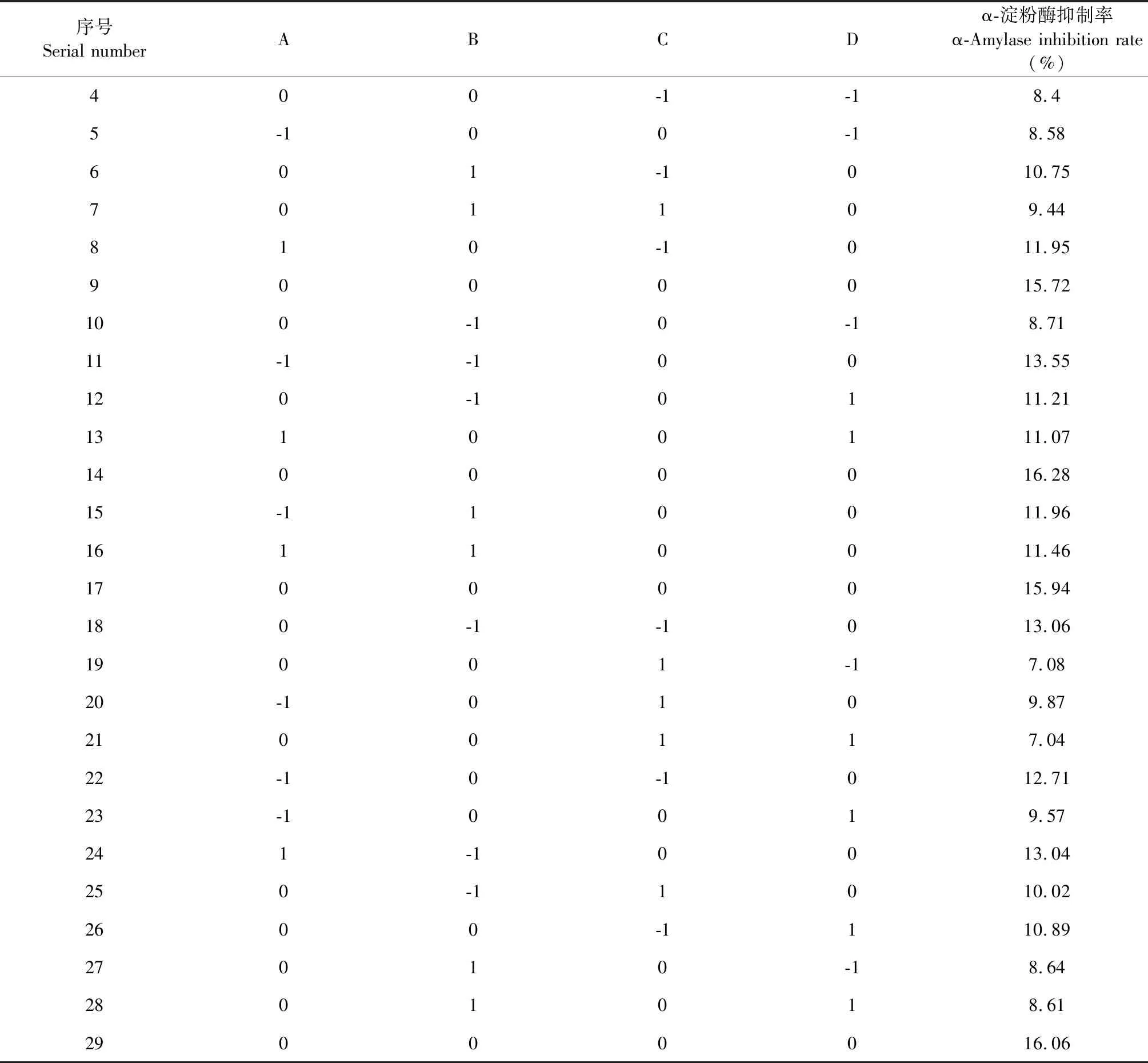
序号Serial numberABCDα-淀粉酶抑制率α-Amylase inhibition rate(%)400-1-18.45-100-18.58601-1010.75701109.44810-1011.959000015.72100-10-18.7111-1-10013.55120-10111.2113100111.0714000016.2815-110011.9616110011.4617000015.94180-1-1013.0619001-17.0820-10109.872100117.0422-10-1012.7123-10019.57241-10013.04250-11010.022600-1110.8927010-18.642801018.6129000016.06
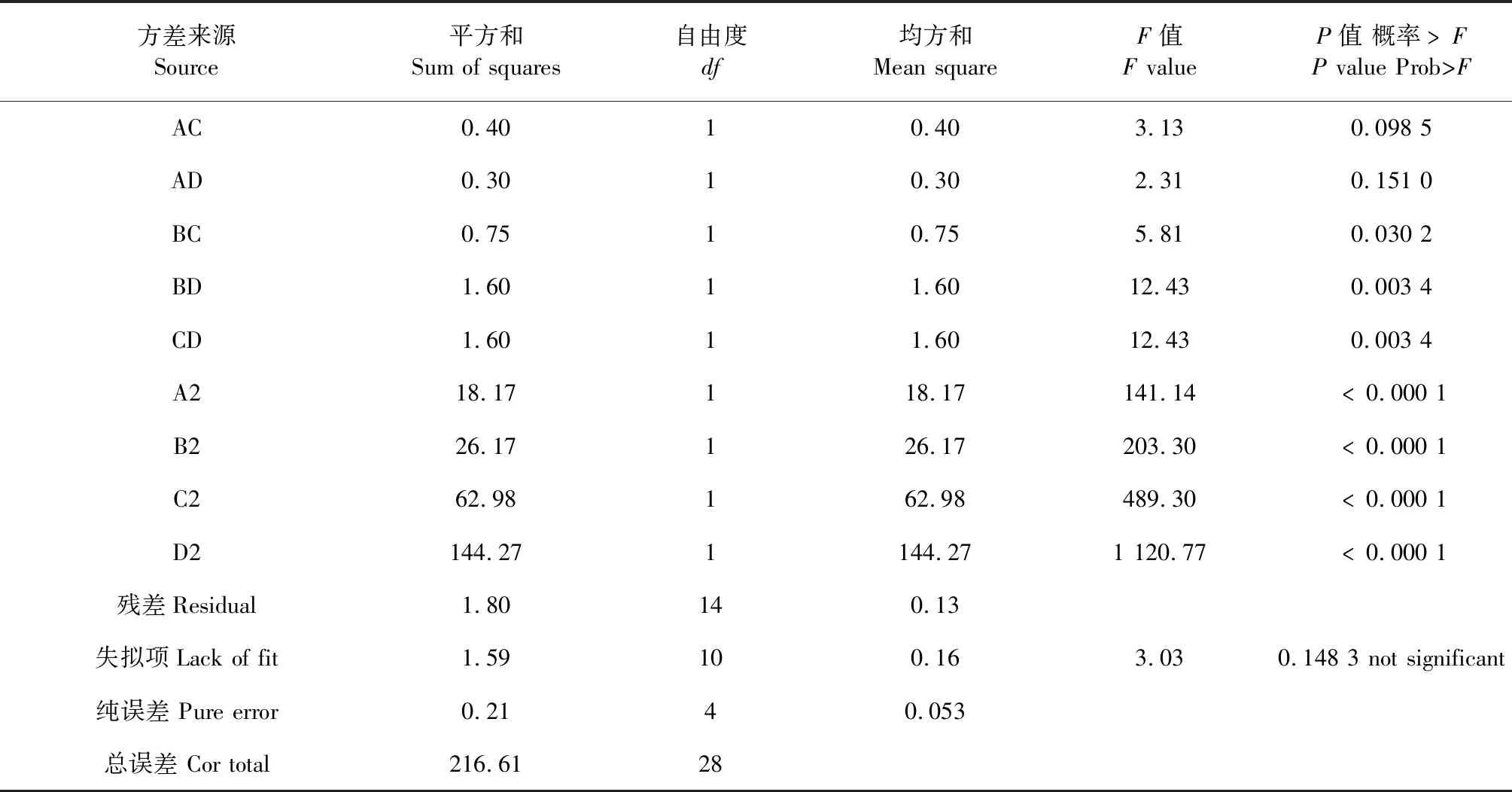
2.3.1 方差分析
运用Design-Expert V8.0软件对表3响应面试验数据进行方差分析,结果见表4和表5。
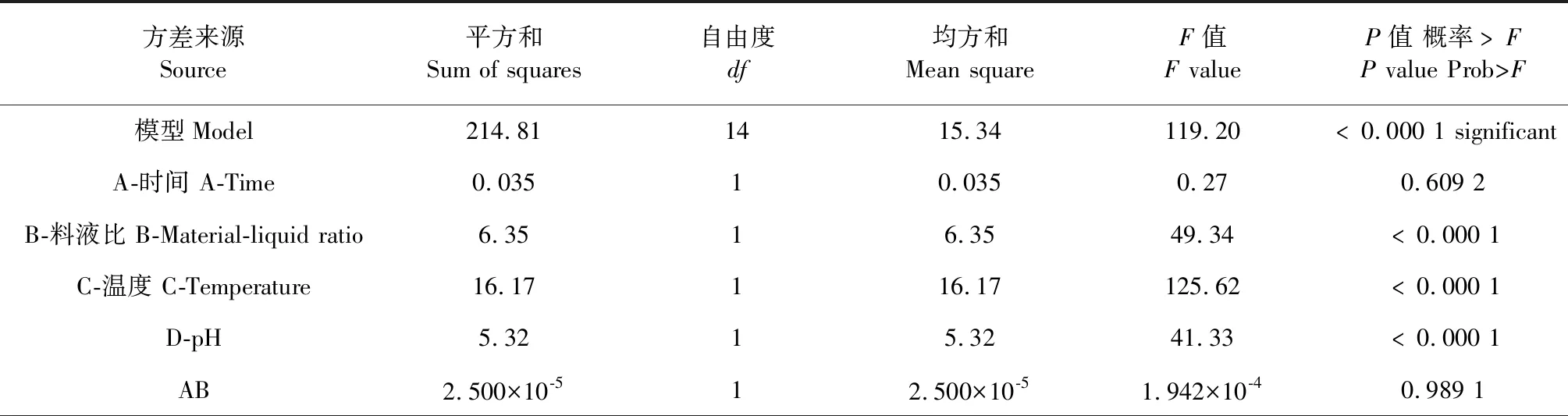
表4 响应面二次模型方差分析 Table 4 Response surface quadratic model analysis of variance
续表4(Continued Tab.4)
方差来源Source平方和Sum of squares自由度df均方和Mean squareF值F valueP值 概率﹥FP value Prob>FAC0.4010.403.130.098 5AD0.3010.302.310.151 0BC0.7510.755.810.030 2BD1.6011.6012.430.003 4CD1.6011.6012.430.003 4A218.17118.17141.14﹤0.000 1B226.17126.17203.30﹤0.000 1C262.98162.98489.30﹤0.000 1D2144.271144.271 120.77﹤0.000 1残差Residual1.80140.13失拟项Lack of fit1.59100.163.030.148 3 not significant纯误差 Pure error0.2140.053总误差 Cor total216.6128
从表4所示的方差分析来看,所选择的模型显著(P<0.05),失拟项为不显著(P>0.05),即所选择的模型可靠。在时间、料液比、温度以及pH四个因素中,料液比、温度以及pH的影响皆显著。此外,这四个因素对羊肚菌多糖改性产物的α-淀粉酶抑制率的影响亦非简单的线性关系。各个因素之间的交互影响表现为显著的有料液比-温度、料液比-pH、温度-pH。
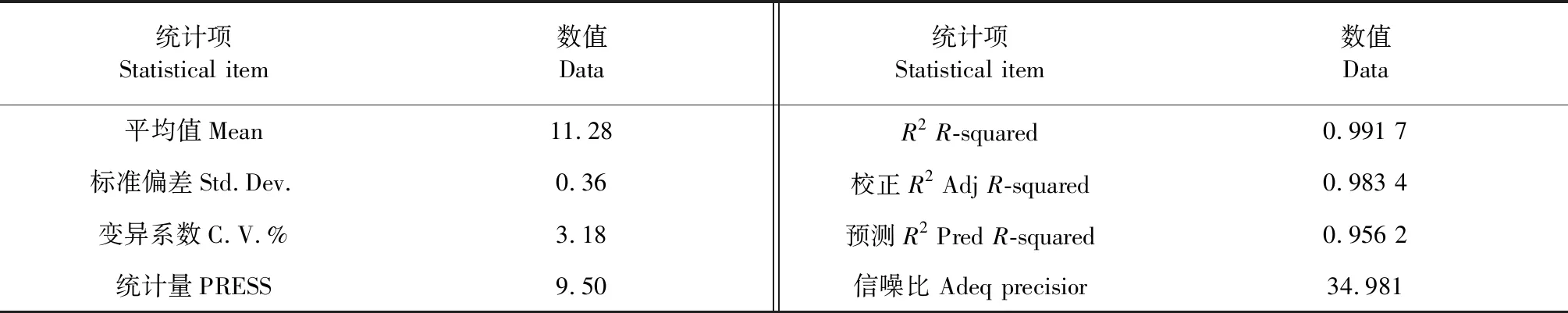
表5 R2综合分析表 Table 5 Analysis of R-squared
从表5可以看出,模型的R2=0.991 7,校正R2=0.983 4,预测R2和校正R2较为接近,信噪比为34.981(﹥4),可知回归方程拟合度和可信度均很高,试验误差较小,故可用此模型对多糖改性的工艺条件进行优化和预测。
利用Design Expert V8.0软件对表5所得试验数据进行多元回归拟合分析,获得改性多糖的多元二次回归方程模型为:α-淀粉酶抑制率=16.05+0.054×A-0.73×B-1.16×C+0.67×D+2.500×10-3×A×B+0.32×A×C+0.27×A×D+0.43×B×C-0.63×B×D-0.63×C×D-1.67×A2-2.01×B2-3.12×C2-4.72×D2。
2.3.2 响应曲面图及其等高线图
根据回归方程,考察两两因素之间的交互作用对α-淀粉酶抑制率的影响,可得一组等高线图及其响应曲面图(图6~图8),从而确定因素的最佳水平范围,结果选择影响显著的BC、BD和CD加以说明。
2.3.2.1 料液比-温度对α-淀粉酶抑制率的交互影响
图6为料液比-温度对改性多糖α-淀粉酶抑制率的等高线图及其响应曲面图。当时间和pH为最佳值时,随着料液比和温度的增加,改性多糖的α-淀粉酶抑制率均出现显著的变化,抑制能力先增大后减小。由图可以确定最佳水平范围料液比在7.92~9.28之间,温度在45.21~50.42 ℃之间。
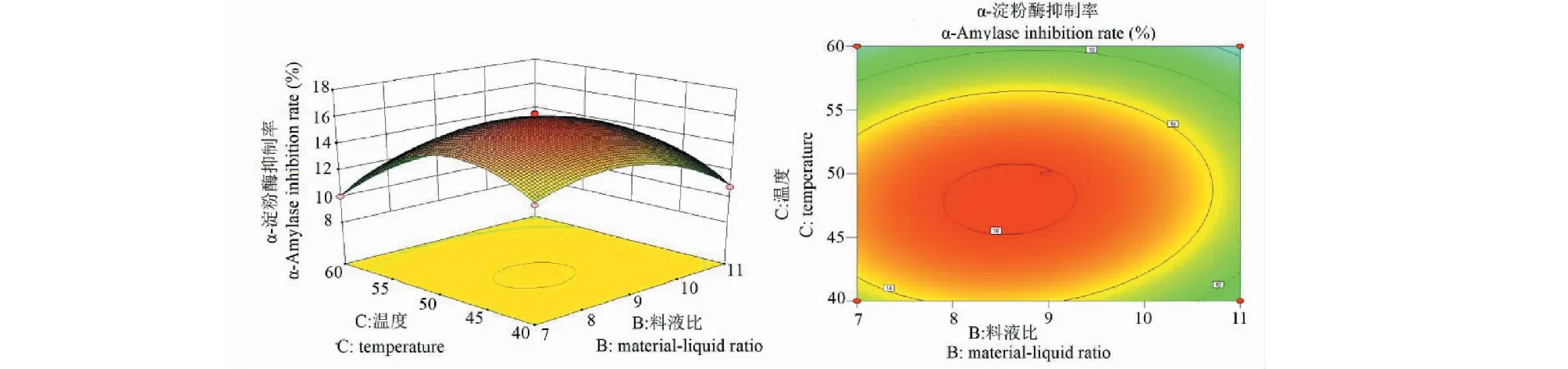
图6 料液比-温度对α-淀粉酶抑制率的响应曲面图(左)和等高线图(右)Fig.6 Response of material-liquid ratio-to-temperature to α-amylase inhibition rate surface plot (left) and contour plot (right)
2.3.2.2 料液比-pH对α-淀粉酶抑制率的交互影响
图7为料液比-pH对改性多糖α-淀粉酶抑制率的等高线图及其响应曲面图。当反应时间和反应温度为最佳值时,随着料液比和pH的增加,改性多糖的α-淀粉酶抑制率均出现显著的变化,抑制能力先增大后减小。由图可知,最佳料液比在8.06~9.14之间,pH在6.86~7.25之间。

图7 料液比-pH对α-淀粉酶抑制率的响应曲面图(左)和等高线图(右)Fig.7 Response of material-liquid ratio-to-pH to α-amylase inhibition rate surface plot (left) and contour plot (right)
2.3.2.3 温度-pH对α-淀粉酶抑制率的交互影响
图8为温度-pH对改性多糖α-淀粉酶抑制率的等高线图及其响应曲面图。当反应时间和料液比为最佳值时,随着温度和pH的增加,改性多糖的α-淀粉酶抑制率均出现显著的变化,抑制能力先增大后减小。由图可以确定最佳温度在45.55~50.55 ℃之间,pH在6.83~7.29之间。
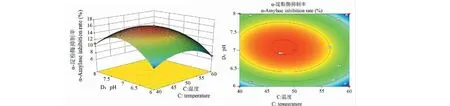
图8 温度-pH对α-淀粉酶抑制率的响应曲面图(左)和等高线图(右)Fig.8 Response of temperature-to-pH to α-amylase inhibition rate surface plot (left) and contour plot (right)
2.3.3 最优条件预测
通过软件对数据进一步分析得出模型理论最佳条件为料液比为1∶8.55、pH7.09、温度为47.8 ℃、时间为3.02 h,按最优条件进行试验验证,重复测定三次所得羊肚菌改性产物的α-淀粉酶抑制率为16.30%,与模型预测结果的相对误差为0.11%,两值相近,说明此模型预测数据可靠。
2.4 改性前后对糖苷酶抑制率的比较
改性前后对糖苷酶抑制率的比较见图9。由图9可知,利用过氧化氢氧化法对羊肚菌多糖进行改性,改性羊肚菌多糖α-淀粉酶抑制率有显著提高(P﹤0.05)。改性后与改性前相比,α-淀粉酶抑制率提高了17.16倍。蔗糖酶抑制率由72.08%提高到78.13%,麦芽糖酶抑制率由10.05%提高到16.48%,α-葡萄糖苷酶由17.54%提高到21.40%。改性产物与同浓度下的阿卡波糖相比,α-淀粉酶抑制率提高了1.44倍,蔗糖酶抑制率与阿卡波糖无明显差异(P>0.05),麦芽糖酶抑制率提高了1.63倍,α-葡萄糖苷酶抑制率提高了1.88倍。

图9 改性前后糖苷酶抑制率的比较Fig.9 Comparison of inhibition rate of glycosidase before and after modification 注:图中横坐标1~4分别表示α-淀粉酶抑制率、蔗糖酶抑制率、麦芽糖酶抑制率以及α-葡萄糖苷酶抑制率。Note:Number 1-4 of abscissa indicates the α-amylase inhibition rate,sucrase inhibition rate,maltase inhibition rate and α-glucosidase inhibition rate.
2.5 改性前后样品表征
羊肚菌多糖改性前后的傅里叶红外光谱图见图10。分析图谱可以看出,羊肚菌多糖经过氧化氢改性前后的红外图谱基本吻合,官能团种类基本没有发生变化,呈现明显的多糖吸收特征。说明羊肚菌多糖经过氧化氢氧化降解后,化学结构单元不发生变化,仅糖苷键发生断键,分子量降低。在3 420cm-1处出现-OH伸缩振动吸收峰,2 928 cm-1为C-H伸缩振动吸收峰,1 635 cm-1处出现-OH弯曲振动吸收峰,1 410 cm-1处出现=CH2的变形吸收峰,1 152 cm-1处出现环上C-O吸收峰,1 078 cm-1处醇羟基的变角振动峰,1 026 cm-1处出现了糖环C-O-C吸收峰。926 cm-1处出现了呋喃环的对称伸缩振动吸收峰,说明羊肚菌多糖及其氧化改性物中有呋喃糖环结构。
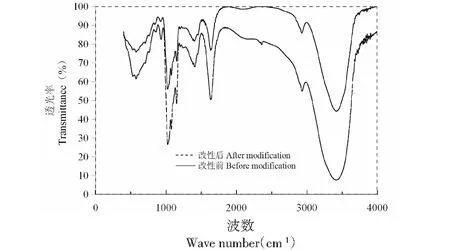
图10 改性前后样品傅里叶变换红外光谱分析Fig.10 FT-IR chromatographic before and after modification
3 结论
本文采用过氧化氢氧化降解法对羊肚菌多糖进行改性,考察了四个因素(反应温度、反应时间、料液比、pH)对改性产物α-淀粉酶抑制率的影响。利用响应面法设计正交试验,建立了四个因素相互作用的数学预测模型,预测模型表明,料液比1∶8.55、pH7.09、温度47.8 ℃、时间3.02 h为最佳反应条件。试验所得改性多糖α-淀粉酶抑制率为16.30%,与模型预测结果的相对误差为0.11%,比改性前提高了17.16倍,蔗糖酶抑制率提高了1.07倍,麦芽糖酶抑制率提高了1.64倍,α-葡萄糖苷酶抑制率提高了1.22倍。与常用的降糖药阿卡波糖相比,羊肚菌多糖改性产物的α-淀粉酶抑制率、麦芽糖酶抑制率、α-葡萄糖苷酶抑制率分别提高了1.44、1.63和1.88倍。
多糖类化合物是由至少超过十个的单糖组成的聚合糖高分子碳水化合物,其糖苷酶抑制率与化合物的结构有一定的关系。目前虽然有一些关于羊肚菌多糖的化学改性研究,如Chen[11]曾利用乙酸酐法、氯磺酸-吡啶法以及硫酸化法等化学改性法对羊肚菌多糖改性后的抗肿瘤、抗氧化等活性进行了比较。但是鲜有文献对羊肚菌多糖改性产物进行深一步的体外降血糖研究。氧化是多糖的化学改性中最为简单和广泛的方法之一,其降解原理是打断多糖分子内的糖苷键,从而使大分子变成小分子多糖。以无副产物、无毒害作用的过氧化氢氧化降解法开发得最多[20]。同时,过氧化氢氧化改性较硫酸化法等化学改性操作更为简便,更为高效,并且不产生任何有毒有害的副产物,绿色环保,因此在生产中可以得到有效利用。本文优化过氧化氢氧化降解羊肚菌多糖工艺条件,进一步提升羊肚菌多糖对糖苷酶的抑制能力,为降糖药的开发利用提供参考依据。

