喜树碱衍生物NCP4在不同种属肝微粒体中代谢稳定性研究
刘琼艳,张美琴,2,卿 晨*,李 霁*
1昆明医科大学药学院暨云南省天然药物药理重点实验室,昆明 650500;2云南新兴职业学院,昆明 650501
喜树碱是从中国珙桐科植物中提取的一种生物碱,具有显著的体内外抗肿瘤活性。机制研究发现,细胞DNA拓扑异构酶I (topoisomerase,Top1)是其主要的作用靶点。但在临床试验中发现,喜树碱类化合物对肿瘤患者的疗效与在啮齿类动物模型的效果有很大差异,同时病人伴随严重的毒副反应,如膀胱出血、骨髓抑制等,使其在临床的应用受到很大限制[1]。究其原因是因为人体血液与啮齿类动物血液的pH值存在较大差异,后者使得喜树碱化学结构中E环的内酯结构保持在闭环,而此结构状态是其抗肿瘤活性所必需。而人血液的pH值却使喜树碱结构中的内酯环(E环)打开,成为其在临床应用中活性下降、毒性增加的主要原因。
因此,对喜树碱结构进行改造优化一直是喜树碱类抗肿瘤药的研究热点。目前临床应用的喜树碱类抗癌药有拓扑替康[2,3]、伊立替康[4]和10-羟基喜树碱[5],此外尚有若干喜树碱类衍生物处在临床前研究和临床研究的不同阶段,如9-硝基喜树碱(9-NC)已完成了胰腺癌的Ⅲ期临床研究[6,8],但也由于其严重的毒副反应而终止。
化合物 NCP4是在9-NC分子的20(S) 羟基位引入碳酸酯结构[9],旨在降低其开环速度,以达到提高抗肿瘤活性、改善溶解度并降低毒性的目的。我们前期的体内外实验研究表明,NCP4对肿瘤的生长具有显著的抑制作用,毒性显著低于9-NC。但对化合物NCP4的稳定性和代谢方面的研究尚未进行。
对候选化合物代谢的研究是药物研发的重要内容。肝脏是药物代谢的主要场所,拥有细胞色素P450等多种代谢酶。这些代谢酶主要存在于肝微粒体中,决定药物代谢途径、代谢速率,与药物清除率直接相关[10,11]。采用体外肝微粒体温孵系统进行代谢研究,不仅可排除体内诸多因素的干扰,还具有反应干扰小、操作简单、代谢条件易于控制等优点。同时,体外代谢还能迅速有效地解决药物代谢中的关键问题,例如代谢物结构鉴定、代谢途径推断等,为体内代谢研究提供重要的线索和依据[12]。
为此,本研究选择人、SD大鼠、beagle犬的体外肝微粒体温孵体系,建立HPLC-UV-MS(Q-TOF)定性分析方法,寻找化合物NCP4的代谢产物,探讨NCP4体外代谢动力学特征,考察NCP4在不同种属间代谢的差异,为NCP4相关药理学、毒理学及药动学的研究寻找合适的动物模型,提供科学依据。
1 仪器与试剂
1.1 仪器
3-18KS台式低温离心机;YCD-EL259冰箱(合肥美菱股份有限公司);VCX150氮气吹干仪(昆明鹏翼达气体产品有限公司);HPLC-UV-MS(Q-TOF)(安捷伦科技有限公司)
1.2 试剂
SD大鼠肝微粒体、beagle犬肝微粒体以及人肝微粒体蛋白浓度为20 mg/mL,购自瑞德肝脏疾病研究有限公司,磷酸缓冲液(PBS)购自Therno公司,NADPH系统购自Sigma公司,叔丁基甲基醚、甲醇(批号151130)、色谱纯乙腈购自德国Merck公司,色谱纯乙酸铵购自美国Tedia公司,色谱纯甲酸购自德国Fluka公司,大鼠和人血浆由本实验室自采。
2 方法
2.1 孵育混合液的组成
SD大鼠孵育混合液:100 mM的PBS(pH7.4),SD大鼠肝微粒体蛋白(终浓度为0.5 mg/mL),化合物NCP4(终浓度为5 μg/mL)。
beagle犬孵育混合液:100 mM的PBS(pH7.4),Beagle犬肝微粒体蛋白(终浓度为0.5 mg/mL),化合物NCP4(终浓度为5 μg/mL)。
人孵育混合液:100 mM的PBS(pH7.4),人肝微粒体蛋白(终浓度为0.5 mg/mL),化合物NCP4(终浓度为5 μg/mL)。
2.2 试验方法
分别取180 μL的孵育液,在37 ℃恒温水浴箱中预孵育5 min,然后加入20 μL NADPH(终浓度1 mM)启动反应,孵育完毕后使用0.8 mL的冰乙腈终止反应。
选取0、2、5、10、15、30、60、90、120 min的孵育样品作为不同种属肝微粒体孵育反应的研究对象,按照各样品的时间要求进行温孵。
0 min是在180 μL孵育液中先加入0.8 mL冰乙腈终止反应后,再加入20 μL 的NADPH液。空白基质样品是取不含药的孵育液,加入20 μL 的NADPH液,再加入0.8 mL冰乙腈沉淀蛋白。终止反应后的样品及空白基质加叔丁基甲基醚1 mL在7 155×g离心10 min,取上清液0.8 mL,氮气吹干,采用100 μL 90%甲醇复溶,涡旋3 min后离心取上清液进行HPLC-UV(Q-TOF)分析。比较NCP4在SD大鼠、Beagle犬、人肝微粒体中的温孵结果,分析其代谢产物。
2.3 色谱及质谱条件
色谱条件:Diamonsil C18(4.6×150 mm,5 μm);流动相:水:甲醇(30∶70)等度洗脱;柱温:25 ℃,流速:0.5 mL/min;紫外检测波长370 nm;进样量20 μL,分析时间23 min。
质谱条件:本实验选择ESI正离子模式、全扫描方式(m/z100~1 000),雾化气压35 psi,干燥气流速9 mL/min,离子化电压为3 500 V,碎片电压175 V。
2.4 数据分析计算公式及相关参数
实验选用SD大鼠、beagle犬、人等三个种属的肝微粒生物基质对NCP4进行体外温孵,采用高效液相色谱法对NCP4的剩余量进行测定,并且计算相关的代谢动力学参数。
肝微粒体代谢稳定性相应的参数估算公式如下:
T1/2=0.693/k
(1)
CHint=0.693/T1/2×[Incubation(mL)/Microsomes(mg)]×[Microsomes(mg)/Liver(g)]×[Liver(g)/BW(kg)]
(2)
CLh=(Qh×CLint)/(Qh×CLint)
(3)
公式(2)和公式(3)中各参数均为经验值,相关数值经参考文献总结见表1。
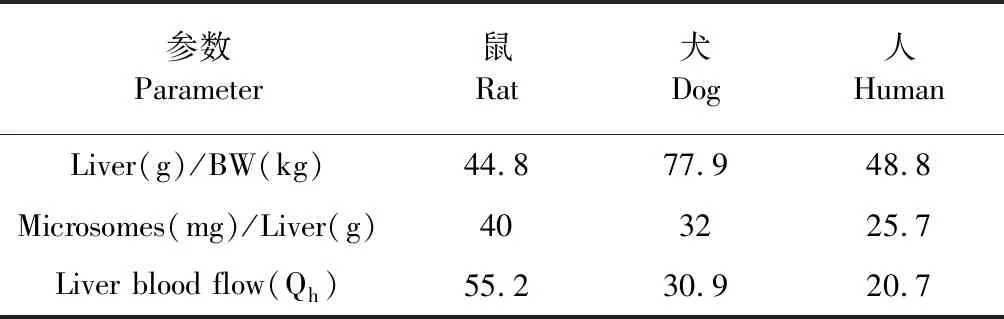
表1 肝微粒体生化参数经验值Table 1 The empirical values of liver microsomes biochemical parameters
3 结果
3.1 NCP4分别在不同种属肝微粒体中的代谢稳定性及动力学参数
3.1.1 NCP4在SD大鼠肝微粒体样品中的体外代谢稳定性
将NCP4在0 min时的峰面积作为100%,其他时间点与0 min时间点的峰面积相比得到NCP4的剩余百分比(area%),结果见表2,可以看出NCP4在60 min内代谢完全。将各时间点NCP4的剩余百分比的自然对数与相应的孵育时间进行线性回归,求得斜率(-k),线性关系良好的ln(area%)与孵育时间计算结果见图1。回归方程:y=-0.132 9x+4.718 6,R2=0.994 8,说明NCP4在鼠肝微粒体孵育体系中0~30 min时间范围内呈现线性消除。由公式(1)-(3)计算NCP4在SD大鼠肝微粒体中的半衰期Tl/2(min)、肝固有清除率CLint(mL/min/kg)和肝清除率CLh(mL/min/kg)分别为5.21 min、11.91 mL/min/kg和9.80 mL/min/kg。
3.1.2 NCP4在beagle犬肝微粒体样品中的体外代谢稳定性
NCP4在0 min时的峰面积作为100%,其他时间点与0 min时间点的峰面积相比得到NCP4的剩余百分比(area%),结果见表3,可以看出NCP4在90 min内代谢完全。将各时间点NCP4的剩余百分比的自然对数与相应的孵育时间进行线性回归,求得斜率(-k),线性关系良好的ln(area%)与孵育时间计算结果见图2。回归方程:y=-0.062 2x+4.474 9,R2=0.994 3,说明NCP4在狗肝微粒体孵育体系中0~60 min时间范围内呈现线性消除。由公式(1)~(3)计算NCP4在狗肝微粒体中的半衰期Tl/2(min)、肝固有清除率CLint(mL/min/kg)和肝清除率CLh(mL/min/kg)分别为11.1 min、7.78 mL/min/kg和6.22 mL/min/kg。
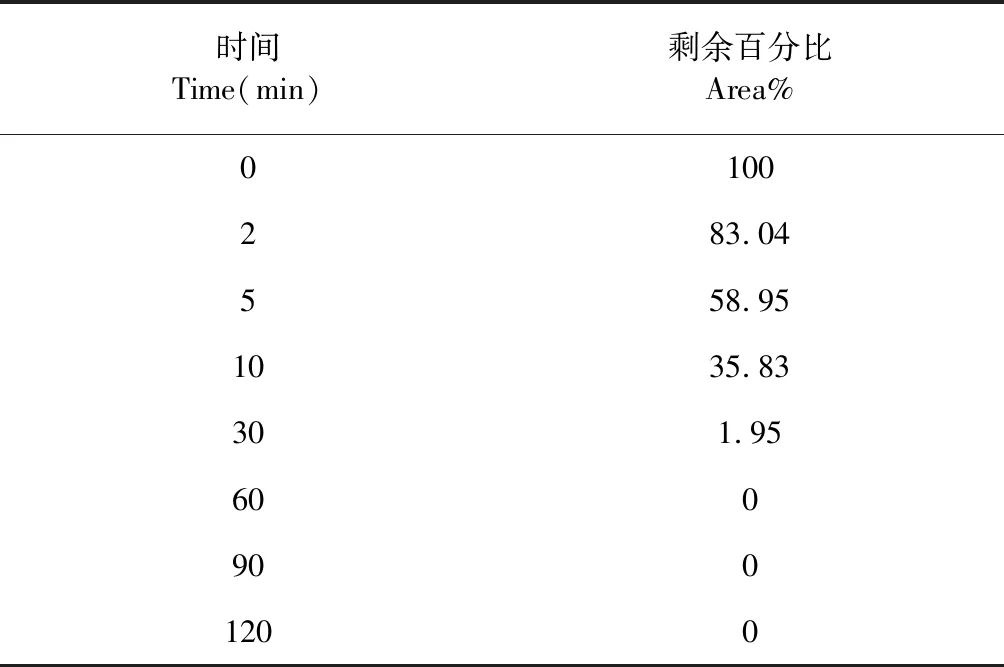
表2 NCP4在鼠肝微粒体孵育体系中剩余百分比(area%)的结果Table 2 The remaining percentage of NCP4 in rat liver microsome incubation system (area%)
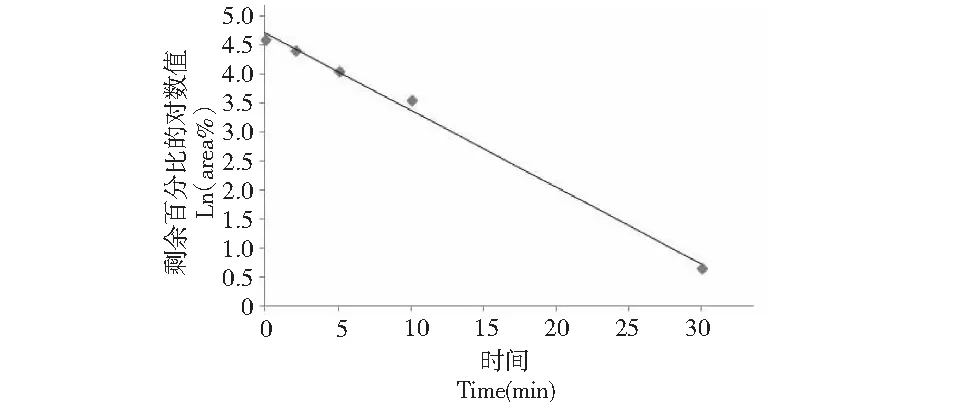
图1 NCP4在SD大鼠微粒体孵育体系中ln(area%) 值与孵育时间的线性关系图Fig.1 Linear relationship between ln(area%) and incubation time of NCP4 in SD rat microsome incubation system
3.1.3 NCP4在人肝微粒体样品中的体外代谢稳定性
NCP4在0 min时的峰面积作为100%,其他时间点与0 min时间点的峰面积相比得到NCP4的剩余百分比(area%),结果见表4,可以看出NCP4在120 min内代谢完全。将各时间点NCP4的剩余百分比的自然对数值与相应的孵育时间进行线性回归,求得斜率(-k),线性关系良好的ln(area%)值与孵育时间计算结果见图3。回归方程:y=-0.040 9x+4.470 5,R2=0.990 3,说明NCP4在人肝微粒体孵育体系中0~90 min时间范围内呈现线性消除。由公式(1)~(3)计算NCP4在人肝微粒体中的半衰期Tl/2(min)、肝固有清除率CLint(mL/min/kg)和肝清除率CLh(mL/min/kg)分别为16.9 min、2.54 mL/min/kg和2.29 mL/min/kg。
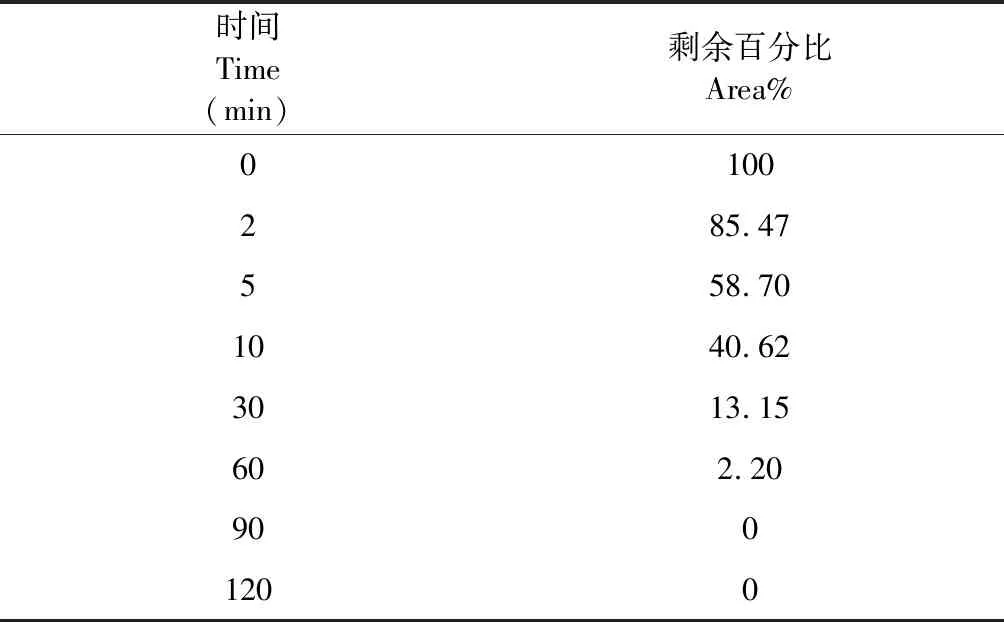
表3 NCP4在beagle犬肝微粒体孵育体系中剩余百分比(area%)的结果Table 3 The remaining percentage (area%) of NCP4 in beagle canine liver microsome incubation system

图2 NCP4在beagle犬肝微粒体孵育体系中ln(area%) 值与孵育时间的线性关系图 Fig.2 Linear relationship between ln(area%) and incubation time of NCP4 in beagle dog liver microsome incubation system
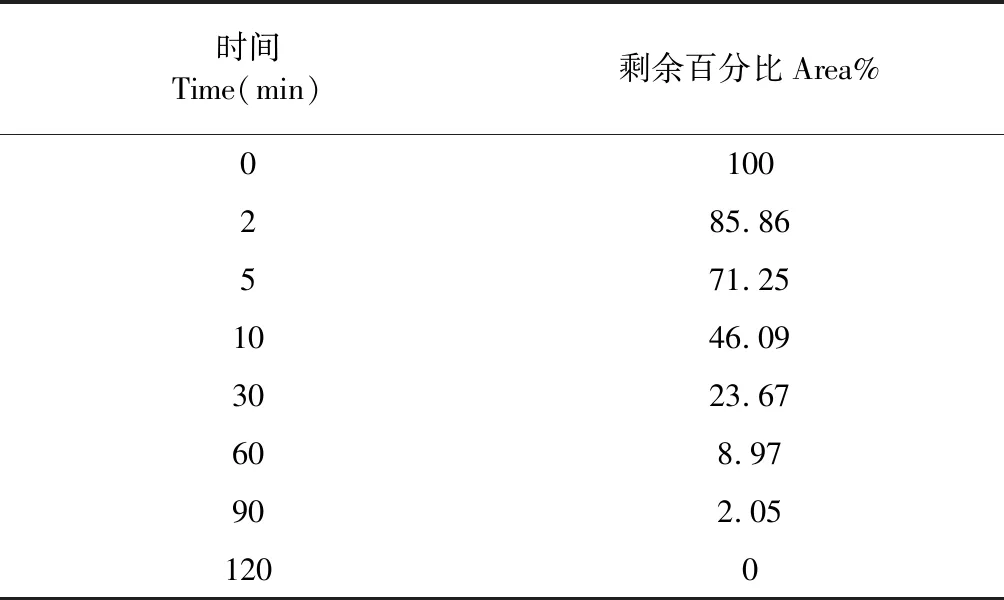
表4 NCP4在人肝微粒体孵育体系中剩余百分比(area%)的结果Table 4 The remaining percentage (area%) of NCP4 in human liver microsome incubation system

图3 NCP4在人肝微粒体孵育体系中ln(area%) 值与孵育时间的线性关系图Fig.3 Linear relationship between ln(area%) and incubation time of NCP4 in human liver microsome incubation system
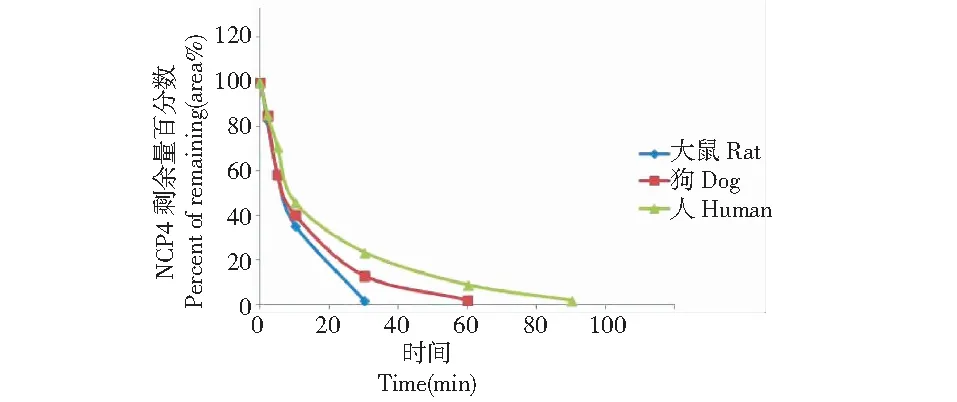
图4 NCP4在不同种属肝微粒体中孵育结果Fig.4 Incubation results of NCP4 in different species liver microsomes incubation system
3.2 NCP4在不同种属肝微粒体孵育液中代谢产物结构鉴定
3.2.1 NCP4在SD大鼠肝微粒体温孵样品中代谢产物结构鉴定
NCP4在SD大鼠肝微粒体温孵体系下温孵60 min(图5c)和120 min(图5d)后,发现均有4个新增的主要色谱峰,见图5,NCP4及各产物的m/z[M+Na]+和保留时间数据如表5所示。其中M1和M2的m/z[M+Na]+均为502,比NCP4少了14,推测M1和M2均是NCP4脱去一分子甲基,M1和M2是同分异构体。M3的m/z[M+Na]+比NCP4(m/z516)要少56,推测M3是NCP4末端-O-C-断裂脱去C4H9。M4的分子离子比NCP4少172,推测M4的代谢过程较为复杂。推测各个化合物的代谢途径如图6(A、B)所示。
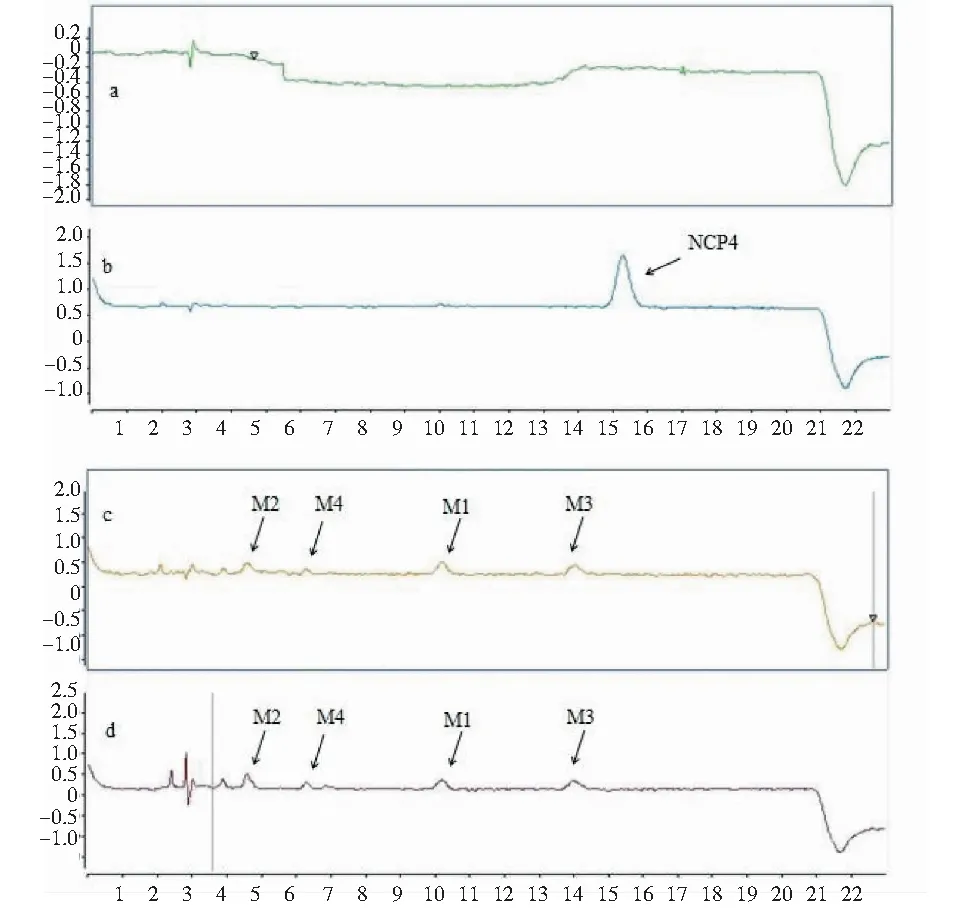
图5 SD大鼠肝微粒体温孵样时间点LC-UV分析色谱图Fig.5 Typical LC-UV chromatogram of incubation sample 注:空白基质(a)、0 min(b) 、60 min(c)、120 min(d);M1,M2,M3,M4均为NCP4在SD大鼠肝微粒体中温孵后的代谢产物 Note:blank matrix (a),0 min (b),60 min (c),120 min (d);M1, M2,M3,M4 are metabolites of NCP4 in rat liver microsomes incubation systems
3.2.2 NCP4在beagle犬肝微粒体温孵样品中代谢产物结构推断
NCP4在beagle犬肝微粒体温孵体系下温孵不同时间的样品在确定HPLC-UV-MS(Q-TOF)分离鉴别条件下进行分析,其中与空白基质和0 min点温孵样品比较,代谢产物较明显的是60 min(图7c)和120 min(图7d)温孵样品。NCP4及各产物的m/z[ M+Na]+和保留时间数据如表6所示。推测可能的代谢途径如图8(A、B、C)所示。
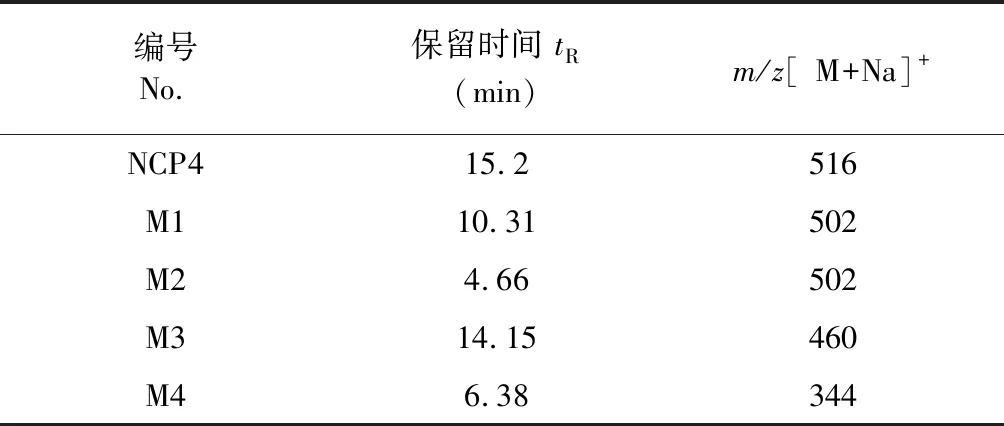
表5 NCP4在SD大鼠肝微粒体孵育60 min后的降解产物色谱保留时间和质谱数据Table 5 Retention time and mass spectrometry data of NCP4 degradation products in SD rat liver microsomes (incubation time:60 min)

图6 NCP4在鼠肝微粒体中代谢途径推测Fig.6 Metabolic pathways of NCP4 metabolic product in SD rat liver microsome 注:A.代谢产物M1,M2,M3代谢途径;B.代谢产物M4代谢途径。Note:A.metabolic pathway of M1,M2 and,M3;B.metabolic pathway of M4 metabolic pathway.
3.2.3 NCP4在人肝微粒体温孵样品中代谢产物鉴定
NCP4在人肝微粒体温孵体系下温孵不同时间的样品在确定的HPLC-UV-MS(Q-TOF)分离鉴别条件下进行分析,其中与空白基质和0 min点温孵样品比较,代谢产物较明显的是60 min(图9c)和120 min(图9d)温孵样品。NCP4及各产物的m/z[M+Na]+和保留时间数据如表7所示。我们发现NCP4在人和beagle犬肝微粒体中的代谢产物一致,推测代谢途径也一致(见图8)。

图7 Beagle犬肝微粒体温孵样时间点的LC-UV图Fig.7 Typical LC-UV chromatogram of incubation sample 注:空白基质(a)、0 min(b)、60 min(c)、120 min(d);M5,M6,M7,M8均为NCP4在犬肝微粒体中温孵后的代谢产物。Note:blank matrix (a),0 min (b),60 min (c),120 min (d);M1,M2,M3,M4 are metabolites of NCP4 in dog liver microsome incubation systems.

表6 NCP4在Beagle犬肝微粒体温孵60 min后的降解产物色谱保留时间和质谱数据Table 6 Retention time and mass spectrometry data of NCP4 degradation products in Beagle dog liver microsome incubation systems (incubation time:60 min)
4 讨论
实验分别对NCP4在不同种属(SD大鼠、Beagle犬、人)肝微粒体温孵体系中的底物代谢稳定性进行了研究,不同种属肝微粒体孵育体系中NCP4的剩余量百分比与孵育时间的相关图见图4,可见体外代谢稳定性动态变化趋势基本一致,其中Beagle犬与人肝微粒体温孵体系中的底物代谢稳定性更为接近。
根据NCP4的剩余量与孵育时间以及肝微粒体生化参数经验值,计算SD大鼠、Beagle犬和人肝微粒体温孵代谢动力学参数Tl/2(min)、CLint(mL/min/kg)和CLh(mL/min/kg),结果表明:NCP4在SD大鼠、Beagle犬和人三种不同种属肝微粒体中代谢半衰期Tl/2(min) 、CLint(mL/min/kg )和CLh(mL/min/kg)范围分别为5.21±277.2 min、2.54±11.91 mL/min/kg、2.29±9.80 mL/min/kg,其中Beagle犬和人肝微粒体温孵代谢动力学参数Tl/2(min)相当,说明Beagle犬与人肝微粒体温孵体系中NCP4底物的代谢稳定性基本一致。

图8 NCP4在beagle犬及人肝微粒体中代谢途径推测Fig.8 Metabolic pathways of NCP4 metabolic product in beagle dogs and human liver microsome 注:A.代谢产物M6,M7代谢途径;B.代谢产物M5代谢途径;C.代谢产物M8代谢途径。Note:A.metabolic pathway of M6,M7;B.metabolic pathway of M5 metabolic pathway;C.metabolic pathway of M8.

图9 人肝微粒体温孵样时间点的LC-UV图Fig.9 Typical LC-UV chromatogram of incubation sample 注:空白基质(a)、0 min(b)、60 min(c)、120 min(d);M5,M6,M7,M8均为NCP4在人肝微粒体中温孵后的代谢产物。Note:blank matrix (a),0 min (b),60 min (c),120 min (d);M1,M2,M3,M4 are metabolites of NCP4 in human liver microsome incubation systems.
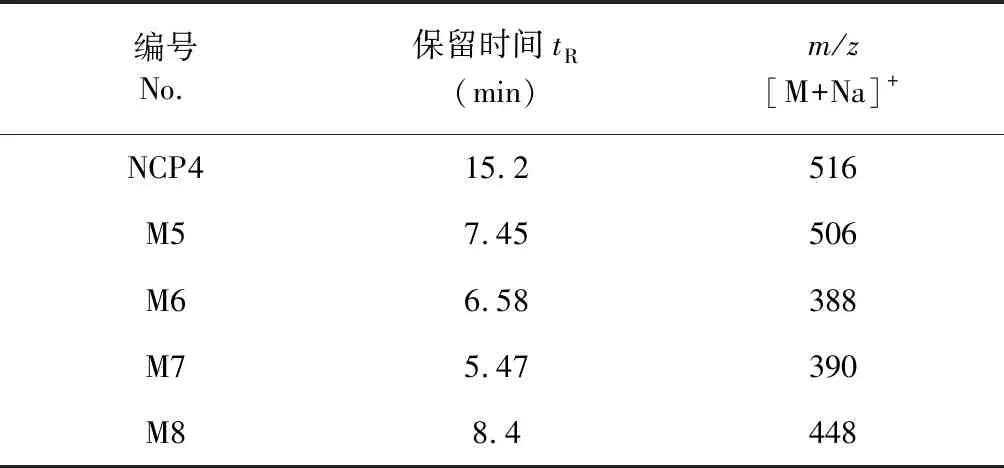
表7 NCP4在人肝微粒体温孵60 min后的降解产物色谱保留时间和质谱数据Table 7 Retention time and mass spectrometry data of NCP4 degradation products in human liver microsome incubation systems (incubation time:60 min)
同时,本实验还分别对NCP4在不同种属(SD大鼠、beagle犬、人)肝微粒体温孵体系中的代谢产物进行了研究,结果表明NCP4在SD大鼠肝微粒体中生成m/z[M+Na]+为502、460、344的代谢产物,在Beagle犬、人肝微粒体中生成m/z[M+Na]+为388、390、448的代谢产物。表明NCP4在犬及人肝微粒体中代谢产物相同。
综上所述,我们可以选择beagle犬作为NCP4临床前研究的动物模型,用于NCP4的临床前药理学、毒理学及药代动力学等相关研究。

