粪肠球菌ace阳性和阴性菌株体外生物被膜形成能力比较
细菌生物被膜在肠球菌感染中起重要作用。导尿管、前列腺小管、口腔感染根管、感染性性心内膜炎瓣膜等感染部位均可观察到肠球菌生物膜的存在[1-2],研究肠球菌生物被膜形成的上调或抑制基因,探讨肠球菌生物被膜形成的分子机制,成为肠球菌致病机制的研究方向之一。已有研究表明肠球菌表面蛋白esp、明胶酶gelE、分选酶srt、肠球菌调节因子fsr和增强子结合蛋白ebpR等基因与肠球菌的生物膜形成相关[3-7]。粪肠球菌胶原结合蛋白ace(粪肠球菌胶原粘附素),是肠球菌的表面粘附蛋白,在肠球菌泌尿道感染以及心内膜炎感染中具有毒力作用[8]。同时,这些部位的感染也与细菌生物被膜的存在密切相关。近年来,人们发现一些细菌粘附素除了启动对宿主的感染外,对生物被膜的形成也有贡献[9-10]。肠球菌Ace的毒力机制除了促进细菌与宿主细胞的粘附外,是否也还有利于细菌间生物被膜的形成值得探讨。本文对粪肠球菌临床分离株的生物膜形成能力与ace基因的相关性进行分子流行病学分析,并通过本室构建的一对ace基因转化变异株,采用微量滴定板法以及共聚焦显微镜观察比较ace+、ace-粪肠球菌体外生物膜形成能力的差异,探讨粪肠球菌ace基因产物影响生物膜形成的致病机制。
1 材料与方法
1.1菌株及质粒 46株粪肠球菌临床分离株分离自福建医科大学附属协和医院及福建省立医院就诊患者的尿液、胆汁、腹腔液和心瓣膜、留置导尿管等临床标本。标准菌株ATCC29212(ace+)购自卫生部临床检验中心,粪肠球菌ace阴性野生株U8-ace-(壮观霉素敏感),分离自泌尿道感染临床标本。粪肠球菌空质粒对照株EU8-ace-、粪肠球菌转化株ZU8-ace+本实验室构建保存。大肠杆菌XL1-Blue 含pTEX5646(pAT 392穿梭质粒,整段ace基因,携壮观霉素抗性)德克萨斯大学医学院Barbara E. Murray教授馈赠。
1.2主要试剂及仪器 BHI培养液、MH肉汤为美国 Difco公司产品;PCR试剂与 TaqDNA聚合酶为宁波基内公司产品;吖啶橙(AO)、溴化乙锭(EB)为Sigma公司产品。35 mm培养皿、10 mm培养皿、96孔微量滴定板为 Corning Incorporated产品。Gene Amp 2400 PCR扩增仪(GE Healthcare Bio-Sciences公司); 酶标仪(BioRad公司);共聚焦激光扫描显微镜(LSM780德国zeiss公司)。
1.3生物被膜形成能力检测 采用微量滴定板法[11-12],将粪肠球菌ace+、ace-菌液(1×107CFU/mL),加入96孔细胞培养板中,每孔200 μL,37 ℃培养3 h~48 h,各时间点培养3孔,并设培养液阴性对照。吸去培养液,PBS缓冲液洗去浮游细菌,10%甲醛固定,结晶紫染色15 min,PBS缓冲液洗板,无水乙醇溶解结晶紫,测定各孔OD570值,每孔测3次取平均值。生物被膜形成力评价标准:测定阴性对照(培养液) OD570值,取阴性对照OD570平均值加3倍标准差为生物膜形成界定值Dc(D+3S),测定的ace+、ace-粪肠球菌OD570值与Dc进行比较,未形成生物膜:OD570≤Dc;生物膜形成力弱:Dc
1.4粪肠球菌ace基因检测 应用 DNAMAN 软件设计上下游引物,引物从5′至3′方向:
aceF: AAAGTAGAATTAGATCCACAC
aceR: TCTATCACATTCGGTTGCG
以肠球菌基因组DNA为模板,PCR扩增肠球菌ace基因;PCR反应程序为: 94 ℃ 5 min变性,(94 ℃ 30 s→56 ℃ 45 s→72 ℃ 60 s)×30个循环,72 ℃延伸7 min。扩增所得产物大小为290 bp。PCR产物经1.5%琼脂糖凝胶电泳,溴化乙啶染色,于凝胶分析系统中观察。
1.5激光共聚焦显微镜比较ace+和ace-粪肠球菌生物被膜 于35 mm细胞培养皿内放入20 mm×20 mm灭菌玻片,将ATCC29212(ace+)、U8-ace-、EU8-ace-、ZU8-ace+菌液(5×106CFU/mL)1 mL分别滴至玻片表面,静置1 min,加入BHI培养液1.5 mL,封口膜封闭,37 ℃分别培养6 h、12 h、18 h、24 h、48 h、72 h。弃培养液,用PBS冲洗浮游菌,于盖玻片表面滴加100 μL AO/EB染液,暗室孵育染色15 min,PBS冲洗2次,吸水纸吸干,透明指甲油密封。共聚焦激光扫描显微镜(CLSM)观察收集图像。CLSM观察条件为:物镜×20,氩激光514/488 nm。生物被膜标本由内(生物被膜与玻片相贴的面)向外(生物被膜的游离面)沿Z轴逐层扫描,获得生物被膜的断层扫描图象。生物膜厚度取生物膜最外层和玻片之间的距离。生物膜的细菌密度取中间层断层扫描图象的数据进行分析。生物膜内细菌密度以CLSM断层扫描图象中的荧光量表示。
2 结 果
2.1粪肠球菌ace基因的扩增 对46株粪肠球菌临床分离株进行PCR检测ace基因,有28株检测到ace基因,琼脂糖凝胶电泳可见大小290 bp左右清晰条带,与引物设计的预期结果一致,ace基因阴性株未见条带,部分菌株电泳结果见图1。
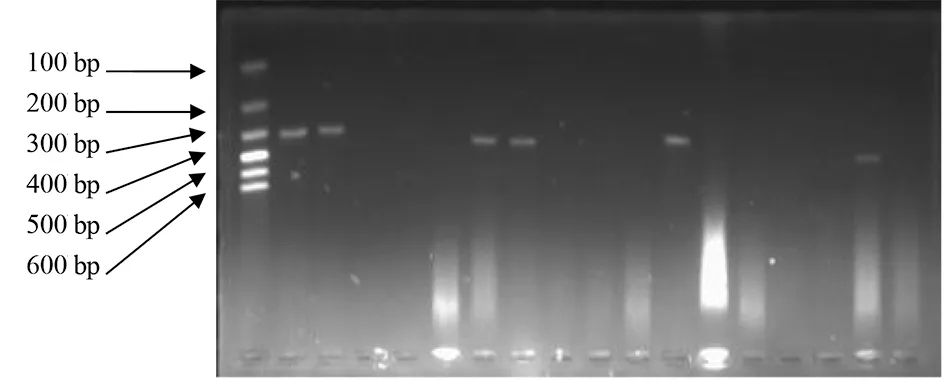
图1 临床分离粪肠球菌ace基因PCR产物Fig.1 PCR products of ace gene from clinical isolates of Enterococcus faecalis
2.2临床分离粪肠球菌株生物膜阳性组与生物膜阴性组ace基因的检出率比较 微量滴定板法对46株临床分离粪肠球菌进行生物膜形成检测65.22%(30株)为生物膜阳性菌株。生物膜阳性菌株中,23株(76.67%)菌株携带ace基因;生物膜阴性菌株中,5株(31.25%)菌株携带ace基因,经统计学分析,生物膜阳性、阴性菌株携带ace基因差别有统计学意义(χ2=9.04,P<0.05) (表1)。
2.3粪肠球菌ace+和ace-菌株生物被膜形成能力比较 微量滴定板法比较肠球菌野生株ATCC29212(ace+)、U8-ace-、空质粒对照株EU8-ace-、转化株ZU8-ace+的生物被膜形成能力,各菌株的生物被膜形成能力随培养时间延长而提高,粪肠球菌ATCC29212(ace+)以及转化株ZU8-ace+在各时段的生物膜形成能力均比野生株U8-ace-强,经单因素方差分析,差异有统计学意义(F=5.32、6.13,P<0.01);EU8-ace-与U8-ace-比较,差异无统计学意义(F=2.04,P>0.05),图2。
表1 生物膜阳性组与生物膜阴性组粪肠球菌ace基因的检出率
Tab.1 Detection rate ofacegene ofE.faecalisin positive or negative biofilm group

ace+ace-合计ace阳性率/nnn%生物膜阳性2373076.67生物膜阴性5111631.25合计28184660.87

**与U8-ace-比较,P<0.01 *与U8-ace-比较,P>0.05图2 粪肠球菌ace+、ace-菌株生物膜形成能力(OD570)Fig.2 Biofilm formation ability (OD570) of ace+, ace-E.faecalis
2.4粪肠球菌ace+和ace-菌株生物被膜厚度比较 激光共聚焦显微镜观测比较粪肠球菌ace基因阳性、阴性菌株生物被膜厚度,在生物膜形成的各阶段,ATCC29212(ace+)、转化株ZU8-ace+所形成的生物膜的平均厚度比野生株U8-ace-的大,经单因素方差分析,差异有统计学意义(F=6.46、7.63,P<0.01);空质粒对照株EU8-ace-与野生株U8-ace-比较,生物膜厚度差异无统计学意义(F=1.88,P>0.05)图3。
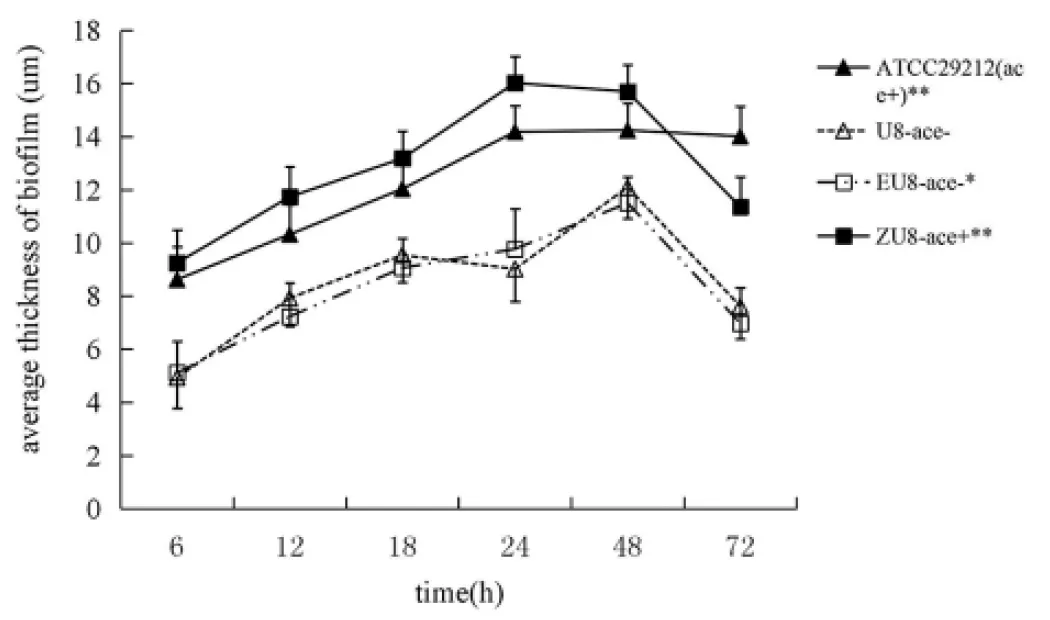
**与U8-ace-比较,P<0.01 *与U8-ace-比较,P>0.05
图3 粪肠球菌ace+、ace-菌株生物被膜在各阶段的平均厚度
Fig.3 Average thickness oface+、ace-E.faecalisbiofilm at different stages
2.5粪肠球菌ace+和ace-菌株生物被膜细菌密度比较 激光共聚焦显微镜观测,生物膜内层、中间层的细菌密度相对较大,而外层较低。取生物膜中层比较粪肠球菌ace+与ace-菌株所形成的生物膜的密度,结果表明,ATCC29212(ace+)、转化株ZU8-ace+所形成的生物膜密度比野生株U8-ace-的高,经单因素方差分析,差异有统计学意义(F=8.83、10.32,P<0.01);空质粒对照株EU8-ace-与野生株U8-ace-比较,生物膜密度无统计学差异(F=1.17,P>0.01),图4。
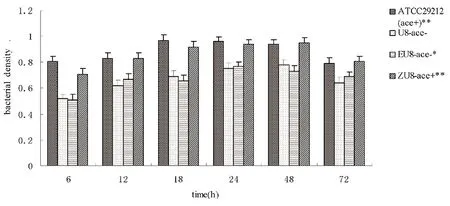
**与U8-ace-比较,P<0.01 *与U8-ace-比较,P>0.05图4 ace+、ace-粪肠球菌生物被膜中层细菌密度Fig.4 Bacterial density of ace+、ace-E.faecalis biofilm at intermediate layer
3 讨 论
细菌粘附是细菌感染宿主的起始步骤,在肠球菌毒力因子研究中,对粘附素的研究近年来较为广泛。同时,细菌生物被膜在感染致病中的意义也越来越受重视。肠球菌生物被膜的形成在呼吸道感染、泌尿道感染尤其是留管相关泌尿道感染、感染性心内膜炎等医院感染中都有具有重要意义。细菌粘附启动感染以及细菌生物被膜形成都是细菌感染的关键步骤。
近年来,在粘附素启动细菌感染第一步的基础上,人们开始关注黏附素在生物被膜的形成中的作用。已有研究表明肠球菌表面蛋白esp、明胶酶gelE、粪肠球菌心内膜炎抗原EfaA、分选酶srt、肠球菌调节因子fsr和增强子结合蛋白ebpR等基因与肠球菌的生物膜形成相关[3-7],肠球菌胶原结合蛋白黏附素是否有利于细菌生物被膜的形成未见报道。
本文对46株临床分离粪肠球菌分别进行ace基因PCR检测以及生物膜形成能力检测。结果表明,46株临床分离粪肠球菌中28株粪肠球菌携带ace基因,ace基因检出率为60.87%,28株ace基因阳性组中,82.14%(23株)为生物膜阳性菌株,16株ace基因阴性组中仅有38.89%(7株)为生物膜阳性,ace基因阳性、阴性粪肠球菌生物膜形成情况的差别有统计学意义,P<0.05,初步表明该基因与生物膜形成具有相关性。
临床分离菌株存在背景不一、多种毒力基因共存等情况,本文利用美国德克萨斯大学医学院Barbara E. Murray教授馈赠的质粒pTEX5646(含pAT 392穿梭质粒,整段ace基因,壮观霉素抗性),构建了一对ace基因转化变异株,通过微量滴定板法以及共聚焦显微镜观察比较ace+、ace-粪肠球菌体外生物膜形成能力的差异。研究结果表明,共聚焦激光显微镜观察,无论临床菌株还是实验室改造菌株,ace+粪肠球菌在不同阶段所形成的生物膜的厚度、细菌密度均高于ace-菌株;微量滴定板法显示,不同时间点ATCC29212(ace+)以及转化株ZU8-ace+的生物膜形成能力的OD570值均大于野生株U8-ace-的OD570值,而ace-空质粒转化对照株与ace-野生株比较,生物膜形成能力没有统计学差别,提示粪肠球菌胶原黏附素ace基因有利于肠球菌体外生物被膜的形成。
细菌生物被膜的形成,需经历初始表面粘附阶段(可逆);表面附着阶段(不可逆,黏附素介导);细胞间粘附聚集阶段;发展和成熟阶段等4个阶段。虽然生物被膜的形成过程非常复杂,但初始粘附是细菌形成生物被膜的必要条件,因此黏附素至少在初始阶段参与了细菌生物被膜的形成。在生物膜形成机制研究中,研究较多的是微生物表面成分识别粘附基质分子(microbial surface components recognizing adhesive matrix molecules,MSCRAMMs),这些细菌表面相关蛋白,能够特异性地与宿主组织的细胞外基质(ECM)中的纤连蛋白(Fn) 、纤维蛋白原 (Fg)以及胶原等成分结合,介导细菌结合到宿主细胞。Philippe等报道,金黄色葡萄球菌纤维连接蛋白结合蛋白FnBPs主要参与金黄色葡萄球菌生物膜的形成的附着过程和聚集阶段[9]。Court 等通过原子力显微镜技术证明FnBPs 通过多种低亲和力键介导相邻细菌间的粘附作用[10]。沙门氏菌Hap粘附素可以介导细胞间聚合,导致微小菌落及生物被膜形成[15]。肠球菌胶原结合蛋白Ace可介导粪肠球菌黏附到层粘连蛋白、胶原蛋白等细胞外基质蛋白,有助于粘附牙本质、肾细胞、膀胱癌等细胞,在导管相关泌尿道感染以及心内膜炎感染的动物模型中有毒力作用[16-18]。Ace与金黄色葡萄球菌胶原蛋白黏附素Cna同源,都属于MSCRAMM家族,可在生物膜形成中发挥类似作用,具体深入机制有待进一步探讨。
本文通过临床菌株和实验室构建菌株,研究比较粪肠球菌ace基因阳性、阴性菌株体外生物被膜的形成能力,为进一步的体内生物被膜动物模型研究提供相互印证,为寻找抑制肠球菌生物膜形成的途径及肠球菌泌尿道、呼吸道等的医院感染的防治提供新思路。
利益冲突:无
引用本文格式:强华,刘光英,林任玺.粪肠球菌ace阳性和阴性菌株体外生物被膜形成能力比较[J].中国人兽共患病学报,2019,35(7):599-603. DOI:10.3969/j.issn.1002-2694.2019.00.081

