贵阳地区351株幽门螺杆菌药物敏感性及pbp1多样性分析
吴芳草,王 琼,朱 键2,胡 越3,潘 科4,蒋 强4,雷静静3,刘 芳,文学琴,糜孟衡,王彩霞,崔古贞,陈峥宏
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种螺旋形、微需氧、革兰氏阴性杆菌,是人类疾病最常见的慢性致病菌之一[1],其感染是慢性活动性胃炎、消化性溃疡、胃黏膜相关组织淋巴瘤(MALT)的主要病因, 被认为是胃癌发生的Ⅰ类致病因子,发挥诱导和促进胃癌发生的作用[2]。国内外公认的根除幽门螺杆菌治疗方案是三联疗法或四联疗法[3],即:质子泵抑制剂(proton pump inhibitor, PPI)和两种抗生素联合或PPI、铋剂和两种抗生素联合(克拉霉素加阿莫西林、甲硝唑加阿莫西林、克拉霉素加甲硝唑等)。但随着抗菌药物的广泛使用和幽门螺杆菌根除治疗的普遍开展,该菌的耐药率逐年上升,且表现出地区差异[4]。目前阿莫西林耐药率相对较低,因此是临床首选的治疗幽门螺杆菌感染的β-内酰胺类药物。该药物通过与细菌的青霉素结合蛋白(penicillin binding proteins, PBPs)结合而干扰细菌细胞壁的合成,导致菌细胞裂解死亡[5]。但是,近年来不断有关于幽门螺杆菌对阿莫西林耐药的报道,探讨其耐药机制是幽门螺杆菌耐药性研究热点之一。有研究认为,PBP1突变是导致幽门螺杆菌阿莫西林耐药的主要机制[6-7],但不同国家不同地区报道的PBP1氨基酸序列的突变类型及位点存在较大差异。为了解本地幽门螺杆菌耐药性,特别是对阿莫西林的耐药性以及本地菌株PBP1多样性和耐药的关系,本课题对胃病患者胃黏膜分离的幽门螺杆菌进行了药物敏感性检测以及对阿莫西林耐药株和敏感株的pbp1基因序列进行了检测和分析,现报道如下。
1 材料和方法
1.1 材 料
1.1.1样本来源 选取2016-2018年在贵阳市三家医院(贵州医科大学附属医院、贵州省肿瘤医院、贵航贵阳医院)的上消化道疾病患者。纳入标准:患者年龄18岁以上且内窥镜检查前15 d没有抗幽门螺杆菌治疗。排除标准:近15 d内接受过抗幽门螺杆菌治疗;存在消化道大出血和幽门梗阻等并发症;严重心、肺、肾功能不全患者。本研究经贵州医科大学附属医院人体医学伦理委员会批准,患者均知情同意。
1.1.2主要试剂及仪器设备 琼脂培养基(Mueller-Hinton, MH;杭州天和微生物试剂有限公司);尿素酶试纸(珠海市克迪科技开发有限公司);抗生素标准品:克拉霉素、阿莫西林、左氧氟沙星、四环素、甲硝唑(中国药品生物制品检定所);无菌脱纤维绵羊血(河南圣康生物科技有限公司);幽门螺杆菌选择性添加剂(英国 OXOID公司);胎牛血清(浙江天杭生物科技股份有限公司);微需氧产气袋(日本三菱化学株式会社);厌氧罐(日本三菱化学株式会社);细菌组DNA提取试剂盒(北京天根生物工程有限公司);PCR扩增仪(杭州晶格科学仪器有限公司);电泳仪(北京市六一仪器厂);凝胶成像分析仪(北京市六一仪器厂);冷冻高速离心机(赛默飞世尔科技有限公司)。
1.2 方 法
1.2.1幽门螺杆菌的分离培养、鉴定 在胃内窥镜下取胃窦或胃体黏膜组织1块,放入含20%蔗糖和10%胎牛血清的脑心浸出液(BHI)无菌保存液中低温转运至实验室并在2 h内进行处理。无菌操作将活检标本充分剪碎至无明显组织块,接种到已加入幽门螺杆菌添加剂(万古霉素、头孢磺啶、甲氧苄氨嘧啶、两性霉素B)且含10%无菌脱纤维绵羊血的MH培养基,置微需氧环境培养3~5 d,若平板上出现针尖样大小、透明或半透明光滑潮湿的单菌落,则挑取单菌落传代培养,培养物通过革兰染色、氧化酶、过氧化氢酶、脲酶试验及幽门螺杆菌特异性16S rDNA PCR进行鉴定[8]。
1.2.2 幽门螺杆菌药物敏感性试验
1.2.2.1抗生素原液的制备 配制抗生素药液,终浓度为1 000 μg/mL,-20 ℃保存。参照美国临床实验标准化协会(CLSI)指南[9],不同生素的溶剂与稀释剂不同,见表1。
1.2.2.2幽门螺杆菌菌悬液的制备 从MH血琼脂平板上刮取培养72 h且状态良好的幽门螺杆菌,以无菌生理盐水制备菌悬液,菌液浓度相当于2.0麦氏单位(6×108CFU/ mL)。
表1 抗生素稀释
Tab.1 Dilution of antibiotics
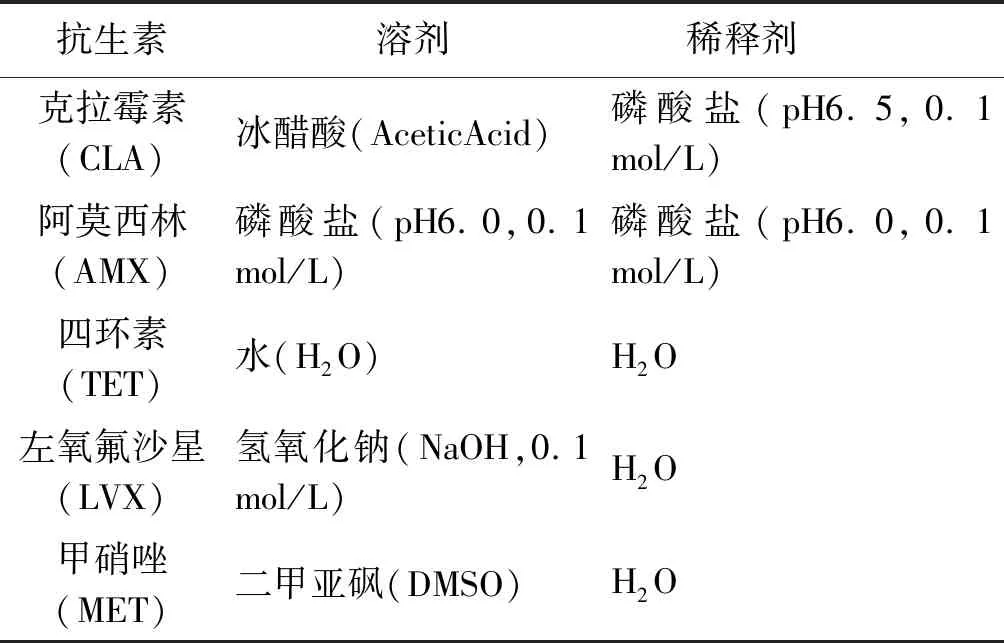
抗生素溶剂 稀释剂克拉霉素(CLA)冰醋酸(AceticAcid)磷酸盐(pH6.5,0.1mol/L)阿莫西林(AMX)磷酸盐(pH6.0,0.1mol/L)磷酸盐(pH6.0,0.1mol/L)四环素(TET)水(H2O)H2O左氧氟沙星(LVX)氢氧化钠(NaOH,0.1mol/L)H2O甲硝唑(MET)二甲亚砜(DMSO)H2O
1.2.2.3幽门螺杆菌临床分离株的药物敏感性试验制备含药的界值平板(含10%脱纤维羊血),药物浓度为:阿莫西林、克拉霉素和左氧氟沙星为1 μg/ mL, 四环素为2 μg/ mL,甲硝唑为8 mg/μL[10-12]。取10 μL菌液(浓度为6×108CFU/ mL)点种于含药的MH血琼脂平板上,每一菌株同时接种5种药敏平板,同时取10 μL菌液点种于不含药的MH血琼脂平板上为对照,以标准菌株ATCC 26695(受赠于山东大学齐鲁医学院病原生物学研究所)作为质控菌株[13-14]。37 ℃微需氧培养,72 h观察结果。克拉霉素、阿莫西林、左氧氟沙星、四环素、甲硝唑的耐药判断标准:所有平板无污染,不含药的MH血琼脂平板上均生长,在耐药界值平板上生长判为耐药,未生长判为敏感。
1.2.3幽门螺杆菌pbp1基因突变的检测及分析
1.2.3.1pbp1基因引物序列pbp1基因引物序列见参考文献[15],由生工生物(上海)科技有限公司合成。各基因引物序列如下:pbp1,正向引物5′-GCGTCTAATGAAGATGAAGA-3′,反向引物5′-TTAAAGTCCCTATAGCCATG-3′。
1.2.3.2pbp1基因片段的PCR扩增 选择幽门螺杆菌阿莫西林耐药株20株和敏感株20株,以细菌基因组DNA提取试剂盒提取各菌株新鲜培养物基因组DNA,采用NanoDrop2000超微量紫外分光光度计检测DNA纯度及浓度。以提取的幽门螺杆菌基因组DNA模板,PCR反应体系(50 μL):2×TaqPCR Master MIX 25 μL,上、下游引物各2 μL,DNA 6 μL,H2O 15 μL。pbp1基因PCR反应循环参数:94 ℃预变性10 min,94 ℃变性1 min;55 ℃ 1 min ,72 ℃ 1 min,共35个循环,72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳观察。
1.2.3.3pbp1基因片段的测序和氨基酸序列分析 PCR产物送生工生物(上海)科技有限公司进行测序,将所得序列在NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行BLAST后采用DNAStar软件将DNA序列转换为氨基酸,分别与GenBank中幽门螺杆菌ATCC 26695的PBP1氨基酸序列进行比对并统计结果。
1.2.4统计学分析 采用SPSS19.0软件对单一耐药组、双重耐药组和多重耐药组耐药率最高的抗生素或抗生素组合的耐药率进行χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1幽门螺杆菌临床分离株药物敏感性 351株幽门螺杆菌药敏检测结果显示:克拉霉素、阿莫西林、左氧氟沙星、甲硝唑和四环素5种药物的耐药率分别为34.60%、13.27%、40.28%、71.56%、17.06%,见表2。
表2 351株幽门螺杆菌临床分离菌株药敏试验结果
Tab.2 Antibiotic susceptibility of 351H.pyloriclinicalisolates
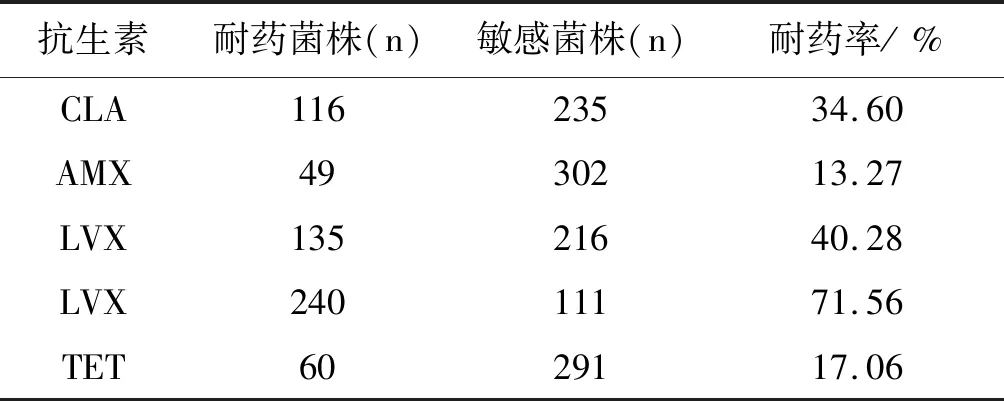
抗生素耐药菌株(n)敏感菌株(n)耐药率/%CLA11623534.60AMX4930213.27LVX13521640.28LVX24011171.56TET6029117.06
注:CLA克拉霉素;AMX阿莫西林;LVX左氧氟沙星;LVX甲硝唑;TET四环素。
根据临床菌株不同的耐药情况分为单一耐药组、双重耐药组、多重耐药组和全敏感组,统计不同耐药组合耐药率。结果显示贵阳地区全敏感率仅为14.5%;单一药物耐药菌株数占总菌株数的35.61%,双重耐药率占25.64%;多重(3种及以上药物耐药)耐药占24.22%。单一耐药组中耐药率最高为甲硝唑(23.65%),双重耐药组耐药率最高组合为甲硝唑+左氧氟沙星(11.97%),多重耐药组耐药率最高组合为甲硝唑+左氧氟沙星+克拉霉素(5.41%),甲硝唑、甲硝唑+左氧氟沙星、甲硝唑+左氧氟沙星+克拉霉素的耐药率差异有统计学意义(χ2=39.42,P<0.01),见表3。
表3 351株幽门螺杆菌不同药物耐药情况
Tab.3 Drug resistance of 351 strains ofHelicobacterpyloriin different groups
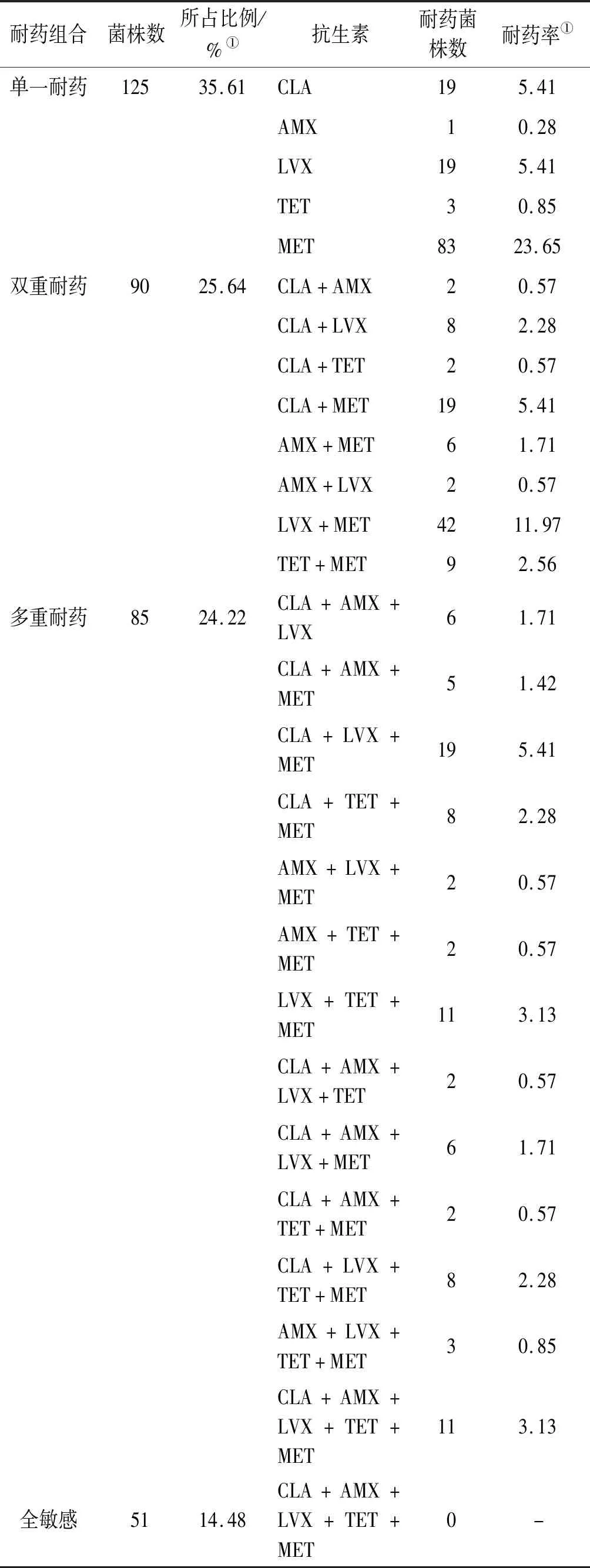
耐药组合菌株数所占比例/%①抗生素耐药菌株数耐药率①单一耐药12535.61CLA195.41AMX10.28LVX195.41TET30.85MET8323.65双重耐药9025.64CLA+AMX20.57CLA+LVX82.28CLA+TET20.57CLA+MET195.41AMX+MET61.71AMX+LVX20.57LVX+MET4211.97TET+MET92.56多重耐药8524.22CLA+AMX+LVX61.71CLA+AMX+MET51.42CLA+LVX+MET195.41CLA+TET+MET82.28AMX+LVX+MET20.57AMX+TET+MET20.57LVX+TET+MET113.13CLA+AMX+LVX+TET20.57CLA+AMX+LVX+MET61.71CLA+AMX+TET+MET20.57CLA+LVX+TET+MET82.28AMX+LVX+TET+MET30.85CLA+AMX+LVX+TET+MET113.13全敏感5114.48CLA+AMX+LVX+TET+MET0-
注:① 该抗生素或抗生素组合在351株分离菌株中的耐药率。
2.2贵阳地区幽门螺杆菌PBP1氨基酸序列的多态性 选取幽门螺杆菌阿莫西林耐药株20株、敏感株20株、标准菌株ATCC26695的pbp1基因片段的PCR产物,经1%琼脂糖凝胶电泳,于紫外检测仪下观察均可见分子量分别约为1 050 bp大小的DNA条带。各临床菌株pbp1序列经DNAStar软件翻译为氨基酸后与ATCC26695的PBP1氨基酸序列比对,阿莫西林耐药株及敏感株中PBP1氨基酸多态性分布为:D479E、N504D、M515I、D535N、S589G、K648Q、R649K;仅出现在阿莫西林耐药株中而敏感株中未发现的氨基酸差异包括:S543R、T556S、I563V、594插入G、596插入S、N641D、A611T、S638L,各菌株多态性见表4。
表4 40株H.pylori临床分离株PBP1氨基酸多态性
Tab.4 Amino acids diversity of PBP1 in 40H.pyloriclinical isolates
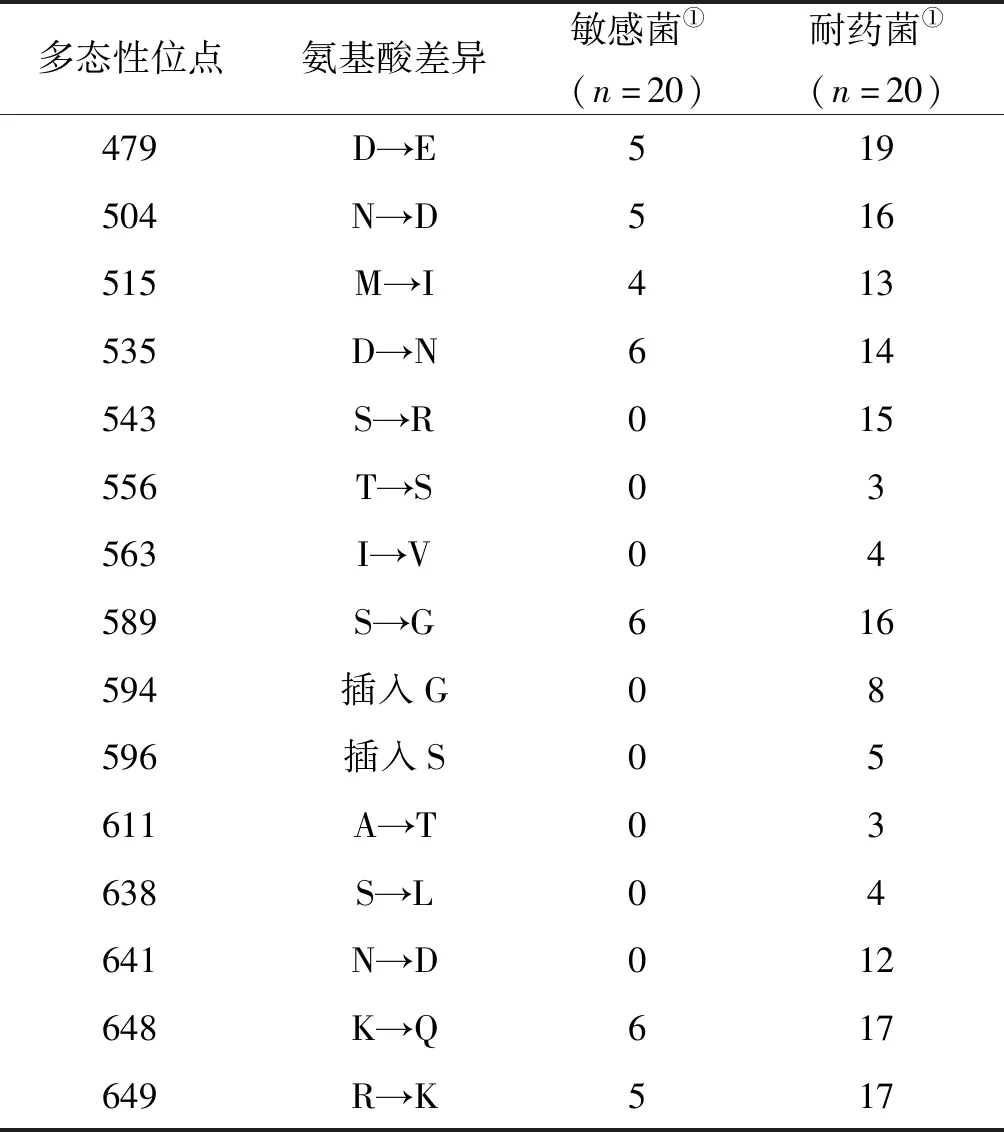
多态性位点氨基酸差异敏感菌①(n=20)耐药菌①(n=20)479D→E519504N→D516515M→I413535D→N614543S→R015556T→S03563I→V04589S→G616594插入G08596插入S05611A→T03638S→L04641N→D012648K→Q617649R→K517
注:① 列下各数字为在该位点存在多态性的菌株数。
3 讨 论
幽门螺杆菌感染被认为是消化系统最常见的细菌感染之一[16],其耐药性的流行程度在不同国家、不同地区有所不同,并且许多国家的耐药率在不断增加。Ghotaslou[17]等对2009—2014年来自PubMed,MEDLINE,Science Direct,Google Scholar和Scielo manuscripts,关于全球地区幽门螺杆菌抗生素耐药性的研究进行了系统性回顾,得出了部分抗生素的耐药性趋势,结果表明甲硝唑总体对幽门螺杆菌的耐药率为47.22%(30.5%~75.02%),克拉霉素为19.74%(5.46%~30.8%),左氧氟沙星为18.94%(14.19%~25.28%),阿莫西林为14.67%(2%~40.87%),四环素为11.70%(0%~50%),呋喃唑酮为11.5%(0%~23%),利福布汀为6.75%(1%~12.45%)。在我国,韩一凡[18]等通过检索共725篇相关文献发现,在全国范围内,左氧氟沙星耐药率为8.9%,甲硝唑耐药率为83.7%,克拉霉素耐药率为20.8%,阿莫西林耐药率为8.7%,四环素耐药率为7.6%,呋喃唑酮耐药率为7.0%。而各类抗生素耐药率在南北方地区有所区别,例如,在北方地区,左氧氟沙星耐药率为17.7%,在南方为7.5%,北方地区耐药率明显高于南方;在北方地区,甲硝唑耐药率为51.7%,在南方为88.6%,南方地区耐药率明显高于北方;而克拉霉素耐药率在南北地区相似。四川省幽门螺杆菌对左氧氟沙星、克拉霉素的耐药率分别为32.05%和30.76%[19];上海地区幽门螺杆菌对克拉霉素、甲硝唑和左氧氟沙星的耐药率为分别19.8%、57.0%和29.1%[20];山西省幽门螺杆菌对甲硝唑、克拉霉素、阿莫西林、左氧氟沙星、呋喃唑酮的耐药率分别为75.3%、7.4%、7.4%、12.4%和8.6%[21]。本研究显示,贵阳地区分离株除了甲硝唑耐药率略低于国内的耐药率,阿莫西林、克拉霉素、左氧氟沙星和四环素的耐药率均高于国内平均耐药率,其原因之一为抗生素不合理使用,尤其是存在无处方亦可购买到抗生素的现象。左氧氟沙星和甲硝唑的高耐药率也与此类药物广泛应用于各种肺部感染、口腔疾病以及妇科疾病等有关,导致耐药率逐年增加[22-23]。与文献[24-25]报道一致,四环素的耐药率相对较低,与其对牙齿和骨骼的毒性作用及在临床较少使用有关。本研究中351株幽门螺杆菌的四环素耐药率为17.06%,并且单一耐药较少,多为多重耐药,提示细菌药物外排泵机制在其耐药形成中有重要意义。阿莫西林的原发性耐药十分罕见[26],因此也是目前临床首选的治疗幽门螺杆菌感染的抗生素。但本实验351株幽门螺杆菌阿莫西林的耐药率达到13.27%,除了与抗生素滥用有关,也与阿莫西林的广谱抗菌作用使得阿莫西林的使用率逐渐增加有关[27]。
近年来,幽门螺杆菌出现多发性和混合性感染[28],多重耐药现象也不断出现[11],有报道嘉兴市4年间有586株幽门螺杆菌出现了对2种抗生素混合耐药,双重耐药率高达34.45%,以克拉霉素和甲硝唑双重耐药率最高,为15.23%[29];青岛地区临床分离的幽门螺杆菌株双重耐药率最高是克拉霉素和左氧氟沙星组合(10.40%)[30];浙江地区甲硝唑和克拉霉素双重耐药率也较高,为15.47%[31]。本研究显示,贵阳市三家医院幽门螺杆菌的双重耐药率达到25.64%,其中甲硝唑和左氧氟沙星混合耐药率最高为11.97%。可见不同地区幽门螺杆菌的双重耐药都较为严重,但不同地区最为严重的耐药组合稍有差异。而本研究的351株幽门螺杆菌三重耐药达到24.22%,严重影响本地区抗幽门螺杆菌治疗药物的选择。本实验结果提供了近期贵阳幽门螺杆菌耐药数据,对于本地治疗该菌感染选择抗菌药物有一定的参考价值。
综合文献,目前幽门螺杆菌对阿莫西林较为敏感,也是临床首选的药物,但是耐药率也有增加的趋势,因此阿莫西林耐药机制是近年来幽门螺杆菌耐药性研究的热点之一。大多数研究认为青霉素结合蛋白的突变是导致幽门螺杆菌对阿莫西林耐药的主要原因[5]。青霉素结合蛋白是细菌的一种特殊膜蛋白,具有糖基转移酶和酰基转肽酶活性,参与肽聚糖的生物合成。转肽酶功能域中有3个青霉素结合基序是β-内酰胺类抗生素结合的关键序列,这些序列的突变将导致PBPs与阿莫西林亲和力下降而发生耐药[6]。β-内酰胺类药物结合的3个关键性青霉素结合基序为:SXXK338-341,SXN402-404和KTG555-557[32],Gerrits[33]等报道了在第二(SKN402-404)和第三(KTG555-557)保守的青霉素结合蛋白基序中或邻近的几个氨基酸变异可以介导其对阿莫西林耐药。2003年,Dong H.Kown[7]通过对幽门螺杆菌阿莫西林耐药株的DNA序列比对时发现,pbp1基因中发生36个碱基的突变导致了pbp1序列上10个氨基酸的替代,认为pbp1突变是导致该菌阿莫西林的重要机制。不同国家和地区幽门螺杆菌阿莫西林耐药株的PBP1氨基酸多态性不同,如位点S414R和A480V突变仅发现于荷兰;而韩国耐药株中PBP1氨基酸突变主要包括T556S和N562Y;巴西耐药株中PBP1氨基酸突变主要包括S417T和D508N。
本次研究发现,与幽门螺杆菌26695相比,幽门螺杆菌阿莫西林耐药株及敏感株中PBP1氨基酸存在共同的差异,其中D479E位点氨基酸变化与文献报道相同[34],耐药菌株与敏感菌株均存在此位点差异。本地菌株中,有8个PBP1氨基酸差异是阿莫西林耐药株特有的,其中S543R出现频率为75%,其次是N641D为60%。提示S543R为本地阿莫西林耐药菌株PBP1氨基酸高频突变位点,但这些仅在阿莫西林耐药株中出现的氨基酸差异并非存在于所有耐药株菌株,可能与多位点的联合突变导致耐药有关。本实验室下一步计划通过将耐药菌pbp1基因转化至敏感菌,以及构建pbp1基因特定突变菌株,进一步明确某一个位点或几个位点突变与阿莫西林耐药之间的关系。在本实验中,阿莫西林耐药菌株多为多重耐药菌株,这些菌株耐药的机制可能不仅仅是由于pbp1等与药物结合靶位相关的基因突变有关,还与细菌外排机制有关[7, 35-36]。
综上所述,本地幽门螺杆菌耐药较全国平均水平严重,并且双重耐药与多重耐药在总体耐药中所占比例较大,在临床治疗中应重视菌株的分离培养和耐药性检测。阿莫西林耐药菌株PBP1氨基酸存在多位点突变,与阿莫西林耐药相关的突变值得进行深入研究,以期建立快速筛查阿莫西林耐药菌,避免抗生素滥用。
利益冲突:无
引用本文格式:吴芳草,王琼,朱键,等. 贵阳地区351株幽门螺杆菌药物敏感性及pbp1多样性分析[J].中国人兽共患病学报,2019,35(7):587-593. DOI: 10.3969/j.issn.1002-2694.2019.00.092

