沙门氏菌CTX-M型超广谱β-内酰胺酶基因分型及变异研究
从20世纪80年代以来,在广谱头孢菌素等β-内酰胺类抗生素(尤其是广谱头孢菌素)的选择压力下,催生了新型β-内酰胺酶包括CTX-M、TEM、SHV、PER、VEB、BES、GES、TLA、SFO和OXA等,这类酶能够降解并赋予对这些抗生素的耐药性[1]。CTX-M以高度水解头孢噻肟、轻度水解头孢他啶为特征,水解活性可被β-内酰胺酶抑制剂如克拉维酸、舒巴坦和他唑巴坦等抑制[2];迄今为止,已发现至少109种CTX-M型及相关变体[3]。前期的研究中,我们分析了S.enteritidis(ST11克隆)、S.indiana(ST17克隆)、S.thompson(ST319)等常见沙门氏菌,发现这类菌的耐药与CTX-M有相关性;同时发现了起源于禽的ST17超级耐药克隆(ST17-XDR clone),并预测ST319有可能是下一个超级耐药克隆,CTX-M是这类超级耐药克隆出现的主要原因[4-5]。研究发现质粒在CTX-M耐药基因传递过程中有着重要作用[6]。通过对常见血清型肠炎沙门氏菌 (S.enteritidis)、印第安纳沙门氏菌(S.indiana)、汤卜逊沙门氏菌(S.thompson) 等CTX-M分子基因型别、脉冲场凝胶电泳(PFGE)溯源分析及CTX-M氨基酸位点变异情况,研究CTX-M各型别流行特征及在超级耐药克隆中的作用,为沙门氏菌耐药及感染控制提供参考。
1 材料与方法
1.1菌株来源 研究采用江苏及周围地区2013-2016年间猪、鸡基线调查、农贸市场食品及食品从业人员、哨点监测腹泻病人及食物中毒病人收集S.enteritidis、S.indiana、S.thompson等主要血清型菌株共197株,在前期的研究中,完成CTX耐药表型及相应CTX耐药基因的检测,对头孢噻肟耐药且携带CTX-M基因共有61株[4-5],包括S.indiana45株,S.enteritidis7株,S.thompson7株,鼠伤寒沙门氏菌(S.typhimurium)2株(表1)。
1.2 实验方法
1.2.1CTX基因的分群试验 参照已发表方法设计引物对CTX-M阳性株通过PCR试验进行分群试验[7]。PCR产物通过商业测序公司进行测序,序列通过与Comprehensive Antibiotic Resistance Database (CARD) (https://card.mcmaster.ca/analyze) 数据库BLAST 注释其CTX-M基因型。
1.2.2脉冲场凝胶电泳 参照中国细菌性传染病分子分型实验室监测网络 Pulse Net China 的沙门氏菌 PFGE 分子分型方法,用 SeaKem glod agarose 将沙门氏菌包埋,用XbaI进行酶切,把所得到的 DNA 片段用 Chefmapper 进行脉冲场凝胶电泳分型,最后将成像结果用Bionu-merics7.6软件聚类分析。
1.2.3基因测序 根据CTX-M分型及前期耐药克隆研究结果[4-5],选取9株S.indiana,2株S.thompson及1株S.enteritidis共12株进行全基因测序分析。菌株利用TAKARA DNA提取试剂盒提取DNA,由商业测序公司使用PacBio○RRS II System进行全基因组测序。序列拼接使用SPAdes-3.5.0软件对预处理后的Illumina 数据和PacBio数据进行拼接组装。所得基因序列用相应的数据库注释其结果。
2 结 果
2.1CTX基因分型 61株CTX阳性的菌株分为3个亚群6个型。主要为CTX-M-9亚群(33株),其次为CTX-M-1亚群(27株)。主要型别为CTX-M-65(29株)和CTX-M-55 (24株)。S.indiana携带这6种CTX-M基因型,主要为CTX-M-65及CTX-M-55基因型;S.thompson主要为CTX-M-65基因型;S.enteritidis主要为CTX-M-55基因型。 禽源分离株中检测到5种CTX-M基因型,主要为为CTX-M-65及CTX-M-55基因型(表1)。
2.2PFGE分型结果 根据PFGE分子图谱总体上分为4个基因簇 (cluster),对应相应血清型。按照聚类分析70%相似度分类,可以将CTX-M阳性菌株分为19个型。A2,B4,B8,B9,D2等为主要型。A2主要是S.enteritidis携带CTX-M-55型; B4,B8,B9主要是S.indiana,主要携带CTX-M-55型和CTX-M-65型;D2为S.thompson,携带CTX-M-65型(图1)。
表1 沙门氏菌不同血清型携带CTX-M分型结果
Tab.1 CTX-M genotypes in differentSalemonellaserotypes

血清型(No.)CTX-M群CTX-M型来源(No.)S.indiana(45)CTX-M-1群CTX-M-55禽源(14),人源(1),食源(1),猪源(2)CTX-M-79禽源(2),人源(1)CTX-M-9群CTX-M-14禽源(1),环境(1)CTX-M-27禽源(1)CTX-M-65禽源(20)CTX-M-64群CTX-M-123食源(1)S.enteritidis(7)CTX-M-1群CTX-M-55禽源(5),人源(1)CTX-M-9群CTX-M-65禽源(1)S.thompson(7)CTX-M-9群CTX-M-14食源(1)CTX-M-65禽源(6)S.typhimurium(2)CTX-M-9群CTX-M-65禽源(2)
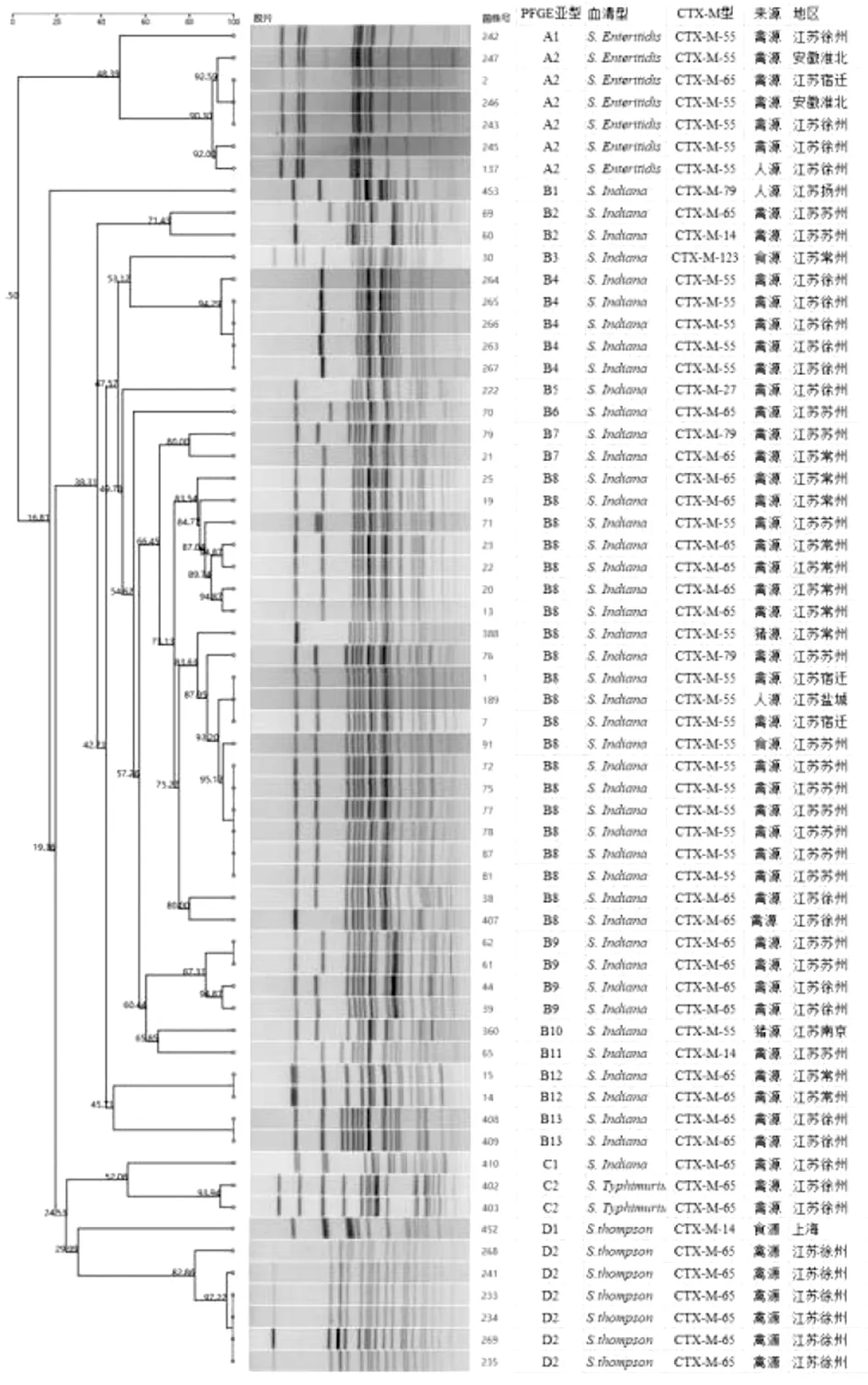
图1 61株CTX-M菌株PFGE聚类图及CTX-M基因型别与血清型、来源间关系Fig.1 Dendrogram displaying PFGE genotypes with CTX-M genotypes, serotypes and the sources of 61 isolates
2.3CTX-M基因型的氨基酸突变位点 12株全基因测序中,包括本研究中全部6种CTX-M型,CTX-M-55,CTX-M-79, CTX-M-14,CTX-M-27,CTX-M-65, CTX-M-123;其中9株S.indiana中含全部6种CTX-M型;2株S.thompson及1株S.enteritidis均为CTX-M-55型。与已发表的CTX-M-1型(GenBank: AMM70777.1)、CTX-M-9型 (NCBI Reference Sequence: WP_032489926.1)和CTX-M-64型(NCBI Reference Sequence: WP_032492042.1)分别属于CTX-M-1群、CTX-M-9群和CTX-M-64群的序列作为参照进行比较。
经比对发现CTX-M-1、CTX-M-55和CTX-M-79,CTX-M-9、CTX-M-14、CTX-M-27和CTX-M-65,CTX-M-64和CTX-M-123均含有291个氨基酸。在CTX-M-1群中,易变化的主要是4个氨基酸位点:1,117,143,298。在CTX-M-9群中,易变化的主要是3个氨基酸位点:80,234,242。在CTX-M-64群中,易变化的主要是12个氨基酸位点:70, 86, 89, 90,91,92,97, 102, 103, 121, 230, 233。同一CTX-M基因群中,基因发生突变的氨基酸位点是固定的(表2)。
3 讨 论
本研究中的CTX-M型超广谱β-内酰胺酶主要禽源出现,但在猪源、人源、食源以及环境均有涉及;出现了6个CTX-M基因型,主要为CTX-M-65和CTX-M-55。由于地域差异,不同地区出现的CTX-M的型别有所不同。国际上,澳洲、美国以CTX-M-15最为常见、拉丁美洲以CTX-M-2常见、欧洲西班牙以CTX-M-9和CTX-M-14常见[3,8-10]。 本文结果表明江苏及周围地区主要为CTX-M-65和CTX-M-55,与国内动物分离株的研究报道的结果类似[11-13]。禽源ST17克隆中携带多种CTX-M基因,以CTX-M-55和CTX-M-65为主,且S.thompson则也携带CTX-M-14和CTX-M-65; CTX基因型复杂且多变可能是超级耐药克隆形成并广泛流行的原因之一。
表2 CTX-M群的CTX-M基因型氨基酸突变
Tab.2 CTX-M amino acid serial variation in different CTX-M groups

CTX-M群CTX-M分型氨基酸位点17080868990919297102103117121143230233234242275289CTX-M-1群CTX-M-1H——————————D—S—————NCTX-M-55M——————————N—A—————DCTX-M-79M——————————N—A—————NCTX-M-9群CTX-M-9——A—————————————AD—SCTX-M-14——A—————————————VD—SCTX-M-27——A—————————————VG—SCTX-M-65——V—————————————VD—RCTX-M-64群CTX-M-64—P—QTQKQPPA—T—AV————CTX-M-123—A—KSEPNRKS—S—TT————
注:H:组氨酸、D:天冬氨酸、S:丝氨酸、N:天冬酰胺、M:蛋氨酸、A:丙氨酸、V:缬氨酸、G:甘氨酸、R:精氨酸、P:脯氨酸、Q:谷氨酰胺、T:苏氨酸、K:赖氨酸、E:谷氨酸;-:该位置的氨基酸相同
PFGE分子分型结果表明,CTX-M型别与血清型、地区来源及分子型密切相关。PFGE A2亚型中,是来自不同地区的S.enteritidis多数为CTX-M-55型;B4亚型中都是来源于同一地区ST17且都为CTX-M-55;最大的亚型B8中是来源于不同地区的ST17,CTX-M-65与CTX-M-55各半。D2亚型中都是来源于同一地区的ST319克隆的CTX-M-65。主要相同的分子型别中多数菌株为禽源,少数为人源,进一步佐证动物源性耐药基因是人源耐药基因的主要来源[4-5]。PFGE分子分型表明,血清型、地区和来源是影响CTX-M基因型多样性的重要因素。
根据全基因测序氨基酸比较结果显示,CTX-M型超广谱β-内酰胺酶氨基酸位点易突变,且同群的变易氨基酸的位点是相同的,但群之间易变异氨基酸位点是不同的;CTX-M氨基酸位点多变且同群CTX-M基因型即使1位氨基酸位点突变就导致基因型别发生改变[2-3]。研究表明,CTX-M同群的菌株对β-内酰胺类抗生素耐药状况基本相同,而不同群间的菌株对β-内酰胺类抗生素耐药差异较大[14-15],氨基酸突变导致CTX-M基因型及对β-内酰胺类抗生素抗药性的变化。
CTX-M基因大部分位于质粒上,不但可以进行水平传播还可以进行垂直传播[3,11]。位于质粒上的CTX-M基因遗传稳定性差,上游具有固定插入序列ISEcp1,下游插入序列较多,常见的为IS903、IS26等,使得CTX-M基因可在沙门氏菌与肠杆菌科之间以及沙门氏菌与其它种属细菌之间进行快速的传播,这是其水平传播的关键因素[12-13]。国内Wang W等及Wang J等分别报道了S.indianaST17克隆菌株C629及D90分别含有一个及多个携带有耐药基因的质粒。 其中pD90-1 (GenBank accession:CP022451) 携带CTX-M-65基因[16-17]。 本研究1株携带有CTX-M-27基因的典型ST17克隆菌株全基因测序(GenBank accession: CP031189,CP031190, CP031191)结果表明,该基因位于一小质粒上(GenBank accession: CP031191),其前后分子组成为: ISEcp1-blaCTX-M-27-IS903。以上结果表明,耐药质粒是超级耐药克隆产生的主要原因。
利益冲突:无
引用本文格式:余菊,徐红红,申永秀,等.沙门氏菌CTX-M型超广谱β-内酰胺酶基因分型及变异研究[J].中国人兽共患病学报,2019,35(7):594-598. DOI:10.3969/j.issn.1002-2694.2019.00.080

