急性胰腺炎合并广泛门静脉系统血栓形成及小肠坏死1例报道
魏倩倩,李亚军,孙小杰,孙 逊,孟祥伟
吉林大学第一医院 1.消化内科; 2.病理科,吉林 长春 130021
急性胰腺炎(acute pancreatitis,AP)是多种病因导致胰酶在胰腺内被激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应。临床表现以急性上腹痛、恶心、呕吐、发热和血胰酶升高等特点。依据是否存在并发症和器官功能障碍持续时间,2012年修订版亚特兰大分类标准将AP分为轻症、中-重症及重症。大多数轻症AP以胰腺水肿为主,临床多见,病情常呈自限性,预后良好,但中-重症AP及重症AP伴有多种并发症,其中,相对常见的是急性胰周液体积聚、胰腺假性囊肿、胰腺脓肿、胸腔积液等,而门静脉系统血栓形成(portal vein system thrombosis,PVT)相对少见的[1]。广泛PVT是指门静脉、脾静脉、肠系膜上静脉、肠系膜下静脉中有2条或2条以上血管血栓形成,造成管腔的完全或部分阻塞。在临床上更为罕见,病情较重的是AP合并广泛PVT及小肠坏死。现报道1例AP合并广泛PVT及小肠坏死的患者。
病例患者,女,48岁,因“持续性上腹部胀痛伴后背放射痛5 d”于2018年1月20日入院。入院前5 d患者无明显诱因出现上腹疼痛,呈持续性,向后背放射,伴恶心,未呕吐,未治疗,来我院行全腹CT平扫提示:(1)AP伴胰周液体积聚;(2)腹腔积液。既往:6年前因甲状腺肿瘤行甲状腺次全切除术;2年前因乳腺癌行保乳手术治疗;双下肢静脉血栓多年,未治疗;无胆石症病史;否认大量吸烟、饮酒史。查体:腹部平坦,上腹部压痛阳性,无反跳痛及腹肌紧张,全腹叩呈鼓音,肠鸣音2次/min。结合患者病史、体征及辅助检查,诊断为AP,给予禁食水、胃肠减压、抗炎、抑酸、抑酶、补液、对症治疗。经治疗后腹痛减轻,入院后第3天晨6∶20出现血便,为鲜红色,量约100 ml,检血常规:白细胞10.23×109L-1,中性粒细胞百分比0.92,血红蛋白122 g/L,血小板95×109L-1,便常规及潜血示潜血阳性,红细胞散在满视野,同时行全腹CT平扫+三期增强示:(1)门静脉主干(见图1)及肝内分支、肠系膜上静脉(见图2)及属支、脾静脉近端广泛栓子形成(见图3);(2)部分肠管壁厚、密度降低,扩张积液,分层状强化,暂倾向淤血水肿。结合病史及影像学检查,存在广泛PVT,且出现血便,考虑肠管可能存在坏死,建议急诊手术,同时检D-二聚体:15 815.00 μg/L,于胃肠外科行小肠切除术,小肠十二指肠吻合术,病理:小肠:小肠出血性梗死,肠壁全层见较多急慢性炎细胞浸润,部分肠黏膜坏死、脱落,黏膜下层高度水肿,血管增生、扩张、淤血,肠系膜血管扩张、淤血、出血伴血栓形成,散在急慢性炎细胞浸润,肠周淋巴结2枚反应性增生(见图4)。术后根据血管外科会诊给予克赛40 mg, 2次/d,皮下注射抗凝治疗, 经治疗后腹痛明显缓解,入院第33天诉腹部疼痛加重,行全腹CT平扫+三期增强示:(1)脾大;(2)门静脉主干及各分支、肠系膜上动静脉、左肾静脉、卵巢静脉血栓形成,伴胃周围侧支循环开放,门静脉海绵样改变;(3)肠系膜上动脉栓子形成(见图5)。继续克赛 60 mg,2次/d,皮下注射,利伐沙班 15 mg,2次/d, 口服抗凝治疗。入院第62天复查全腹CT平扫+增强提示:(1)脾大;(2)门静脉主干血栓形成,伴胃周围侧支循环开放,门静脉海绵样变性;(3)前片所示肠系膜上动脉栓子,此次未见显示。考虑治疗有效,继续克赛 40 mg,2次/d,皮下注射,利伐沙班 20 mg,2次/d,口服,后停用利伐沙班。入院第105天行胃镜检查未见食管、胃底静脉曲张。患者因一般状态差,多部位血栓合并多种疾病,病情较重,住院周期较长,于2018年5年17日出院。电话随访该患者,出院后继续应用利伐沙班20 mg,1次/d,抗凝治疗,目前仍在抗凝治疗中。
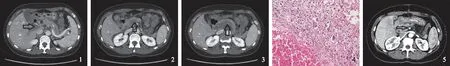
注:箭头所指为血管血检。
讨论AP是一种炎症性疾病,常合并多种并发症。胰腺炎的血管并发症是导致发病率和死亡率的主要原因[2]。约1/4的AP患者出现血管并发症,其中静脉血栓占主要部分[3]。相关研究[4]表明,AP合并内脏静脉血栓的发病率为1.8%~36.5%,最常累及脾静脉,其次为门静脉,肠系膜上静脉最少见。血栓形成与AP的严重程度有关,大多数中-重症及重症AP合并PVT形成,轻症AP则相对较少见[5]。国外几个单中心研究表明,AP合并PVT的发病率为1.8%~24.0%[1]。而AP合并广泛PVT及小肠坏死更为罕见。
门静脉系统的解剖特点促使它容易形成血栓,其起止端均为毛细血管,且门静脉主干及较大的分支无瓣膜结构,血流速度相对缓慢,两侧压力较小,多种因素可导致血栓形成。胰腺和门静脉系统的解剖学关系导致AP时易累及门静脉系统及分支。门静脉是一条短而粗的静脉干,长约6.8 cm,宽约1.3 cm,大多由脾静脉与肠系膜上静脉汇合而成,而脾静脉紧密毗邻胰体尾部,外源性压迫及炎症导致血管损伤等因素可引起脾静脉栓塞,从而造成门静脉系统血流动力学发生改变,进而影响到门静脉。最新研究[1,4,6]指出,胰周局部压迫和血管周围直接炎症过程是AP合并PVT的主要原因,多数患者伴有急性胰周积液或胰腺坏死(伴或不伴感染),胰周积液或坏死组织对血管的直接损伤,其中,管壁增厚、血管内膜受损、血管痉挛、管腔狭窄是导致血栓形成的主要原因。
AP的临床表现和血栓形成的表现往往相混淆,特异性症状和体征的缺失为AP合并PVT的诊断带来一定的困难。血清D-二聚体异常升高对判断血栓形成有预测价值。静脉血栓的检出主要依靠超声和影像学检查。彩色多普勒超声诊断血栓形成的灵敏度、特异度分别为66%、93%[7],常作为首选。增强CT既可以评估胰腺坏死的程度和范围,又可以对血管结构、管壁及邻近的肠系膜进行评估,是最常用的检查手段。CT血管成像能够准确定位,发现血管内和血管外的异常,对小的壁内血栓和肠系膜水肿显影良好[1],其灵敏度、特异度较高,达90%及以上[7]。磁共振血管成像诊断PVT的灵敏度、特异度几乎为100%[8-9],是诊断胰腺疾病及其周围血管走形最先进的手段。本例患者无腹痛加重,但出现血便,且血清D-二聚体显著升高,行全腹CT平扫+三期增强发现广泛PVT及肠管可能存在坏死,行手术治疗,术后明确小肠坏死。
相关文献表明,AP合并静脉血栓形成的自发再通率可达30%[10]。在治疗方面,目前,缺少一个得到广泛认可的治疗方案,仍以个体化治疗策略为主。对于近期形成的且无抗凝禁忌的PVT,早期应用抗凝治疗既不增加出血并发症的风险,又安全有效[11-12]。若在确诊1周内应用抗凝治疗,血栓再通率达到69%,而两周内治疗,则下降到25%[2]。而对于新形成的和抗凝治疗无效的PVT,可以应用溶栓治疗,常静脉全身给药或局部溶栓。必要时还可行门静脉介入或手术治疗[1]。急性肠系膜上静脉血栓形成会导致肠坏死,从而进一步发展为肠穿孔、败血症,甚至多功能脏器衰竭,必须及时进行手术切除坏死肠管。所以,越早治疗,预后越好。本例患者确诊门静脉系统血栓形成及肠坏死后立即行小肠切除术,术后立即给予克赛、利伐沙班抗凝治疗。后复查全腹CT+三期增强提示肠系膜上动静脉、左肾静脉、卵巢静脉血栓未见显示,考虑抗凝治疗有效。
AP合并PVT会导致门脉高压,进而引起胃底或食管静脉曲张出血,也可导致肝衰竭、肠坏死及腹水形成。本例患者出院前全腹CT平扫+增强示脾大,门静脉主干血栓形成,伴胃周围侧支循环开放,门静脉海绵样改变,行胃镜未见食管、胃底静脉曲张。AP合并广泛PVT及小肠坏死是相对罕见的,却较为严重。所以,早发现、早诊断、早治疗,可改善患者的预后。本病例提示我们对于AP腹痛加重或出现血便的患者,应及时检查血清D-二聚体,早期行腹部增强CT检查,以免发生漏诊,造成严重后果。

