PAX-5在Barrett食管、食管腺癌中的表达及其对食管腺癌细胞侵袭和转移的影响
朱晓文, 孙传涛, 李胜保, 许为佳
湖北省十堰市太和医院 1.消化内科; 2.肾内科,湖北 十堰 442000
近年来,随着生活水平的不断提升及人口的老龄化,食管腺癌的发病率呈逐年上升的趋势[1],有文献报道,Barrett食管被认为是食管腺癌发生、发展过程中的关键步骤,预防或靶向干预Barrett食管病变可预防食管腺癌的形成[2]。目前缺乏从“食管上皮黏膜-Barrett食管-食管腺癌”诊断和治疗的有效靶点。目前基因组学的发展为肿瘤的治疗提供了新的思路,肿瘤相关抑癌基因丢失是肿瘤形成的重要因素[3]。PAX-5作为新发现的抑癌基因,其异常表达与多种实体肿瘤密切相关,如:乳腺癌、非小细胞肺癌、胃癌中异常表达[4-6],但其在食管腺癌中的致病机制尚未见报道。
1 资料与方法
1.1 一般资料选取十堰市太和医院2015年8月至2017年8月就诊的胃食管反流病患者的病理资料。纳入标准:(1)所有诊断Barrett食管的患者符合中华医学会消化病学分会制订的《Barrett食管诊治共识(2011修订版)》的诊断标准[7];(2)正常食管上皮和食管腺癌的病理诊断由本院2位高年资病理科医师诊断。排除标准:临床资料不全者、合并严重糖尿病和(或)心脏病疾病、转移性肿瘤、既往胃肠道手术治疗史。
1.2 主要试剂蛋白提取试剂盒购自北京普利莱科技公司(批号:180778),PAX-5单克隆抗体购自美国Abcam公司(批号:ab109443),二抗GAPDH购自上海碧云天科技公司(批号:3123455),PAX-5引物由上海生工生物工程股份有限公司合成及提供(批号:1822834),RNA提取试剂盒购自美国应用生物系统公司,逆转录试剂盒购自美国Promega公司(批号:4512386)。消化内镜购自奥林巴斯公司,蛋白凝胶系统成像仪购自美国Lightools公司,实时荧光定量PCR仪购自美国应用生物系统公司。SEG1和OE33是食管腺癌细胞系,CP-C和CP-D是Barrett食管细胞系,Het-1A是正常食管上皮细胞系,所有细胞系均来源于ATCC细胞库。
1.3 组织RNA和蛋白提取所有细胞系、组织RNA和蛋白提取按照试剂盒说明书操作[8]。提取的RNA和蛋白测浓度后置于-80 ℃冰箱中保存。
1.4 细胞转染PAX-5过表达载体购自广州辉骏生物科技有限公司。质粒转染方法和步骤同文献[8-9],活性状态下的食管腺癌细胞OE33种于6孔板中,离心半径13.5 cm,1 800 r/min离心5 min,消化离心并重新种板,当细胞融合度为80%~90%时进行细胞转染。转染载体:Lipofectamine 2000(美国通用应力公司),细胞转染48 h后收集实验组和对照组细胞进行相应的功能实验。
1.5 Transwell实验迁移实验:收集上述过表达PAX-5和对照pcDNA3.1(+)的食管腺癌细胞OE33,离心半径13.5 cm,1 800 r/min离心5 min,消化离心,倒置显微镜下计数,并分别取实验组和对照组细胞(4×103个),种于Transwell小室上室,下室加入质量浓度为150 g/L胎牛血清1640约700 μl,置于细胞孵育箱中继续培养,待20 h后取出小室,固定、染色、计数(显微镜下随机5个视野),计数并评价细胞迁移能力。侵袭实验:在Transwell小室上室中加入基质胶(无血清1640∶基质胶=1∶7)混匀后加入,将加入基质胶的小室放入细胞孵育箱中2~4 h,待基质胶凝固后进行侵袭实验,侵袭实验步骤基本同细胞迁移实验。
1.6 qRT-PCR核酸检测仪进行总RNA定量检测,所取的细胞和组织的OD260/OD280比值为1.8~2.2。按照5×PrimeScriptRTMaster Mix试剂盒说明书逆转录为cDNA,以及Promega试剂盒中说明书进行扩增。qRT-PCR上机总反应体系如下:95 ℃ 5 min;95 ℃ 30 s;55 ℃ 30 s;72 ℃ 30 s;25 ℃ 10 min。其中内参循环23个,目的循环32个。引物序列:PAX-5-F:5′-CACTCTCAGTGAGATGTTCC-3′,PAX-5-R:5′-TGCTCTCATTATGATAGCTG-3′;E-cad-F:5′-TACAC
TGCCCAGGAGCCAGA-3′,E-cad-R:5′-TGGCACCAGTGTCCGGATTA-3′;Vim-F:5′-GACCAGCTAACCAACGACAA-3′,Vim-R:5′-GTCAACATCCTGTCTGAAAGAT-3′;N-cad-F:5′-CGAATGGATGAAAGACCCATCC-3′,N-cad-R:5′-GGAGCCACTGCCTTCATAGTCA-3′;Occ-F:5′-GGAGTCCGCAGTCTTACGAG-3′,Occ-R:5′-TCTGGAGGACCTGGTAGAGG-3′。
1.7 免疫蛋白印迹实验提取上述组织蛋白质,采用BCA法测定蛋白浓度。配制分离胶和浓缩胶,分别取45 μg/孔进行凝胶电泳,转膜,质量浓度为50 g/L脱脂牛奶的TBST封闭1 h后,加入PAX-5一抗以及内参GAPDH,4 ℃冰箱过夜。第2天常温下复温,TBST液洗膜二抗封闭液稀释室温下孵育2 h,显色剂显色、成像仪曝光,并用Quantity One软件分析蛋白灰度值,以目的蛋白条带灰度值与内参GAPDH比值表示相对表达差异。
1.8 统计学分析采用SPSS 17.0统计学软件进行分析。各实验独立重复3次,两独立样本数据间的比较采用双侧t检验;多组数据的比较采用方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PAX-5在食管腺癌细胞和组织中表达首先通过qRT-PCR验证PAX-5在人正常食管上皮细胞、Barrett食管细胞、食管腺癌细胞中的相对表达;结果显示:与正常食管上皮细胞Het-1A相比,PAX-5 mRNA在SEG1、OE33、CP-C和CP-D中表达下调,在食管腺癌细胞系OE33中表达最低(见图1A,P<0.001);因此本实验采用OE33为研究对象,进行细胞功能实验。进一步分析人正常食管组织、Barrett食管组织、食管腺癌组织中的相对表达,我们发现:与人正常食管组织相比,PAX-5 mRNA在Barrett食管组织、食管腺癌组织中表达下调,且在食管腺癌组织中表达水平最低(P<0.001,见图1B)。因此,我们推测PAX-5在食管腺癌中表达下调,可能作为潜在的抑癌基因参与“食管上皮黏膜-Barrett食管-食管腺癌”这一病理生理过程。

注:与Het-1A比较,*P<0.001。图1 PAX-5 mRNA在人食管细胞和组织表达情况 A:qRT-PCR中PAX-5 mRNA在Barrett食管和食管腺癌细胞系中表达下调;B:qRT-PCR中PAX-5 mRNA在Barrett食管组织、食管腺癌组织中表达下调Fig 1 Expression of PAX-5 mRNA in esophagus cells and tissues A: the expression of PAX-5 mRNA in Barrett’s esophagus and esophageal adenocarcinoma cell lines was down-regulated by qRT-PCR; B: the expression of PAX-5 mRNA in Barrett’s esophagus and esophageal adenocarcinoma tissue was down-regulated by qRT-PCR
2.2 PAX-5蛋白在食管腺癌中表达免疫蛋白印迹实验进一步验证PAX-5蛋白在人正常食管组织、Barrett食管组织、食管腺癌组织中的相对表达,结果显示(见图2A):与人正常食管组织相比,PAX-5蛋白在Barrett食管组织、食管腺癌组织中表达下调,在食管腺癌组织中表达水平最低,Quantity One软件分析蛋白灰度值分析发现,其表达差异有统计学意义(P<0.001)。免疫蛋白印迹实验在配对的Barrett食管和食管腺癌中进行了验证(见图2B~2C),发现配对组织中与人正常食管黏膜上皮相比,PAX-5蛋白在Barrett食管、食管腺癌中表达下调,Quantity One软件分析蛋白灰度值分析发现,其表达差异有统计学意义(P<0.001)。
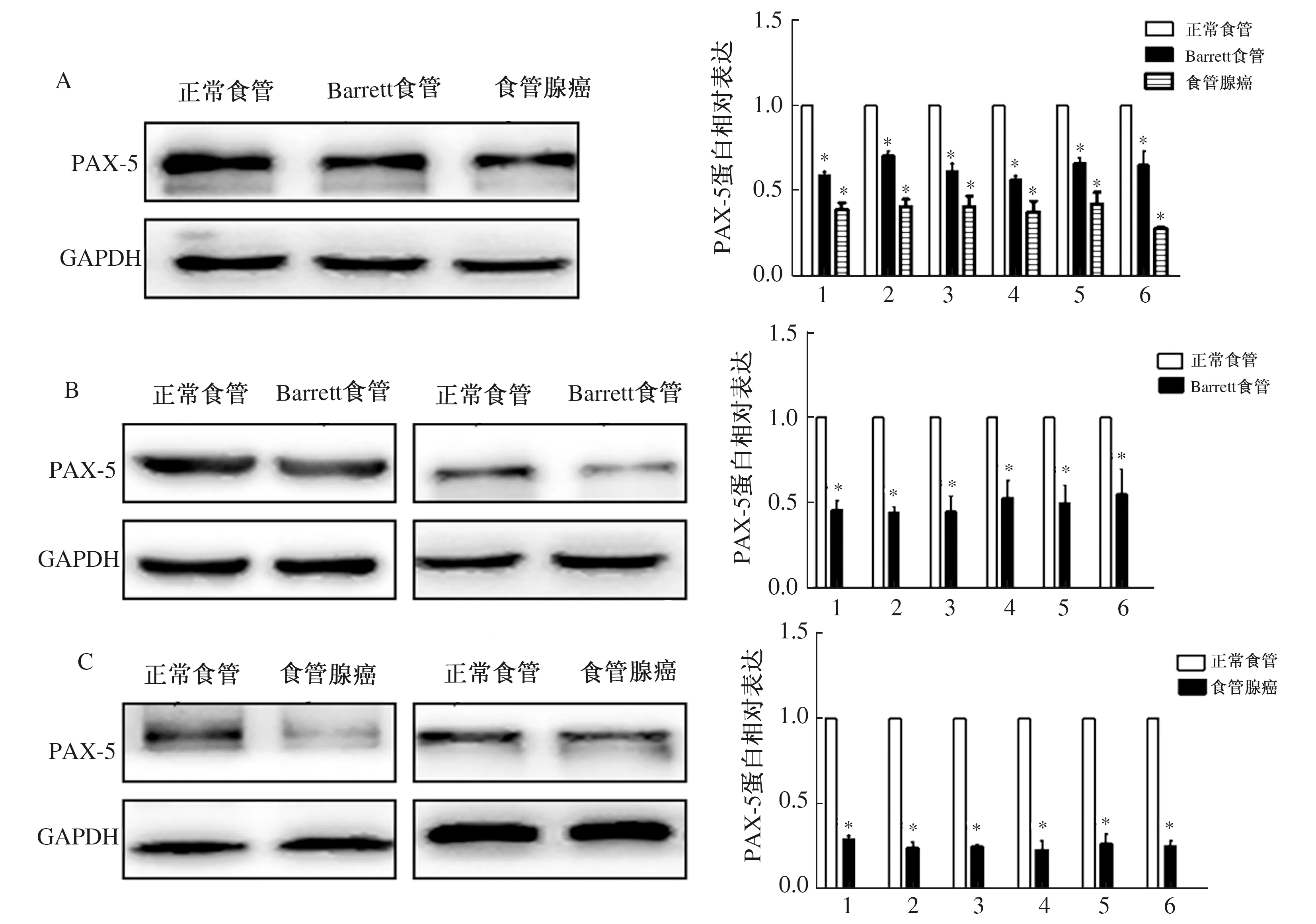
注:与正常食管比较,*P<0.001。图2 PAX-5蛋白在人食管组织表达情况 A:Western blotting中PAX-5蛋白在Barrett食管、食管腺癌中表达下调;B:在配对Barrett食管中,PAX-5蛋白表达下调;C:在配对食管腺癌中,PAX-5蛋白表达下调 Fig 2 Expression of PAX-5 protein in esophagus tissues A: the expression of PAX-5 proteins in Barrett’s esophagus and esophageal adenocarcinoma was down-regulated by Western blotting; B: in paired Barrett’s esophagus, the expression of PAX-5 proteins was down-regulated; C: in paired esophageal adenocarcinoma, the expression of PAX-5 proteins was down-regulated
2.3 PAX-5 mRNA在食管腺癌中的表达及与临床病理参数的关系PAX-5在食管腺癌组织中的表达水平与患者年龄、性别、复发及血管侵犯均无关(P>0.05),而与肿瘤T分期(P=0.015)和局部淋巴结转移情况(P=0.0029)呈正相关,与肿瘤分化程度呈负相关(P=0.0021),即肿瘤分化程度越低,PAX-5表达水平越高(见表1)。
2.4 PAX-5抑制食管腺癌细胞OE33迁移和侵袭通过Transwell实验检测PAX-5对细胞迁移和侵袭的影响,结果显示:对照组PAX-5中迁移细胞数为(231±33)个,实验组PAX-5中迁移细胞数为(427±41)个;对照组PAX-5中侵袭细胞数为(212±29)个,实验组PAX-5中侵袭细胞数为(118±24)个。过表达PAX-5组的OE33细胞迁移和侵袭到小室底部的细胞明显减少(P<0.001,见图3)。
2.5 PAX-5抑制食管腺癌细胞OE33的上皮-间质转化分别取实验组和对照组中细胞,提取总RNA和总蛋白,采用qRT-PCR法和免疫蛋白质印迹检测上皮-间质转化相关分子E-cadherin、N-cadherin、Vimentin和Occuludin的表达水平。结果显示,PAX-5过表达后,Vimentin、N-cadherin的蛋白和mRNA表达水平降低,E-cadherin、Occuludin的蛋白和mRNA表达水平升高(见图4,P<0.001)。
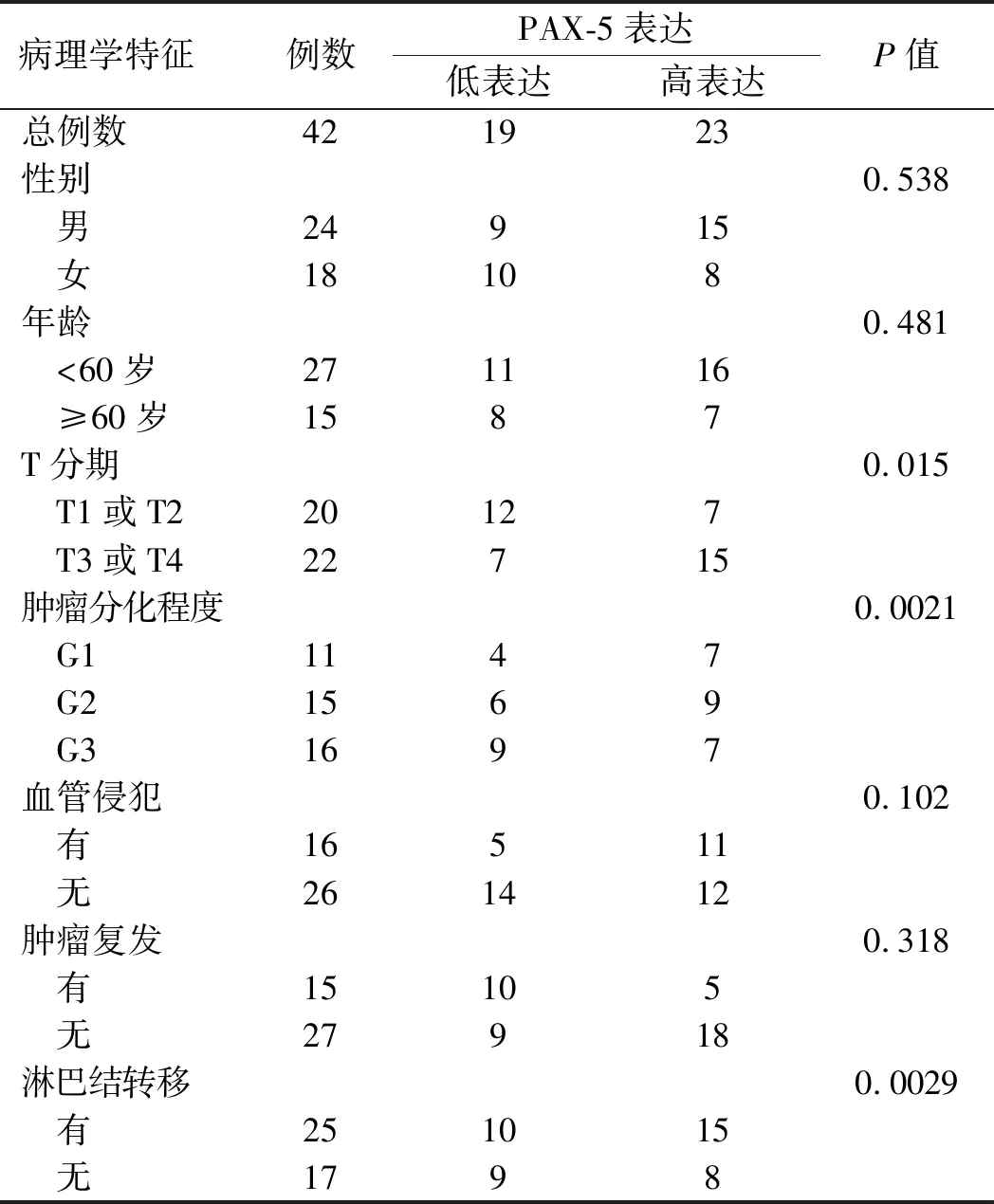
表1 PAX-5的表达与临床病理特征的关系Tab 1 Correlation between PAX-5 expression and clinicopa-thological features of esophageal adenocarcinoma
3 讨论
食管腺癌的发生通常是“食管上皮黏膜-Barrett食管-食管腺癌”的病理性变化过程,其发生、发展由众多基因异常调控,既往文献[10]报道显示,食管慢性炎症、长期胃食管反流氧化应激损伤导致p53、p16等基因异常缺失。基因组结构变化导致非整倍性染色体发生,通常见于重度异型增生;异型细胞多克隆无限扩增直至肿瘤形成。目前食管癌的发病人群高,多数患者确诊时已是Ⅲ期和Ⅳ期患者,因此食管癌的死亡人数和死亡率高;发现具有诊断性意义的靶基因具有重要的临床意义[9]。
PAX-5主要表达B细胞相关的核转录因子,在早期B细胞分化发育过程中具有重要的调控作用。文献报道,PAX-5α编码B细胞特异激活蛋白(B cell lineage specific activator protein,BSAP),仅在B细胞系特异性表达;PAX-5β在B细胞、睾丸、中枢神经系统中转录表达[11];研究发现,PAX-5α和PAX-5β基因启动子区频发甲基化[12]。PAX-5能通过结构域结合调控160种以上的下游基因,在B细胞的发育过程中涉及B细胞的免疫功能、受体信号传导、转录调控及迁延黏附等[13]。研究显示,在人类某些肿瘤中,如:胃癌、肝癌、乳腺癌、非小细胞肺癌中,PAX-5表达缺失,通过进一步研究发现,PAX-5起着抑制肿瘤生成的作用[4-5,12-13]。MŽIK等[14]发现,PAX-5在正常人肝脏组织中正常表达,而肝癌细胞株中表达沉默或缺失83%(10/12);PAX-5在原发性肝细胞癌表达水平显著低于邻近的正常组织,PAX-5的表达缺失与启动子甲基化密切相关;恢复沉默肝癌细胞株抑制细胞的PAX-5表达,在体外能诱导细胞的凋亡,并抑制裸鼠移植瘤的生长。同时也有文献报道,PAX-5是细胞增殖、凋亡、表型转变的分子标志物;在细胞凋亡中起着某些特定的作用[12-14]。PALMISANO等[15]报道,PAX-5α和PAX-5β存在2个不同的CpG位点,由2个不同的启动子转录形成,在细胞分化和胚胎发育中编码着起重要作用的不同转录因子;酸性亚硫酸盐测序发现,每个CpG位点高甲基化与转录沉默密切相关。同时通过甲基化检测发现,在乳腺和肺癌中甲基化率高达65%,PAX-5β基因在乳腺癌和肺癌中的表达沉默与CD19基因表达缺失密切相关。因此,PAX-5可能作为一个候选抑癌基因参与了部分实体肿瘤的发生、发展。
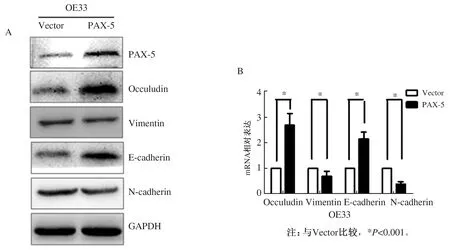
图4 过表达PAX-5对食管腺癌上皮-间质转化相关蛋白的影响 Fig 4 Effects of overexpression of PAX-5 on related proteins of epithelial mesenchymal transformation in esopheal adenocarcinoma
目前PAX-5在食管腺癌的病理生理过程尚未见报道,本实验通过qRT-PCR和免疫蛋白印迹实验发现:与正常食管黏膜相比,PAX-5 mRNA和蛋白在Barrett食管和食管腺癌中表达下调,差异有统计学意义;同时在配对的Barrett食管和食管腺癌组织中,通过qRT-PCR和免疫蛋白印迹实验发现:与正常食管黏膜相比,PAX-5 mRNA和蛋白在配对组织中表达下调,差异有统计学意义。因此,我们推测PAX-5在Barrett食管和食管腺癌中表达下调,可能作为潜在的抑癌基因参与“食管上皮黏膜-Barrett食管-食管腺癌”这一病理性进展过程,可能是食管腺癌早期诊断的靶基因。通过对PAX-5在食管腺癌的临床病理分期研究发现,其表达与肿瘤T分期和局部淋巴结转移情况呈正相关,与肿瘤分化程度呈负相关,即肿瘤分化程度越低,PAX-5表达水平越高,提示预后不良;与肿瘤的远处转移有密切的关系。而上皮-间质转化是一种进化上保守的发育程序,与肿瘤的转移密切相关,通过增强细胞的迁移、侵袭和抗凋亡刺激来赋予癌细胞的转移特性。在癌细胞中,上皮-间质转化由来自肿瘤微环境的细胞外刺激异常调节,包括生长因子和炎性细胞因子,以及瘤内物理应激,如低氧。进一步通过Transwell实验发现,PAX-5基因在实验组细胞中的迁移和侵袭能力明显下调,提示PAX-5基因可能作为功能性抑癌基因参与到食管腺癌的病理性进程[9]。为进一步明确PAX-5抑制食管腺癌细胞OE33迁移和侵袭的分子机制,通过免疫蛋白印迹实验和qRT-PCR实验发现,恢复表达PAX-5基因后,Vimentin、N-cadherin的蛋白和mRNA表达水平降低,E-cadherin、Occuludin蛋白和mRNA表达水平升高,和文献报道相一致。
综上所述,PAX-5基因在食管腺癌中表达下调,可能作为功能性抑癌基因参与“食管上皮黏膜-Barrett食管-食管腺癌”的病理性变化过程。

