肿瘤免疫治疗引起免疫相关不良反应的若干思考*
周毅,孙建国
(陆军军医大学第二附属医院肿瘤科,重庆 400037)
近年来,已经获批的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs),包括CTLA-4抑制剂(如:Ipilimumab)、PD-1单抗(如:Nivolumab,Pembro lizumab)及PD-L1单抗(如:Atezolizumab,Durvalumab)等,已经在肺癌、黑色素瘤、肾癌、头颈部肿瘤、结直肠癌等多种恶性肿瘤中取得令人瞩目的临床疗效,成为继手术、化学治疗(化疗)、放射治疗(放疗)和靶向治疗后的重要手段。与此同时,这些药物不可避免地带来免疫相关不良反应(immue-related adverse events,irAEs),虽然大多数irAEs为1或2级,但仍有0.5%~18.0%的3级以上的不良反应发生并可能导致患者死亡[1]。针对irAEs的监测、分级、治疗等全程管理,欧洲肿瘤内科学会(European Society for Medical Oncology,EMSO)[2]、美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)[3]、美国国立综合癌症网(National Comprehensive Cancer Network,NCCN)以及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)都已制定各自的指南。然而,对于irAEs仍有许多未能涉及到或存在争议的话题,比如,irAEs的判定尚无明确的标准,在鉴别诊断方面也有诸多争议,不同ICIs之间irAEs发生机制和严重度有明显不同,如何对irAEs进行预测从而提前防范是未来重要的探索领域。在此,笔者在本文就常见irAEs、少见irAEs、未确定irAEs、联合治疗irAEs、irAEs作用机制以及生物标志物等方面的研究现状进行点评,并提出若干思考和未来探索方向。
1 常见irAEs
irAEs可能广泛累及多个器官,常见部位包括皮肤、胃肠道、肺、肝脏、骨骼肌、内分泌系统等,不同药物发生率不一致,见表1[4],不同器官发生的中位时间也不同,一般来说皮肤出现irAEs的时间较早,在2~3周;然后是胃肠道的不良反应,腹泻、结肠炎发生在6~7周;肝炎、转氨酶升高在8~12周;内分泌系统irAEs发生稍晚,在9~10周;肺炎在不同瘤种中出现时间不同,非小细胞肺癌发生肺炎的起始时间较早,约为8周,而黑色素瘤治疗约为20周[5]。针对irAEs的治疗以糖皮质激素为主,对于严重病例给予其他免疫抑制剂及血浆置换等治疗,其治疗原则见表2。对于常见irAEs,在临床工作中需要注意:①大多数情况下,通过及时关注、全面复查和密切监测,比较容易及早发现常见irAEs,通常情况下按照各指南推荐的方案给予早期、足量、足疗程的治疗,大多irAEs可逆,预后较好。②对于少数靶器官受损的irAEs,需要特殊处理对待。如内分泌系统irAEs,即使出现3~4级的甲状腺功能减退或亢进,在激素替代及有效对症治疗时,无需停止ICIs;免疫性间质性肺炎是临床较为棘手的irAEs,需要注意的是,参照EMSO irAEs指南[2],糖皮质激素的使用剂量要比其他靶器官irAEs剂量要大,可以加倍使用,48 h无缓解时,需要增加其他免疫抑制剂,如英夫利昔或麦考酚酯(MPA)。③在irAEs治疗过程中,需要注意密切监测,1级的不良反应可能升级到2~3级,治疗原则和治疗用药要随之更新。④糖皮质激素使用初期是最为关键的时间,对于少数糖皮质激素治疗不敏感的病例,如果激素治疗48~72 h效果不佳者,应及时求助专科医生会诊,及早增加免疫抑制剂英夫利昔或麦考酚酯,必要时进行血浆置换。
2 少见irAEs
少见不良反应可见于神经系统、胰腺、肾脏、血液系统、心血管系统、眼等器官。由于发生率低,3级以上的不良反应非常罕见,因此文献大多以个案的形式报道。接受抗CTLA-4单抗治疗的患者神经系统irAEs发生率为3.8%,接受抗PD-1单抗治疗的患者为6.1%,3或4级及以上irAEs发生率低于1%。心血管系统irAEs发生率小于1%,表现为非特异性胸痛、心悸、心律不齐、急性心力衰竭、心电图异常等。肾脏irAEs表现为间质性肾炎,大多患者常无症状,严重患者表现为少尿、血尿、水肿等,发生率小于2%。对于少见irAEs,需要关注以下几点:①部分不良反应一旦发生则可能非常严重,甚至威胁生命,如神经系统irAEs(重症肌无力、格林-巴利综合征、无菌性脑膜炎、脑炎、横贯性脊髓炎等[6])、血液系统irAEs(自身免疫性溶血性贫血、再生障碍性贫血、免疫性血小板减少症、获得性血友病等[7])。需要特别注意心血管系统irAEs,已经报道多例患者因心肌炎死亡[8],按ASCO指南即使是1级心脏毒性就需要暂停ICIs。②由于发生率低,很多临床科室及临床医生没有足够的治疗经验,稍有迟疑或诊治耽误,将带来不可挽回的伤害。因此,在临床治疗过程中遇到不明原因的病情变化或症状,应该引起高度重视,给予经验性治疗,并请相关科室进行多学科联合会诊,排除其他原因,一旦认为与免疫治疗相关,应及早采取相应措施,以避免患者遭受更大的伤害。③在免疫治疗过程中,应当定期监测各项指标,尤其是心肌病损、神经系统病损,及早发现,及早治疗。
表1 常见irAEs发生率
Tab.1RateofcommonirAEs%
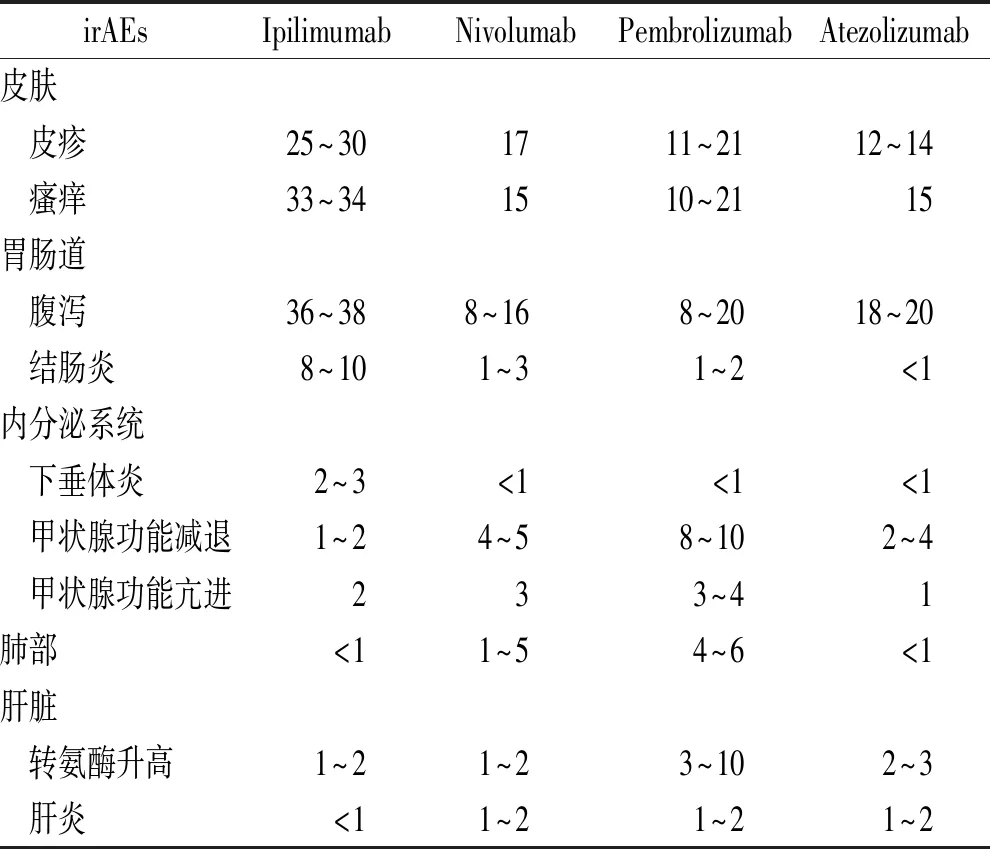
irAEsIpilimumabNivolumabPembrolizumabAtezolizumab皮肤 皮疹25~301711~2112~14 瘙痒33~341510~2115胃肠道 腹泻36~388~168~2018~20 结肠炎8~101~31~2<1内分泌系统 下垂体炎2~3<1<1<1 甲状腺功能减退1~24~58~102~4 甲状腺功能亢进233~41肺部<11~54~6<1肝脏 转氨酶升高1~21~23~102~3 肝炎<11~21~21~2
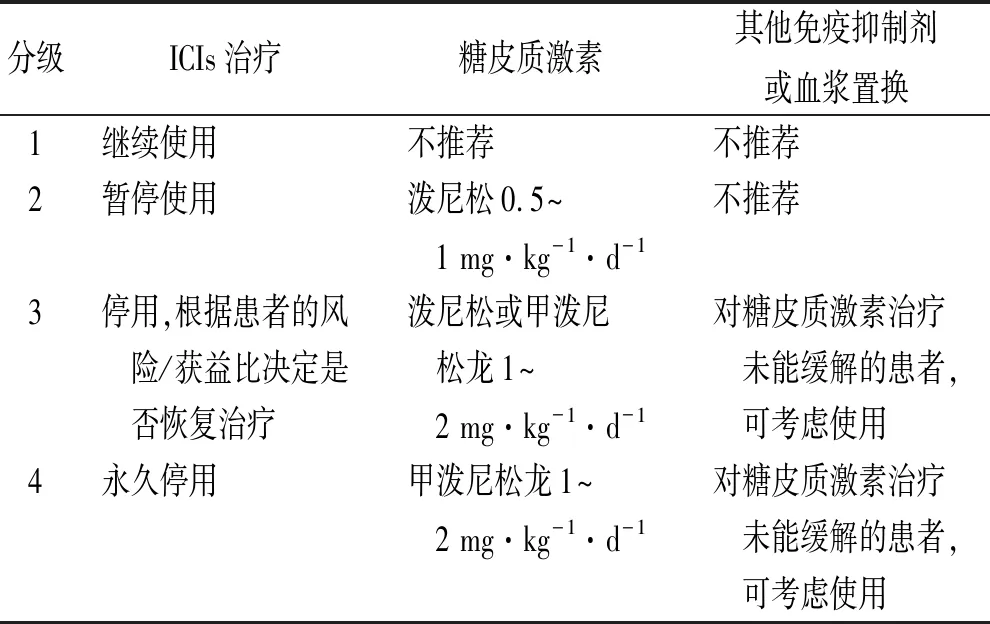
表2 irAEs的分级治疗原则
3 未确定的irAEs
ICIs通过抑制CTLA-4、PD-1/PD-L1,激活效应T细胞,可能导致T细胞过度活化。由于T细胞分布广泛,导致不良反应可能发生在全身任何组织、器官,使用过程中的任何时间,表现形式多种多样。ICIs在临床上广泛应用的时间并不长,前期的研究可能更重视疗效,对不良反应并没有全面的认识。临床研究入组人群均是体力评分较好的患者,对体力评分差、临床试验时排除的特殊人群的用药观察并不够,随着应用人群的增加,很可能出现复杂的不良反应,加之越来越多的进口ICIs和国产ICIs在国内市场,每种药物具有各自的特性和不良反应表现,因此,在临床应用ICIs过程中出现的不良反应可能不能确定是否为irAEs。当遇到这种情况,应注意以下几点:①为了患者的安全,应停用ICIs,按照irAEs处理,给予糖皮质激素诊断性治疗,对于糖皮质激素抵抗的患者,可考虑给予免疫球蛋白、Infliximab、血浆置换等治疗。②及时请专科医生会诊,协助诊断及制定治疗方案。③对于未确定为irAEs的患者,通过治疗恢复以后,如果条件允许,还可以继续应用ICIs,并通过继续治疗分析不良反应的病因。
4 联合治疗irAEs
对未经选择的患者,ICIs的有效率约为20%,联合放疗、化疗和靶向药物将是未来发展的方向,多个联合治疗的Ⅲ期临床研究取得了很好的疗效,如KEYNOTE-407研究Pembrolizumab联合化疗显著延长晚期肺鳞癌患者的生存期,Pacific研究显示Ⅲ期非小细胞肺癌患者同步放化疗后给予Durvalumab巩固治疗,显著延长患者的无进展生存期和总生存期[9]。联合治疗给患者带来生存获益,但不良反应的发生率也随之增加,同时也带来多方面的困扰。首先,联合治疗的各种方式可能存在相似的不良反应,由于病因的不同,对不良反应的治疗方案并不一致,因此临床医生对治疗方案的选择面临极大的挑战。例如,Pembrolizumab联合化疗治疗肺癌,6%患者发生结肠炎,而化疗也可能导致结肠炎;放疗治疗与免疫治疗序贯或者联合治疗肺癌过程中患者可能出现肺炎,放疗、ICIs、感染均可导致肺炎。因此联合治疗irAEs的病因和治疗方案需要仔细鉴别,以及多学科会诊。其次,在联合治疗的过程中,还需要考虑联合治疗的顺序不同导致不良反应的差异,如肺癌治疗中如果同时应用放疗和免疫治疗,肺炎的发生率可能会增加;而先放疗再使用ICIs,放疗可能释放新抗原,增加免疫应答,增强ICIs的疗效。而且,联合用药过程中出现严重的不良反应,又将面临的问题是如何停用治疗药物,是先停用一种药物观察后再决定是否停用其他药物,还是停用所有药物?如果决定先停用一种药物,是应该停用ICIs,还是其他药物?如果恢复治疗,什么时间恢复,应该恢复哪一种药物,是否需要减量?这些问题都没有明确的答案,需要在临床工作中根据具体情况作出合适的处理。
5 irAEs的机制
机体免疫系统对抗原的识别和清除保持平衡,CTLA-4、PD-1/PD-L1是免疫系统重要的抑制性分子,能够抑制效应T细胞的活化。CTLA-4作用于T细胞活化的早期阶段,PD-1/PD-L1抑制效应阶段的活化T细胞,因此它们功能的丧失可能导致自身免疫性疾病。ICIs治疗肿瘤的目的是让肿瘤诱导失常的微环境免疫正常化[10],但是治疗过程中也可能出现免疫细胞的功能失常,产生irAEs。目前是什么原因导致irAEs的发生尚不清楚,但是在患病组织中发现有大量T细胞浸润。根据临床前研究的结果,可能的机制包括抑制CTLA-4、PD-1或者PD-L1后,效应T细胞的过度激活、调节性T细胞功能降低、巨噬细胞和中性粒细胞的毒性作用、γ干扰素和肿瘤坏死因子的大量释放以及B细胞产生的抗体等[11]。在临床ICIs治疗过程中,irAEs累及器官广泛,不同患者的表现各异,产生的机制更加复杂,因此还需要进一步深入探索肿瘤免疫和irAEs产生的机制。在临床工作中,需要关注irAEs的如下特点:①不同类型药物的作用机制不同,导致irAEs存在差异,总的来说CTLA-4单抗的irAEs要大于PD-1/PD-L1单抗,而且随着药物剂量的增加,CTLA-4单抗的不良反应增加更加显著。不同类型的ICIs联合应用可导致严重irAEs的发生率增高、发生的时间提前。②不同类型的肿瘤,同一种ICI的irAEs发生率不同,如PD-1单抗治疗肺癌和黑色素瘤患者,消化道和皮肤毒性发生irAEs,肺癌比黑色素瘤患者发生可能更低,发生肺炎可能性更高。PD-1单抗和PD-L1单抗不良反应总体差异不大,但是PD-L1单抗的免疫性肺炎发生率低于PD-1单抗。③不同厂家同一类型的药物irAEs也不同,如PD-1单抗SHR-1210反应性毛细血管扩张症发生率很高,而其他PD-1单抗则很少见[12]。由于严重irAEs导致治疗中断甚至危及患者生命,希望将来能够根据irAEs产生的机制设计ICIs药物,减少不良反应的发生,例如药物不含产生ADCC的片段,活化的免疫细胞不攻击正常细胞等。
6 irAEs的生物标志物
总的来说,目前的研究证据级别不高,所得到的分子还不足以作为预测irAEs的生物标志物,它们之间是伴随现象、还是因果关系并不清楚,因此还需要更多前瞻性的研究来证实。临床前研究模型发现很多irAEs标志物,还有待临床研究证实。对临床医生来说,与基础研究紧密结合,在循证医学的实践中不断验证基础研究的成果,才有可能得到真正有意义的标志物。基因组学和蛋白质组学的发展为发现新的生物标志物提供了技术基础。未来,基因测序和蛋白质组学研究得到大数据,并通过生物信息学和分子网络分析把各种与irAEs直接和间接相关的分子组成预测模型,有可能更准确的预测irAEs。
7 结束语
随着ICIs的广泛应用,irAEs的发生将涉及更多人群,严重的不良反应可能导致治疗中断甚至威胁患者生命,因此必须高度重视。对irAEs的研究才刚刚起步,还有很多工作要做。随着研究的深入,相信既能够通过生物标志物选择ICIs的优势人群,也可以预测irAEs的发生人群,并通过个体化的治疗,达到减轻患者不良反应并延长患者生存的目标。

