超声波辅助碱法提取鸡副产物和大豆粕混合蛋白工艺优化
潘风光 侯力箫 王 莹 张 婷 刘静波
(吉林大学食品科学与工程学院 营养与功能食品研究室 长春130062)
肉鸡加工过程中产生了大量的头、骨、内脏和羽毛等形式的固体副产物,这些废弃物的不当处理造成了环境污染、疾病和有效生物资源的流失[1]。然而,鸡副产物中含有数量可观的生物分子,如蛋白质、酶和脂类等。这些分子可以回收,加工成在微生物学、医学、制药、人类营养和化妆品等领域有价值的产品[2-3]。大豆粕是大豆制油后的副产物,油脂含量低,而含有大量的蛋白质[4-5]。蛋白胨是由蛋白质水解而制得的产品,作为培养基的重要原料之一,是微生物赖以生存、生长发育和繁衍后代的主要营养氮源[6]。将鸡副产物和大豆粕进行混合后提取蛋白,不仅可以丰富所制备蛋白胨的成分,也简化了生产工艺。综合利用农产品加工过程中的副产物,提取高含量的蛋白质,是解决蛋白质资源日益短缺问题的重要途径[7-8]。
目前对于蛋白提取的基本方法主要是碱溶酸沉法,然而传统碱液提取法存在处理时间长,提取率低等问题。近年来超声波技术在天然物质提取方面显示出强大的优越性[9]。本文使用超声波辅助碱溶法提取原料中的蛋白质,通过单因素试验初步确定各影响因子,采用Plackett-Burman 设计筛选出对蛋白提取率具有显著性影响的因素,通过响应面优化试验,最终得出蛋白提取的最佳工艺,为后期酶解制备蛋白胨提供可行性依据。
1 材料与方法
1.1 材料与设备
脱脂鸡副产物(干重比,鸡骨∶鸡内脏=3 ∶1),其中鸡内脏干重比,鸡心∶鸡肝∶鸡胗=1∶1∶1,吉林德惠食品有限公司;大豆粕,吉林德惠食品有限公司;考马斯亮蓝R-250(分析纯),北京鼎国昌盛生物技术有限公司;氢氧化钠、盐酸、硫酸、硼酸、硫酸铜、甲基红、溴甲酚绿等均为分析纯级。
CP124C 型电子分析天平,奥豪斯仪器有限公司;FK-A 型组织捣碎机,江苏金坛市金城国胜实验仪器厂;FW-400A 型倾斜式高速万能粉碎机,北京中兴伟业仪器有限公司;JJ-1 型精密定时电动搅拌器,江苏省金坛市荣华仪器制造有限公司;JY92-2D 型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;UV-2550 型紫外可见分光光度计,日本岛津仪器有限公司;CR20B2 型高速冷冻离心机,日本Hitachi 公司;K1100 型全自动凯氏定氮仪,海能仪器;FD-1C-50 型真空冷冻干燥机,北京博医康实验仪器有限公司;标准筛,绍兴海特仪器有限公司。
1.2 试验方法
1.2.1 超声波辅助碱法提取混合蛋白的单因素试验设计 将鸡副产物与大豆粕分别粉碎过筛,按一定干重比混合,所得蛋白简称为CBSM(Chicken by-product and soybean meal)按照一定的液固比与不同浓度的氢氧化钠溶液混合,使用超声波细胞粉碎机辅助提取,调节功率与间隔时间,在一定温度下搅拌提取一定时间。提取结束后以1 000 r/min 离心10 min,去除油层和沉淀,所得提取液用于测定比较各因素对蛋白提取率的影响[10],各因素水平取值如下:
鸡副产物与大豆粕的干重比 (g/g):1∶3,1∶2,0∶1,1∶1,1∶0,2∶1,3∶1;CBSM 粒度 (目):10,20,40,60,80,100,120;碱液质量浓度(g/100 mL):0.1,0.5,1.0,1.5,2.0,2.5,3.0;液固比:1∶1,5∶1,10∶1,15 ∶1,20∶1,25∶1,30∶1;超声功率(W):100,150,200,250,300,350,400;提取温度(℃):30,35,40,45,50,55,60;提取时间(h):0.5,1.0,1.5,2.0,2.5,3.0,3.5;提取次数(次):1,2,3,4,5,6,7。
对以上8 个因素分别进行5 水平的单因素试验,测定比较不同单因素对蛋白提取率的影响,利用Plackett-Burman 设计筛选出对指标有显著影响的因素继续进行最陡爬坡试验,确定提取CBSM 蛋白的最优工艺。本试验采用SPSS 软件的one-way ANOVA 进行各因素的显著性分析,当P<0.05 时,差异显著。
1.2.2 Plackett-Burman(PB)试验设计
1.2.2.1 Design-Expert8.0 设计PB 试验[11-12]根据单因素试验结果,每个因素取较优的两个水平,采用Design-Expert8.0 软件选用N=12,进行PB试验设计。对CBSM 原料干重比(X1)、CBSM 粒度(X2)、碱液质量浓度(X4)、液固比(X5)、超声功率(X7)、提取温度(X8)、提取时间(X10)、提取次数(X11),以及3 个虚拟变量X3、X6、X9进行筛选,每个因素取高水平(+1)和低水平(-1)两个水平,其中高水平取低水平的1.5 倍,以蛋白提取率为指标,按表1设计试验。

表1 Plackett-Burman 试验设计因素及水平表Table 1 Variables and levels in the Plackett-Burman experimental design
1.2.2.2 最陡爬坡试验设计 根据最陡爬坡路径可以确定各试验因素的最适条件范围,根据PB 试验结果,由主要影响因素的偏回归系数的正负值来确定各因素的爬坡方向,再根据效应值的大小确定步长,进而可以快速接近最大响应值[13-14]。
1.2.2.3 响应面优化设计 在PB 试验和最陡爬坡试验的基础上,以蛋白提取率为指标,分别考察碱液质量浓度(A)、超声功率(B)、提取温度(C)3个因素对蛋白提取率的影响,试验因素及水平表如表2所示。
1.2.3 CBSM 蛋白质的分离纯化
1.2.3.1 CBSM 蛋白等电点的确定[15]最优条件下提取蛋白后,所得提取液分装于50 mL 离心管中,每管30 mL,用1 mol/L 的HCl 调节各管pH 值分别为2.0,2.5,3.0,3.5,4.0,4.5,5.0,沉淀析出后于4 ℃冰箱中静置2 h,再经过4 000 r/min 离心10 min,去上清液,沉淀后的蛋白质用透析袋置于蒸馏水中,每隔2 h 将蒸馏水更换一次,24 h 后停止,脱盐处理完毕[16]。将沉淀干燥、粉碎,测定产物的蛋白含量。

表2 Box-Behnken 试验因素及水平表Table 2 Factors and levels in Box-Behnken
1.2.3.2 提取液及沉淀物中蛋白含量的测定 采用凯氏定氮法测定CBSM 混合原料及沉淀物中蛋白含量。采用考马斯亮蓝法测定提取液中蛋白含量[17],绘制出蛋白质标准曲线。

2 结果与分析
2.1 蛋白质标准曲线结果
图1为考马斯亮蓝法测定蛋白质标准曲线,其回归方程为y=0.0053x+0.0141,相关系数R2=0.9965,OD595nm与标准蛋白浓度之间线性关系良好。用同样的方法稀释待测蛋白提取液,测定吸光度,通过标准曲线回归方程计算得到蛋白含量[18]。
2.2 超声波辅助碱法提取CBSM 混合蛋白单因素试验结果
2.2.1 CBSM 原料干重比对蛋白质提取率的影响图2为鸡副产物与大豆粕干重比例对蛋白提取率影响结果。其中干重比0∶1 表示只使用大豆粕为原料,干重比1∶0 表示只使用鸡副产物为原料。从中可以看出,将鸡副产物与大豆粕进行混合提取所得提取率显著高于使用单一原料时的结果。随着鸡副产物与大豆粕干重比的增加,提取效果增强,且当干重比达到3∶1 时,蛋白提取率最大,可能是由于鸡副产物中蛋白质含量要高于大豆粕中蛋白质含量。因此,选择干重比为3∶1 作为后续PB 试验的低水平。
2.2.2 CBSM 粒度对蛋白质提取率的影响 由图3可知,随着CBSM 粒度的增加,蛋白提取率先上升后下降。可以看出粒度从10 目到80 目时,由于颗粒细度减小,接触面积增大,提取率明显增大,且80 目和100 目的结果差异不显著(P>0.05);超过100 目后,蛋白溶出率降低,可能由于粒度过小,使其它可溶性物质一起析出,降低了溶液中蛋白含量。综合考虑,选择过80 目筛作为后续PB 试验的低水平。

图1 考马斯亮蓝标准曲线Fig.1 Standard carve of Coomassie brilliant blue

图2 CBSM 原料干重比对蛋白提取率的影响Fig.2 Effects of different CBSM dry weight ratio on extraction of protein
2.2.3 碱液质量浓度对蛋白质提取率的影响 由图4可知,当碱液质量浓度由0.1 g/100 mL 增大到1.0 g/100 mL 时,蛋白提取率随之提高,且结果差异显著(P<0.05)。质量浓度从1.0 g/100 mL 增大到1.5 g/100 mL 过程中,提取率虽稍有下降,但不显著,超过1.5 g/100 mL 后,提取率显著下降,这可能是由于高质量浓度的碱液使蛋白质特性发生改变,氢键断裂;也可能由于产生美拉德反应,提取物中非蛋白杂质增多,从而降低了蛋白的提取率[19]。因此,选择碱液质量浓度为1.0 g/100 mL 作为后续PB 试验的低水平。
2.2.4 液固比对蛋白质提取率的影响 由图5可以看出,蛋白提取率随液固比的增大而不断提高,从1∶1 上升到15∶1 时,其效果差异显著(P<0.05),超过15 ∶1 后,虽然结果仍旧上升,但差异不显著(P>0.05),蛋白质提取率基本趋于平稳。这可能是由于蛋白在溶液中的溶解度有限,溶液饱和提取率也无明显提升,而且液固比过大,会增加提取后废水处理步骤,造成原料浪费。综合考虑,选择液固比为15∶1 作为后续PB 试验的低水平。
2.2.5 超声功率对蛋白质提取率的影响 由图6可知,蛋白提取率随超声功率的增大先上升后下降,且功率在300 W 时,提取率最高,各水平提取效果差异显著(P<0.05)。当功率超过300 W 时,提取率下降,这可能是过高的超声功率会对原料蛋白产生一定的破坏作用,从而降低了蛋白提取率。因此,选择超声功率300 W 作为后续PB 试验的低水平。
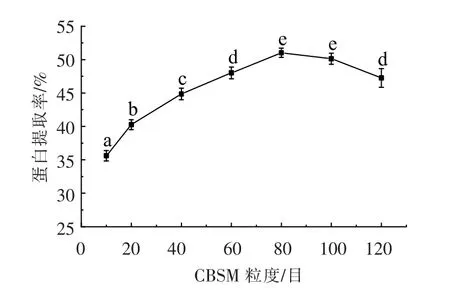
图3 CBSM 粒度对蛋白提取率的影响Fig.3 Effects of different CBSM particle size on extraction of protein

图4 碱液质量浓度对蛋白提取率的影响Fig.4 Effects of different lye mass concentration on extraction of protein

图5 液固比对蛋白提取率的影响Fig.5 Effects of different liquid-solid ratio on extraction of protein

图6 超声功率对蛋白提取率的影响Fig.6 Effects of different ultrasonic power on extraction of protein
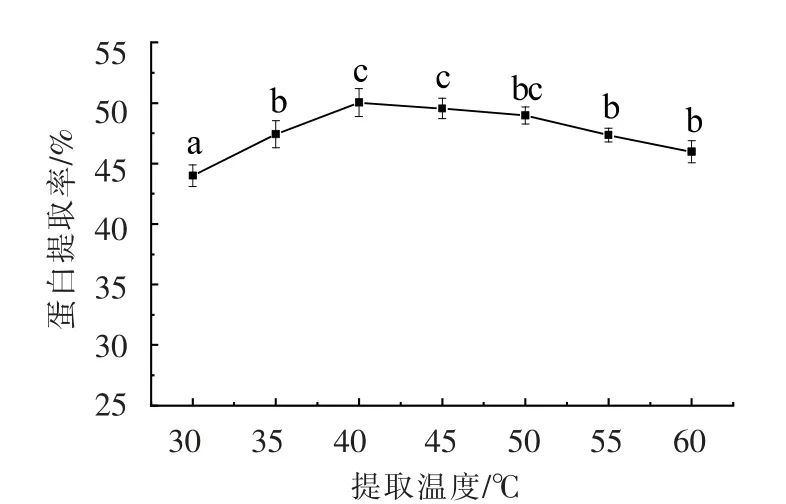
图7 提取温度对蛋白提取率的影响Fig.7 Effects of different extraction temperature on extraction of protein

图8 提取时间对蛋白提取率的影响Fig.8 Effects of different extracting time on extraction of protein

图9 提取次数对蛋白提取率的影响Fig.9 Effects of different extracting times on extraction of protein
2.2.6 提取温度对蛋白质提取率的影响 由图7可以看出,蛋白提取率随提取温度的升高先增大后减小,这是由于升温可以加速分子间的运动,使其结构展开,促进物质产生沉淀,蛋白质可以快速地从原料中分离出来,增大蛋白提取率。在40 ℃时提取率达到最大;超过45 ℃后,提取率下降,因为高温会导致蛋白质变性,直接影响蛋白得率。综上所述,选择提取温度为40 ℃作为后续PB 试验的低水平。
2.2.7 提取时间对蛋白质提取率的影响 由图8可以看出,提取时间在0.5~2.0 h 之间,提取率逐渐增大,且在2.0 h 时达到最大。随着提取时间的延长,原料中蛋白逐渐溶解出来,然而过长的提取时间会导致提取溶液中的溶剂损失,造成液固比减少,使溶液pH 发生变化,蛋白质变性,蛋白提取率降低[20]。综上所述,选择提取时间2.0 h 作为后续PB 试验的低水平。
2.2.8 提取次数对蛋白质提取率的影响 由图9可知,提取多次后蛋白提取率会增大,且提取2 次后的效果显著高于提取1 次的效果,然而超过2次后,蛋白提取率的变化不显著(P>0.05),浪费人力物力。由于提取次数与液固比直接相关,优化其它条件可显著减少试验重复次数,因此,从降低成本的角度考虑,选择提取次数1 次作为后续PB 试验的低水平。
2.3 超声波辅助碱法提取CBSM 混合蛋白的PB 试验结果与分析
2.3.1 Plackett-Burman(PB)试验结果 以蛋白提取率(M,%)为指标,考察CBSM 原料干重比(X1)、CBSM 粒度(X2)、碱液质量浓度(X4)、液固比(X5)、超声功率(X7)、提取温度(X8)、提取时间(X10)、提取次数(X11),以及3 个虚拟变量X3、X6、X9对蛋白提取率的影响,从中筛选出显著因素,PB 试验结果如表3所示。
表4为PB 试验方差分析表,从中可以看出,该模型F 值为29.53,P=0.0090<0.01 极显著,R2=0.9875,表示相关性良好,校正决定系数R2Adj=0.9540,表示95.40%试验数据的变异性可用此模型解释。此模型变异系数CV=3.95%,表示该PB试验的可信度和精确度较好,模型方程能够较好地反映出试验值的真实性。精密度=12.2448>4,视为合理,拟合度高,故可用该模型分析影响蛋白提取率的显著因素[14]。由表4可知,超声功率(X7)和提取温度(X8)对蛋白提取率的影响极显著(P<0.01),碱液质量浓度(X4)对蛋白提取率的影响显著(P<0.05),且显著性X7>X8>X4,即超声功率>提取温度>碱液质量浓度,而其它5 个因素对蛋白提取率的影响不显著(P>0.05),因此,选择碱液质量浓度、超声功率、提取温度3 个因素作为下一步试验的关键因素。

表3 Plackett-Burman 试验设计及结果Table 3 The design and corresponding results of Plackett-Burman experimental

表4 Plackett-Burman 试验变量方差分析Table 4 Analysis of variance for Plackett-Burman experimental design
2.3.2 最陡爬坡试验结果 由表5可以确定最陡爬坡试验方向。在显著性因素中,X4、X7对蛋白提取率的影响是正效应,取值应逐渐增大,而X8的影响是负效应,取值应逐渐减小;在非显著性因素中,X11的影响是正效应,应取其高水平,而X1,X2,X5,X10的影响是负效应,应取其低水平。根据Plackett-Burman 试验结果初步确定非显著因素的水平分别为:原料干重比为3∶1、CBSM 粒度为80目、液固比为15 ∶1、提取时间为2 h、提取次数为2 次。
根据表6结果可以看出,随着碱液质量浓度和超声功率逐渐增大,提取温度逐渐减小,蛋白提取率呈先升高后降低的趋势。试验号3 的蛋白提取率最高,表明最大响应值区域在第3 号试验附近。因此选择碱液质量浓度0.725 g/100 mL、超声功率365 W、提取温度42 ℃为中心值,进行响应面设计试验。
2.3.3 响应面设计结果与分析
2.3.3.1 Box-Behnken 试验结果 通过Design Expert 8.0 软件设计Box-Behnken 试验,得到蛋白提取率(Y)与碱液质量浓度(A)、超声功率(B)、提取温度(C)3 个因素之间的关系,见表7。得到二次多项式回归模型方程:Y=54.66-1.01A-0.69B+0.80C-0.77AB+1.41AC+1.27BC-2.00A2-3.46B2-3.84C2。

表5 Plackett-Burman 试验中因素的正负相关性分析Table 5 Analysis of negative and positive correlation of factors in Plackett-Burman experimental

表6 最陡爬坡试验设计及结果Table 6 Experimental design and results of the steepest ascent experiment

表7 Box-Behnken 试验设计及结果Table 7 Box-Behnken design and corresponding experimental results
对模型进行方差分析,结果见表8。该模型P<0.0001,表示二次方程模型极显著。失拟项F 值=0.081,P=0.9666>0.05,表示失拟项相对于绝对误差不显著,可取[21]。图10反映了蛋白提取率的实际值与预测值之间的相关性,且该模型R2=0.9750,表明97.50%的数据可用该方程解释,实际值与预测值之间的残差呈正态分布,具有良好的线性分布。R2Adj=0.9429,说明拟合度良好,可用于蛋白提取分析。由表8可以看出,因素A 极显著,而因素B 和因素C 显著,二次项都极显著,相互项AB 不显著,AC 极显著,BC 显著。

表8 Box-Behnken 试验方差分析Table 8 Analysis of variance of Box-Behnken design

图10 蛋白提取率实测值与预测值之间的相关性及残差的正态分布Fig.10 The correlation of the actual and predicted values of protein extraction rate and the normal distribution of residuals
2.3.3.2 响应面交互作用及响应曲面分析 通过响应曲面分析可以直观地看出试验中不同因素对蛋白提取率的影响,以及两两因素相互作用对蛋白提取率的影响[16]。各因素的交互作用的等高线图以及3D 立体图如图11~图13所示。
从图11可以看出碱液质量浓度和超声功率之间交互作用对蛋白提取率的影响不显著,曲线比较平缓,且增大碱液质量浓度或是超声功率,蛋白提取率先增后减,变化幅度很小。碱液质量浓度和超声功率分别在0.70~0.75 g/100 mL 和360~370 W 之间时,蛋白提取率达到最大值。
由图12可以看出提取温度对应的响应曲面坡度比较陡峭,碱液质量浓度变化对蛋白提取率的影响较大,且曲线出现最高点,表明碱液质量浓度和提取温度之间交互作用对蛋白提取率的影响极显著。碱液质量浓度和提取温度分别在0.70~0.75 g/100 mL 和40~44 ℃之间,蛋白提取率可以达到最大值。
图13显示出超声功率和提取温度之间的交互作用对蛋白提取率的影响比较显著,且超声功率和提取温度分别在360~370 W 和40~44 ℃之间时,蛋白提取率可以达到最大值。

图11 Y=f(A,B)等高线图及响应曲面立体图Fig.11 The contour map plot and response surface plot for Y=f(A,B)

图12 Y=f(A,C)等高线图及响应曲面立体图Fig.12 The contour map plot and response surface plot for Y=f(A,C)

图13 Y=f(B,C)等高线图及响应曲面立体图Fig.13 The contour map plot and response surface plot for Y=f(B,C)
2.3.3.3 模型验证试验 通过软件分析得出超声波辅助提取CBSM 混合蛋白的最佳条件:碱液质量浓度0.71 g/100 mL,超声功率363.35 W,提取温度42.21 ℃,得到的蛋白提取率为54.82%。结合实际操作,选择碱液质量浓度为0.70 g/100 mL,超声功率为365 W,提取温度为42 ℃,采用上述优化条件提取蛋白,平行测定3 次,最终得出蛋白提取率的实际值分别为53.32%,55.54%,55.02%,平均值为54.63%,与预测值十分吻合。
2.4 CBSM 蛋白等电点的确定
按照干重比为3∶1,准确称取适量的脱脂鸡副产物和大豆粕分别粉碎过筛后进行混合,用0.70 g/100 mL 的氢氧化钠溶液配成液固比为15 ∶1 的样品溶液,于42 ℃下超声碱溶提取2 h,其中超声功率为365 W,间隔时间30 s,在此条件下提取2 次后,以1 000 r/min 的转速离心10 min,去除油层和沉淀,得到提取液。
取7 个50 mL 的离心管,每管中各加入30 mL 上述提取液,用1 mol/L 的HCl 调节各管pH值分别为2.0,2.5,3.0,3.5,4.0,4.5,5.0,待沉淀析出后于4 ℃冰箱中静置2 h,再经过4 000 r/min 离心10 min,去上清液,沉淀后的蛋白质用透析袋放置于蒸馏水中,每隔2 h 将蒸馏水更换1 次,24 h后,脱盐处理完毕[16]。真空冷冻干燥、粉碎、过筛,称取沉淀物质量,计算沉淀率。此操作重复测定3次,计算平均值,以pH 值为横坐标,所得沉淀率为纵坐标,绘制柱状图,确定出沉淀率最大时的pH 值即为该CBSM 蛋白的等电点,测定结果见图14。
蛋白质在等电点时蛋白会析出,出现浑浊或产生沉淀,由图14可以看出,随着pH 值的变化,CBSM 蛋白的沉淀率也相应变化,蛋白沉淀率在pH 值为4.0 时出现最大值,达到70.07%。因此,CBSM 蛋白的等电点(PI)为4.0,将提取液在该pH值条件下沉淀,测定提取后的蛋白含量为62.64%。
3 结论
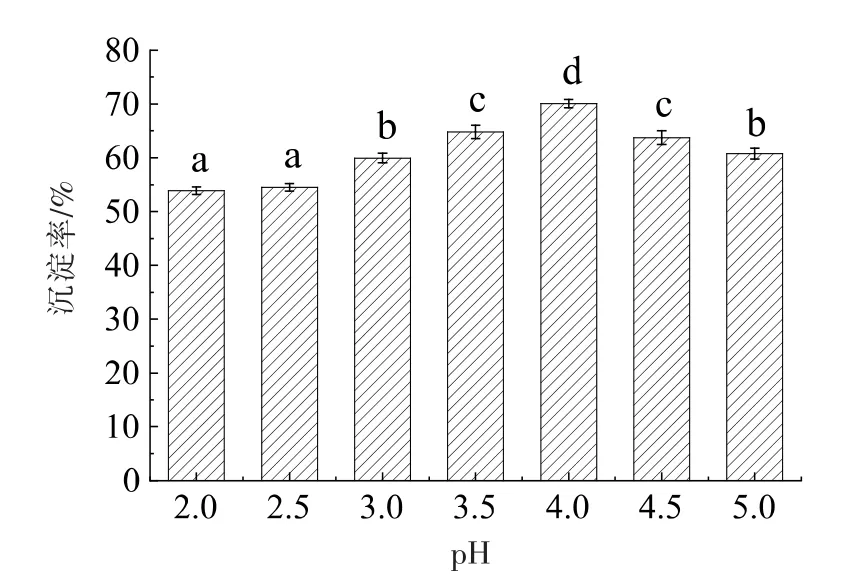
图14 CBSM 蛋白等电点测定结果Fig.14 The determined results of CBSM protein isoelectric point
采用超声波辅助碱法提取鸡副产物-大豆粕混合蛋白中蛋白质的工艺。本试验利用Plackett-Burman 设计筛选出影响蛋白提取率的显著性因素为:碱液质量浓度、超声功率和提取温度。利用响应面分析对超声波辅助碱法提取CBSM 蛋白工艺进行优化,以蛋白提取率为响应值,确定最优提取条件:原料干重比为3∶1、CBSM 粒度为80 目、碱液质量浓度为0.70 g/100 mL、液固比为15∶1、超声功率为365 W、提取温度为42 ℃、提取时间为2 h、提取次数为2 次。该条件下经过3 次平行试验,所得蛋白提取率为54.63%。经测定该蛋白在pH 值为4.0 时达到等电点,沉淀后所得提取蛋白含量为62.64%。

