右美托咪定对多塞平诱导PC12细胞凋亡的影响
楚云超 黄科昌 王中伟 葛维鹏 杜梅青 林艳
(1东营市胜利油田中心医院疼痛科,山东 东营 257034;2潍坊医学院附属医院麻醉科)
多塞平局部应用时可产生较强的脊髓神经麻醉、外周神经阻滞作用,并且在神经病理性疼痛治疗中发挥重要作用〔1~3〕。但以往的研究表明,鞘内应用多塞平在一定浓度范围内有依赖性的神经细胞毒性〔4,5〕,并证实Caspase-3介导的细胞凋亡在多塞平诱导的神经细胞凋亡中具有一定作用〔6〕,线粒体途径介导的而非死亡受体途径介导的细胞凋亡可能是多塞平的脊髓神经毒性机制之一。右美托咪定作为具有镇静、镇痛、抗焦虑、抑制交感神经兴奋性及减少应激反应的高选择性的α2肾上腺素受体激动剂,可加强局部麻醉药脊髓麻醉和外周神经阻滞的效果〔7,8〕;另一方面,右美托咪定可抑制原代培养脊髓神经细胞凋亡和减少发育期大鼠脊髓神经细胞损伤〔9〕,但是,其对多塞平诱导的神经细胞凋亡是否也有保护作用,目前少见报道。本研究探讨右美托咪定对多塞平致神经毒性的影响。
1 材料与方法
1.1 试剂与主要仪器 试剂:DMEM/F12培养基(Gibco,美国);胎牛血清(Hyclone,美国);多塞平(Sigma,美国);噻唑蓝(MTT)检测试剂(碧云天,中国江苏南通);右美托咪定(中国江苏恒瑞医药有限公司);细胞凋亡检测试剂盒(Invitrogen,美国);PC12细胞(大鼠的肾上腺髓质嗜铬细胞瘤细胞,购自中国上海市生命科学研究院细胞库)。
主要仪器:酶标仪(赛默飞,中国);光学倒置显微镜(Nikon,日本);流式细胞仪(BD,美国);细胞离心机(上海市安亭科学仪器有限公司,中国);水平流超净工作台(无锡易纯净化设备有限公司,中国)。
1.2 方法
1.2.1 细胞培养 PC12细胞培养在含12%胎牛血清、100 U/ml青、链霉素的高糖DMEM培养基中,放置于5%CO2细胞培养箱中培养,培养箱温度设置为37℃。
1.2.2 MTT法检测细胞存活率 将PC12细胞接种于96孔培养板中,于5%CO2培养箱中培养,每孔加入约含5×105个细胞的200 μl细胞悬液,按20个孔接种。次日PC12细胞贴壁后分为4组,每组设置5个复孔。正常对照组PC12细胞不做任何处理;多塞平组PC12细胞加入多塞平,浓度为120 μmol/L;右美托咪定组加入右美托咪定,浓度为1 μmol/L,多塞平+左美托咪定组同时加入浓度为120 μmol/L的多塞平和1 μmol/L的右美托咪定。然后将PC12细胞放置于5% CO2培养箱继续培养,温度为37℃。处理培养24 h后向每孔中加入5 g/L MTT溶液20 μl,继续培养4 h。去除培养液后,每孔加入150 μl二甲基亚砜(DMSO),充分振荡使结晶溶解后于酶标仪上测定各孔570 nm处的吸光度值。依据OD值计算细胞存活率(实验组OD值/正常对照组OD值×100%)。
1.2.3 倒置显微镜下观察细胞形态、流式细胞仪检测细胞凋亡率 处理细胞并使其浓度为(5~10)×105个/ml,以每孔2 ml将PC12细胞接种于12个孔中,分为两组,每组设置3复孔,待PC12细胞贴壁后按照1.2.2的方式分组处理。24 h后,在倒置显微镜下观察细胞形态、贴壁状况及细胞密度变化并拍照。吸去培养基,用磷酸盐缓冲液(PBS)洗细胞2次,分别消化和收集各组细胞,加入5 μl Annexin V-FITC和5 μl PI,混匀细胞,室温下避光孵育15 min。加入400 μl 1倍上样缓冲液后通过流式细胞仪检测细胞凋亡率。
1.3 统计学处理 采用SPSS17.0软件,多组间比较采用单因素方差分析。
2 结 果
2.1 MTT法检测各细胞存活率 多塞平组、右美托咪定组、多塞平+右美托咪定组细胞存活率分别为(51.2±2.93)%、(98.10±1.76)%和(66.26±2.12)%,正常对照组(100%)与右美托咪定组相比细胞存活率无统计学意义(P>0.05);多塞平组与正常对照组相比细胞存活率明显降低(P<0.01)。而多塞平+右美托咪定组与正常对照组相比细胞存活率也明显降低(P<0.01),但却明显高于多塞平组(P<0.01)。
2.2 倒置显微镜下观察PC12细胞形态 与正常对照组相比,右美托咪定组细胞形态无明显变化。多塞平组PC12细胞贴壁能力减弱,体积变小变圆,突起变短变小。多塞平加右美托咪定组细胞较多塞平组贴壁能力增强,体积增大,突起部分恢复,见图1。
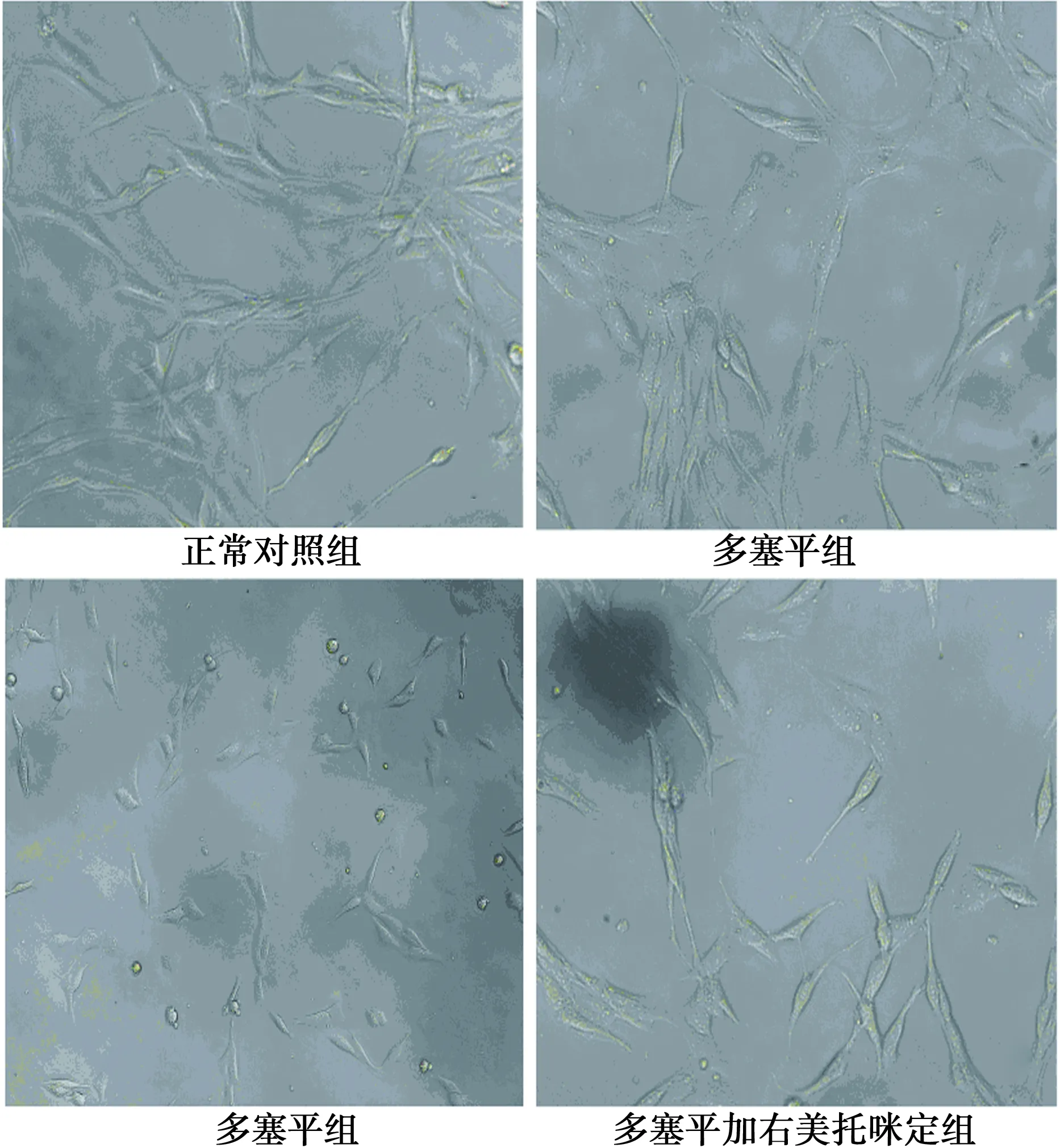
图1 PC12细胞经多塞平或(和)右美托咪定培养24 h后倒置光学显微镜下形态(×200)
2.3 流式细胞仪检测细胞凋亡率 与正常对照组〔(3.76±0.8)%〕比较,右美托咪定组细胞凋亡率〔(4.65±0.33)%〕无明显增高(P>0.05);多塞平组细胞凋亡率〔(49.5±1.24)%〕显著增高(P<0.001),多塞平右美托咪定组细胞凋亡率〔(30.34±1.05)%〕虽明显高于正常对照组(P<0.01),但明显低于多塞平加组(P<0.01)。
3 讨 论
多塞平作为三环类抗抑郁药的主要代表药物,具有与传统的局部麻醉药物类似的Na+离子通道阻断作用,局部应用时可产生较强的脊髓神经麻醉、外周神经阻滞,并且在治疗神经病理性疼痛中发挥重要作用〔1~3〕。但在前期研究中发现,多塞平在一定浓度范围内有依赖性的神经细胞毒性;使用120 μmol/L多塞平处理PC12细胞时,会导致细胞存活率降低约50%〔6〕,同时显微镜下可观察到PC12细胞贴壁能力减弱,细胞体积变小变圆,突起变短变小,因此在本研究中选用此浓度。
细胞凋亡是异于细胞坏死的另一种死亡形式,以细胞特征性的形态变化及细胞DNA片段化为重要特征。其主动性死亡程序是由多种信号通路参与完成的,Caspase介导途径与凋亡征象密切相关,在细胞凋亡过程中起至关重要的作用。本课题组前期研究结果表明,120 μmol/L多塞平孵育PC12细胞后,倒置显微镜下可见明显的细胞损伤性改变,存活率降低,凋亡率升高;给予Caspase-3抑制剂Z-DEVD-FMK孵育后,PC12细胞形态学改变减轻,存活率升高,凋亡率降低,提示Caspase-3可能介导了多塞平诱发的神经细胞凋亡〔6〕。亦有其他研究表明,细胞凋亡是脊髓神经细胞损伤作用机制之一,除此之外还包括细胞炎症反应、能量代谢障碍、钙离子超载和活性氧的大量产生等〔10,11〕。
右美托咪定是一种具有镇静、镇痛、抗焦虑、抑制交感神经兴奋性及减少应激反应作用的高选择性的α2肾上腺素受体激动药。右美托咪定可以抑制Caspase活性,增加抗细胞凋亡蛋白生成且减少了促细胞凋亡蛋白生成,最终能够降低神经细胞的凋亡率,从而增强神经细胞的生存能力〔12〕。Schoeler等〔13〕研究显示,不同剂量的右美托咪定可保护外伤性脑损伤体外海马细胞模型,在1 μmol/L时产生最大作用。因此,笔者假设能否应用右美托咪定替代Caspase-3抑制剂减少多塞平诱导的PC12细胞凋亡。
本实验结果说明右美托咪定能保护多塞平导致的神经细胞毒性改变,从另一个角度进一步证实了多塞平神经毒性可以用右美托咪定来改善。

