白花蛇舌草诱导白血病CEM细胞凋亡的分子机制
朱大诚 徐丽婷 况东 潘荣斌
(江西中医药大学,江西 南昌 330004)
白花蛇舌草(HDW)是茜草科植物,又名蛇舌草、鹤舌草、蛇针草、蛇总管、羊须草、龙舌草等。最早记载于《新修本草》第廿卷中,取名“蛇舌”。白花蛇舌草味苦、甘,性寒,归心、肝、脾经,其功效为清热解毒、利尿消肿,目前药理研究表明白花蛇舌草具有良好的抗菌消炎、抗肿瘤、调节免疫、抗化学诱变、保肝利胆等作用〔1〕。白花蛇舌草抗肿瘤作用的研究非常广泛,且多为实体瘤,但对白血病作用的研究较少〔2,3〕。前期研究〔4,5〕证明HDW能够诱导白血病CEM细胞凋亡,本实验基于细胞凋亡信号通路理论,探讨HDW是否能够通过调控细胞凋亡信号通路-死亡受体途径中相关信号分子的表达而实现诱导CEM细胞凋亡。
1 材料与方法
1.1 细胞株 白血病CEM细胞株于2006年购自中国医学科学院天津血液病研究所,并长期保存于本研究室液氮中。
1.2 药物与试剂 HDW为江西药都樟树中药饮片有限公司产品(批号:2016091212)。RPMI1640培养基为赛默飞世尔生物化学制品有限公司生产;胎牛血清为浙江天杭生物科技有限公司生产;二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自北京康为世纪生物科技有限公司;半胱氨酸-天冬氨酸蛋白酶(caspase)3、caspase8、caspase9分光光度法检测试剂盒购自南京凯基生物科技发展有限公司;抗caspase3(ab32351)、抗caspase8(ab32125)购自Abcam;β-actin(3457P)购自美国CST公司;山羊抗兔(CW0103)购自高灵敏度化学发光检测试剂盒购自北京康为世纪生物科技有限公司。
1.3 主要仪器 高速冷冻离心机(上海立申科学仪器有限公司)、CO2培养箱(型号3111,美国ThermoForma公司)、倒置显微镜(日本OLYMPUS)、去离子纯水机(SMART-Q15UT,上海和泰仪器有限公司)、多功能酶标仪(Varioskan Flash,Thermo Fisher,芬兰)、通用电泳仪(美国Bio-Rad公司)、凝胶成像系统(美国Protein Simple公司)。
1.4 方法
1.4.1 HDW水提取物的制备 HDW水提取物的制备按照参考文献〔4〕报道的方法进行提取得到HDW粉末,临用前采用灭菌三蒸水配成浓度为16.6 mg/ml的HDW水提取液。
1.4.2 凋亡酶活性测定 取对数生长期CEM细胞,用含10%血清的RPMI1640培养基调细胞密度为3×105个/ml,按每瓶14.25 ml细胞悬液分瓶,共12瓶;培养24 h后,分成12、24、36 h 3组,每组4瓶,设定HDW水提物3个浓度组〔每瓶分别加入750 μl HDW水提物,使终浓度分别为6.64 μg/ml(HDW 1组)、33.20 μg/ml(HDW 2组)、166.00 μg/ml(HDW 3组)〕和一个对照组(加入750 μl灭菌三蒸水)。加药后继续培养,分别于12、24、36 h提取作用相应时间的蛋白,用BCA蛋白试剂盒测定并计算蛋白浓度。根据分光光度法检测试剂盒说明书进行操作,检测凋亡酶caspase3、caspase8、caspase9的活性。
1.4.3 凋亡酶蛋白的检测 细胞培养、实验细胞密度、分瓶(分组)及细胞数量、药物浓度等同实验方法1.4.2。加药继续培养,分别于6、12、24 h提取相应时间蛋白,用BCA蛋白试剂盒测定蛋白含量并计算蛋白浓度,得出相应上样量,进行免疫印迹实验。应用Alpha View SA软件对免疫印迹实验得到的条带进行分析,以β-actin作为内参,目的蛋白灰度值/内参灰度值即为目的蛋白的半定量表达。
1.5 统计学分析 采用SPSS19.0软件进行单因素方差分析、t检验。
2 结 果
2.1 凋亡酶的活性 HDW 1、2、3组caspase3、caspase8活性表达量A值明显高于对照组(P<0.05),在同一时间,随HDW水提物浓度增加,caspase3、caspase8的活性表达量也随之增强(P<0.05);对于同一HDW浓度,caspase3、caspase8的活性在24 h时最大,其后酶活性开始逐渐下降(P<0.05)。caspase9活性表达A值随时间、药物浓度的变化没有明显改变,与对照组比也没有统计学意义(P>0.05)。见表1~3。
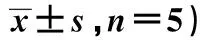
表1 HDW水提物对caspase3活性的影响(A值,
与对照组比较:1)P<0.05;与HDW 1组比较:2)P<0.05;与HDW 2组比较:3)P<0.05;与12 h比较:3)P<0.05;与24 h比较:4)P<0.05;表2、3同
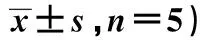
表2 HDW水提物对caspase8活性的影响(A值,
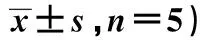
表3 HDW水提物对caspase9活性的影响(A值,
2.2 caspase3、caspase8蛋白的表达 随药物浓度的增加和作用时间的延长,凋亡酶蛋白caspase3、caspase8的表达与内参β-actin的比值与对照组比较逐渐增大,表明caspase3、caspase8蛋白的表达呈上升趋势,且与对照组比较差异有显著意义(P<0.05)。见图1,表4。
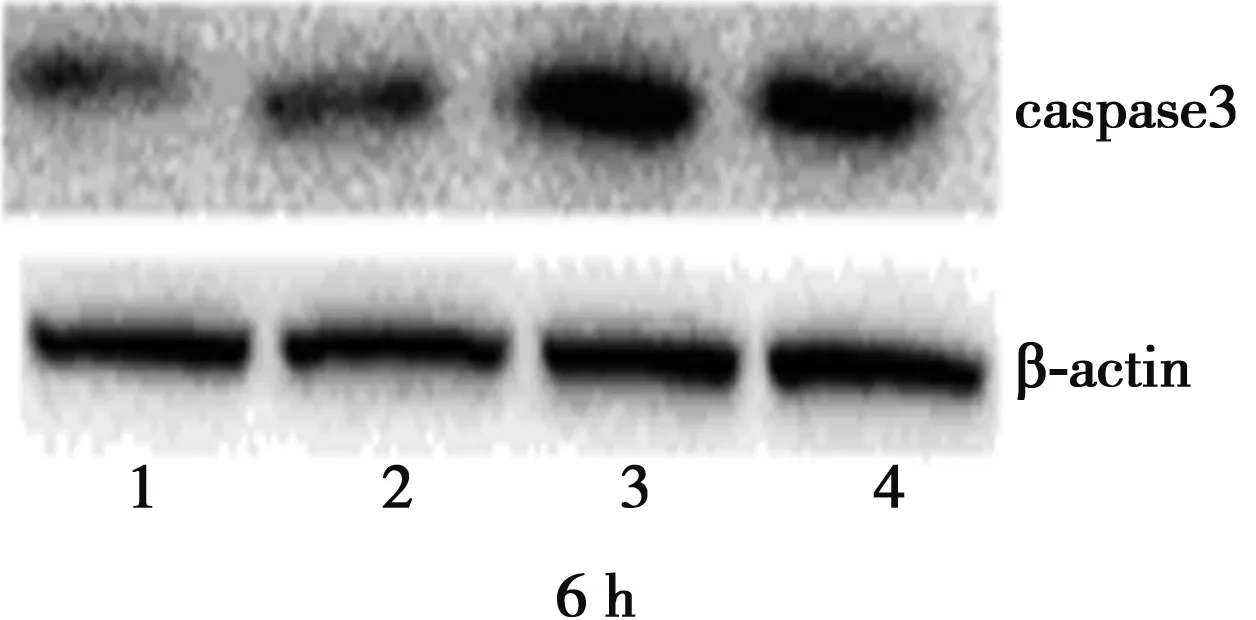

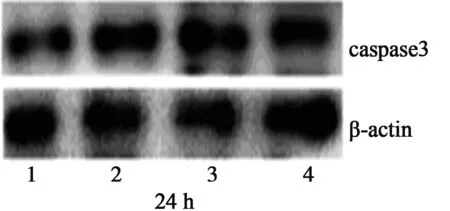
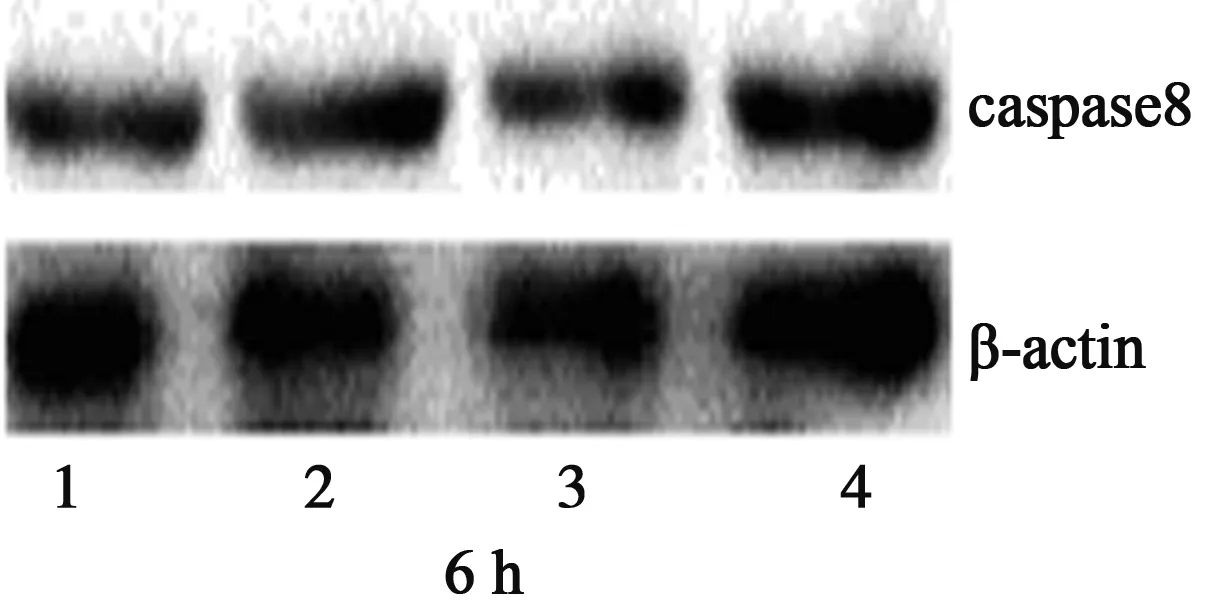
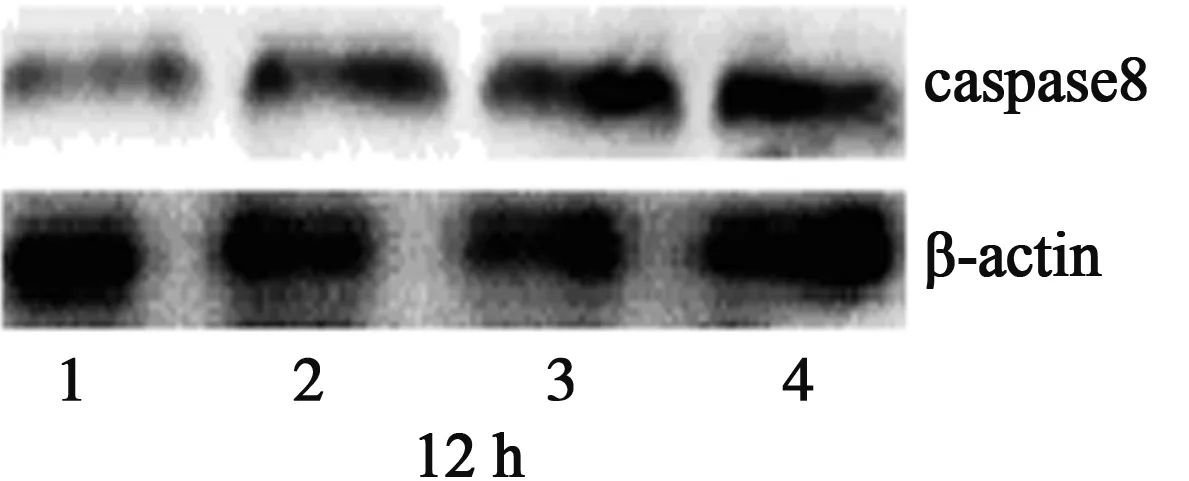
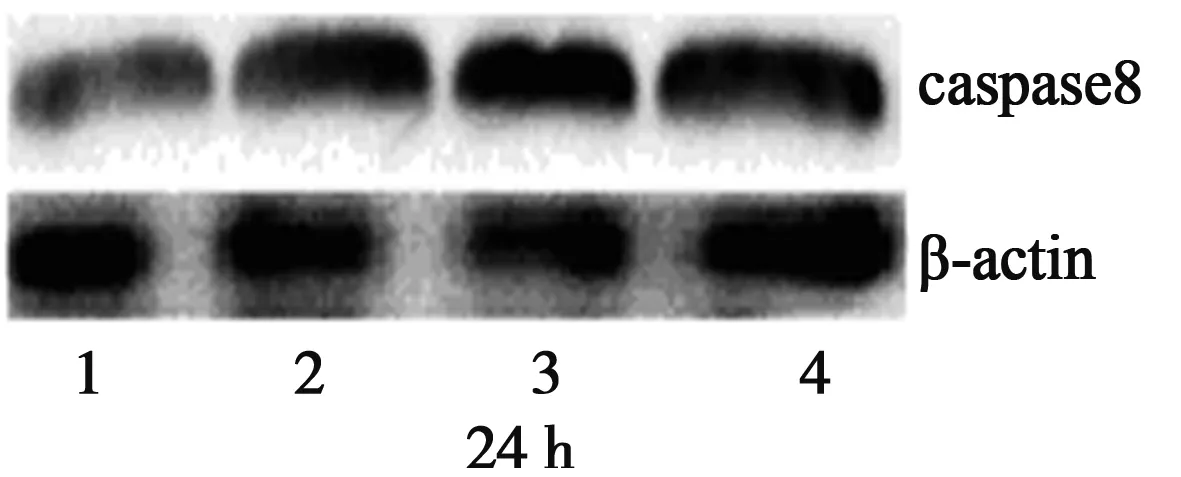
1~4:对照组、HDW 1组、HDW 2组、HDW 3组
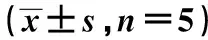
表4 HDW水提取物对caspase3、caspase8蛋白表达的影响
与6 h比较:1)P<0.05;与12 h比较:2)P<0.05;与对照组比较:3)P<0.05;与HDW 1组比较:4)P<0.05;与HDW 2组比较:5)P<0.05
3 讨 论
肿瘤细胞凋亡受阻是导致肿瘤的快速生长和治疗困难的主要原因。细胞凋亡信号通路主要包括3条途径,即线粒体途径、内质网途径及死亡受体途径,这3条途径之间相互联系,并交汇于下游的凋亡酶蛋白caspase3。线粒体途径可由外界的刺激释放细胞色素C后引起一系列的反应。内质网途径主要包括应激活化蛋白激酶(JNK)、增强子结合蛋白同源蛋白(CHOP)和caspase信号通路。死亡受体途径是指通过特定的死亡配体与细胞膜上相应的死亡受体结合、相互作用而介导,从而激活细胞内的凋亡酶caspase:起始酶caspase8激活caspase3;或者切割B淋巴细胞瘤家族成员中的B淋巴细胞瘤2基因抑制性含bh3结构域蛋白引起线粒体释放细胞色素c,增强caspase9的表达使caspase3活化,进而引起凋亡酶caspase的级联反应,从而导致细胞凋亡的一条信号通路〔6,7〕。
本实验说明24 h之前caspase3、caspase8的活性逐渐增强,而在24 h之后此两种酶的活性可能开始下降。细胞凋亡信号通路中,其中凋亡酶caspase8是死亡受体途径的关键酶;凋亡酶caspase9既是线粒体途径的关键酶,又是死亡受体途径的关键酶;内质网途径的关键酶是caspase12;而凋亡酶caspase3是3条凋亡路径的共同交汇点〔6〕。本实验推测HDW水提物诱导CEM细胞凋亡,可能不是通过线粒体途径来实现的。HDW可能是通过调控细胞凋亡信号通路中死亡受体途径的特定死亡配体与细胞膜表面的相应死亡受体结合,从而激活胞内的凋亡酶caspase8的活性,级联反应升高凋亡酶caspase3的活性而导致白血病CEM细胞凋亡。内质网途径是否介导了这一作用还有待于深入研究。

